不同死因大鼠心肌内多种RNA相对表达量变化与PMI的关系
2014-04-08吕叶辉张恒潘晖马开军李文灿陈文峰江洁清薛爱民张萍王慧君陈龙
吕叶辉,张恒,潘晖,马开军,李文灿,陈文峰,江洁清,薛爱民,张萍,王慧君,陈龙
(1.复旦大学上海医学院法医学系,上海200032;2.上海市公安局刑事科学技术研究所法医室,上海200043;3.上海市公安局浦东分局刑事科学技术研究所,上海200135;4.复旦大学附属儿科医院,上海201102)
死亡时间(PMI)是指发现、检查尸体时距死亡发生时的时间间隔,PMI的准确推断具有重要的法医学实践价值,一直是法医病理学研究的重点和难点之一。利用传统的方法进行PMI的推断一直受到各种因素的制约,如环境温度、湿度、机体内在因素等,导致推断的准确性和精确性较低。随着分子生物学技术在法医学领域的广泛应用,利用生物体内RNA的时间依赖性降解规律推断PMI正逐渐成为目前研究的热点。
实时荧光定量PCR作为核酸的精确定量技术,拥有准确、高效的优点,被越来越多地应用于PMI的推断[1-2],但是目前研究PMI的动物模型较为单一,通常只考虑温度因素的影响,而针对不同死亡原因的研究较少,故实际应用受限[3]。本研究通过构建断颈死、窒息死和失血性休克死的大鼠模型,利用实时荧光定量PCR技术检测各RNA相对表达量与PMI的关系,以期为不同死因下PMI的推断提供一种新的思路。
1 材料与方法
1.1 试剂与仪器
RNAlater保护液(美国Ambion公司),TRIzol试剂盒(美国Invitrogen公司),PrimeScriptTMRT试剂盒(日本TaKaRa公司),SYBR®Premix Ex TaqTM试剂盒(日本TaKaRa公司),DEPC水(焦碳酸二乙酯处理并经高温高压灭菌的MiliQ纯水)。NanoDrop 1000分光光度计(美国Thermo公司),7500型实时荧光定量PCR仪(美国AB公司),geNorm PLUS软件(比利时Biogazelle公司)。
1.2 实验动物分组
成年健康SD大鼠135只,雄性,体质量在250 g左右,由复旦大学上海医学院动物实验中心提供。按照随机的原则将大鼠分为断颈组、窒息组和失血性休克组,每组45只,并将断颈组作为对照。
1.3 动物模型的建立及处理
断颈死模型:用一手拇指和食指用力往下按住鼠头,另一只手抓住鼠尾,用力向后上方拉动,造成脊髓横断致死。
窒息死模型:用直径3mm尼龙绳打一个可滑动的活套,上端固定于横杠上,将大鼠颈部放入活套内并使其背对活结,大鼠依靠自身重力拉紧活套,造成窒息死亡[4]。
失血性休克死模型:采用传统的Wiggers改良法,在大鼠处死前12h禁食,50mg/kg戊巴比妥钠腹腔注射麻醉。麻醉后仰卧固定于大鼠板上,分离出右侧股动脉,插入三通管,三通管连接血压计观察血压、连接注射器用于放血,肝素钠500U/kg抗凝。术毕稳定10 min后开始放血,10 min左右血压降至5.3 kPa(40mmHg),维持3h后立即处死大鼠。
尸体保存于室温(25±2)℃的环境下。各组分别在死后0、3、6、12、24、36、48、72、96 h提取大鼠心肌组织(每个时间点5只大鼠),分装于RNAlater保护液中,置于-80℃冻存。
1.4 RNA的提取与cDNA的合成
取冻存组织(约30 mg),按照TRIzol试剂盒总RNA提取说明书操作步骤提取总RNA,NanoDrop 1000分光光度计测定RNA的浓度及纯度,并计算单位质量心肌下RNA得率。取RNA样本500ng进行反转录,按照PrimeScriptTM试剂盒说明书配置10 μL反应体系。反转录条件为37℃15min,85℃5s,1个循环。
1.5 引物的设计与合成
共选择7种RNA指标,分别为甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、β-肌动蛋白(β-actin)、缺氧诱导因子-1(hypoxia-inducible factor-1,HIF-1)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、U6微核RNA(U6 small nuclear RNA,U6 snRNA)。根据GenBank提供的上述大鼠mRNA序列及U6 snRNA序列设计引物。引物设计除U6 snRNA外至少跨一个外显子或外显子区域以保证目的cDNA的正确合成与扩增,所有引物均选择在RNA序列的3′端附近且经Blast验证,扩增片段长度都在400bp以下。引物由上海生工生物工程有限公司合成,引物序列见表1。

表1 选取的指标及引物序列
1.6 实时荧光定量PCR
应用SYBR®Premix Ex TaqTM试剂盒进行实时荧光定量PCR反应。按说明书配制20μL反应体系:SYBR®Premix Ex Taq 10μL、上游引物0.4μL、下游引物0.4 μL、ROX Reference DyeⅡ0.4 μL、cDNA模板1μL、双蒸灭菌水7.8μL。应用7500型实时荧光定量PCR仪进行两步法扩增,扩增条件:95℃30s;95℃5s,60℃34s,40个循环。每个样本重复3次,结果由系统自动生成,从而得到各个指标的循环阈值(threshold cycle,Ct)。
1.7 统计学分析
采用geNorm PLUS软件对7个RNA指标的Ct值进行计算,将基因表达稳定度的平均值M最小的指标作为内对照。各个样本其他RNA指标与选出内对照的Ct差值记做ΔCt,另选取断颈组PMI为0时的样本为对照样本,各样本和对照样本的Ct差值记作ΔΔCt,各指标的相对表达量通过公式2-ΔΔCt计算得到。采用SPSS v18.0软件(美国SPSS公司)进行统计分析,三组间运用单因素方差分析,两组间运用t检验进行差异性分析,检验水准α=0.05。
2 结果
2.1 总RNA得率及实时荧光定量PCR结果
从135个心肌样本中成功提取总RNA,并加入30 μL DEPC水溶解。经NanoDrop 1000分光光度计测定所有RNA样本的D260/D280在1.8~2.1,且所有D260/D280>2.0的均在死后36 h,证明RNA纯度和完整性相对较好。单位质量心肌下,断颈组RNA质量为180~340 ng/mg,窒息组为200~330 ng/mg,失血性休克组为160~350ng/mg,三组之间RNA得率差异无统计学意义(P>0.05)。所有样本均成功反转,对反转后的cDNA进行7个指标的实时荧光定量PCR检测,重复3次,得到Ct值,结果证实扩增曲线和溶解曲线完好,表明样本均成功特异性扩增。
2.2 内对照的选择
采用geNorm PLUS软件对7个指标的Ct值进行统计学处理,得到不同组别的M值,见表2。M值越小,指标的表达水平越稳定,三组中U6 snRNA的M值都是最小的。U6 snRNA表达稳定,受PMI和死亡原因的影响较小,故将其作为内对照。
2.3 不同死因下各RNA相对表达量与PMI的关系
断颈、窒息和失血性休克组均按照1.7项计算公式方式处理,各指标相对表达量与PMI的关系,见表3~8。

表2 各组7个指标M值稳定性评估
表3 GAPDH在各组的相对表达量与PMI的关系(n=5,±s)
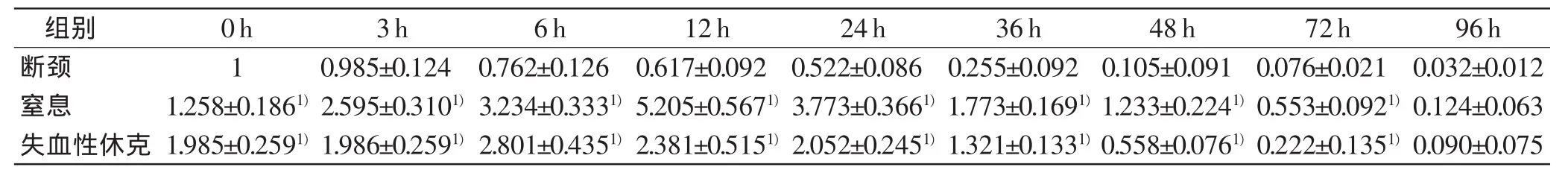
表3 GAPDH在各组的相对表达量与PMI的关系(n=5,±s)
注:1)与相同死亡时间断颈组比较,P<0.05
组别0h3h6h12h24h36h48h72h96h断颈10.985±0.1240.762±0.1260.617±0.0920.522±0.0860.255±0.0920.105±0.0910.076±0.0210.032±0.012窒息1.258±0.1861)2.595±0.3101)3.234±0.3331)5.205±0.5671)3.773±0.3661)1.773±0.1691)1.233±0.2241)0.553±0.0921)0.124±0.063失血性休克1.985±0.2591)1.986±0.2591)2.801±0.4351)2.381±0.5151)2.052±0.2451)1.321±0.1331)0.558±0.0761)0.222±0.1351)0.090±0.075
表4 β-actin在各组的相对表达量与PMI的关系(n=5,±s)
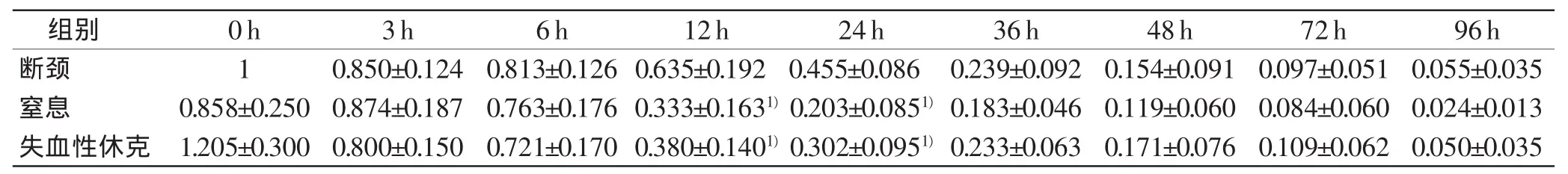
表4 β-actin在各组的相对表达量与PMI的关系(n=5,±s)
注:1)与相同死亡时间断颈组比较,P<0.05
6h12h24h36h48h72h96h组别0h3h断颈10.850±0.1240.813±0.126 0.635±0.1920.455±0.0860.239±0.0920.154±0.0910.097±0.051 0.055±0.035窒息0.858±0.250 0.874±0.1870.763±0.176 0.333±0.1631)0.203±0.0851)0.183±0.0460.119±0.0600.084±0.060 0.024±0.013失血性休克1.205±0.300 0.800±0.1500.721±0.170 0.380±0.1401)0.302±0.0951)0.233±0.0630.171±0.0760.109±0.062 0.050±0.035
表5 HIF-1在各组的相对表达量与PMI的关系(n=5,±s)

表5 HIF-1在各组的相对表达量与PMI的关系(n=5,±s)
注:1)与相同死亡时间断颈组比较,P<0.05;“-”代表未测到
组别0h3h6h12h24h36h48h72h96h断颈11.120±0.1240.813±0.1260.635±0.0920.355±0.0860.239±0.0920.154±0.051--窒息1.216±0.1261)1.415±0.2871)1.316±0.1761)0.986±0.0631)0.803±0.0851)0.723±0.0461)0.419±0.0601)0.084±0.0300.034±0.013失血性休克1.535±0.2151)1.773±0.1001)2.129±0.1701)1.725±0.1401)1.355±0.0951)0.875±0.0631)0.512±0.0761)0.109±0.0420.050±0.015
表6 iNOS在各组的相对表达量与PMI的关系(n=5,±s)

表6 iNOS在各组的相对表达量与PMI的关系(n=5,±s)
注:1)与相同死亡时间窒息组比较,P<0.05;“-”代表未测到
组别0h3h6h12h24h36h48h72h96h断颈---------窒息11.215±0.0871.982±0.1761.458±0.0631.850±0.2850.592±0.0460.359±0.0600.184±0.0600.083±0.033失血性休克1.893±0.2581)2.573±0.2201)2.129±0.1701.725±0.1401.655±0.0950.875±0.0630.212±0.1760.221±0.062 0.240±0.0351)
表7 TNF-α在各组的相对表达量与PMI的关系(n=5,±s)

表7 TNF-α在各组的相对表达量与PMI的关系(n=5,±s)
注:1)与相同死亡时间断颈组比较,P<0.05
组别0h3h6h12h24h36h48h72h96h断颈10.858±0.1211.126±0.2550.759±0.1950.659±0.1460.718±0.2660.346±0.1010.226±0.0940.113±0.085窒息1.512±0.1261)1.215±0.3871)1.982±0.1761)1.458±0.0631)1.850±0.2851)0.592±0.0460.359±0.0600.184±0.0600.083±0.033失血性休克4.589±0.3251)3.120±0.2201)3.570±0.5701)2.725±0.1401)1.655±0.5951)0.875±0.0630.212±0.1760.221±0.0620.240±0.035
表8 IL-6在各组的相对表达量与PMI的关系(n=5,±s)
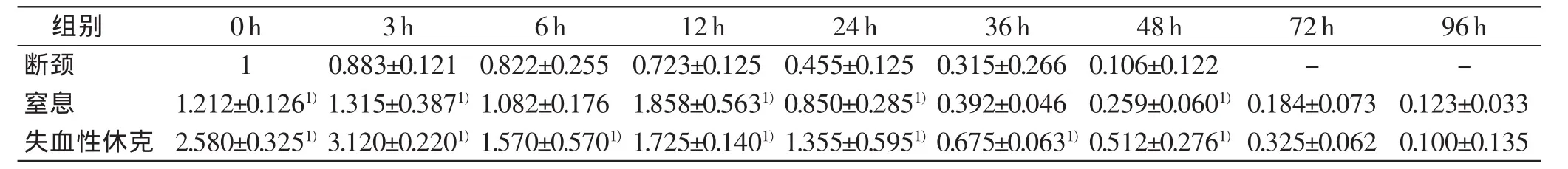
表8 IL-6在各组的相对表达量与PMI的关系(n=5,±s)
注:1)与相同死亡时间断颈组比较,P<0.05;“-”代表未测到
组别0h3h6h12h24h36h48h72h96h断颈10.883±0.121 0.822±0.2550.723±0.1250.455±0.1250.315±0.2660.106±0.122--窒息1.212±0.1261)1.315±0.3871)1.082±0.1761.858±0.5631)0.850±0.2851)0.392±0.0460.259±0.0601)0.184±0.0730.123±0.033失血性休克2.580±0.3251)3.120±0.2201)1.570±0.5701)1.725±0.1401)1.355±0.5951)0.675±0.0631)0.512±0.2761)0.325±0.0620.100±0.135
GAPDH的相对表达量在断颈组随PMI延长呈逐渐下降趋势,24h约为0h的0.5倍;窒息组相对表达量在12h达到峰值,此后随PMI延长不断下降,在72h内均高于断颈组(P<0.05);失血性休克组变化趋势与窒息组相似,但峰值出现在6h,各时间点相对表达量较窒息组低(P<0.05),但较断颈组高(P<0.05)。
β-actin的相对表达量在三组中均随着PMI延长不断下降,各时间点变化基本一致,几乎不受死亡原因的影响。
HIF-1的相对表达量在断颈组随PMI延长逐渐下降的趋势,在72h后已检测不出;窒息组HIF-1相对表达量的峰值出现在3 h,约为对照0 h的1.4倍,此后随PMI延长不断降低,在48 h前略高于断颈组(P<0.05);失血性休克组在24h前均处于高水平表达,峰值出现在6 h,约为对照0 h的2.1倍,此后HIF-1的相对表达量逐渐降低。
iNOS的相对表达量在断颈组各个时间点均检测不出,故将窒息组0 h样本作为对照;窒息组和失血性休克组在24h前表达水平均增高,峰值分别出现在6h和3h,36h之后相对表达量逐渐降低;失血性休克组在0h和3h较窒息组相对表达量增高(P<0.05)。
TNF-α的相对表达量在断颈组36h前保持相对稳定,此后不断下降;窒息组的峰值出现在6 h,约为对照0 h的2倍,其在24 h前都保持较高的表达;失血性休克组的峰值出现在死后即刻(0 h),约为断颈组的4.6倍,之后相对表达量随PMI延长不断降低,但在24h前表达水平都高于对照0h(P<0.05)。
IL-6的相对表达量在断颈组随PMI延长而降低,在72h后检测不到;窒息组在12 h达到峰值,约为对照0h的1.9倍,此后IL-6的相对表达量逐渐降低;失血性休克组在24 h前都处于高表达状态(P<0.05),在3 h达到峰值,约为对照0 h的3.1倍,此后逐渐降低。
3 讨论
近年来随着分子生物学的发展,利用生物体内大分子如DNA、RNA和蛋白质等来推断PMI是当前研究的热点,尤其是依据RNA的时间依赖性推断PMI已经取得了一定进展[5]。但是目前对RNA推断PMI的研究主要停留在动物模型上,通常的处死方式为断颈死,而针对其他不同死因的研究较少。本研究在将断颈死动物模型作为对照的基础上,探讨了窒息和失血性休克这两种较常见的死因对死后特定RNA表达量的影响,而模型的成功建立是研究死因对PMI影响的前提。窒息死采用了缢死的动物模型,大鼠在套上活套后6min内死亡,尸僵出现较早,与文献[4]报道一致。失血性休克模型在经典的Wiggers改良法基础上,降压稳定后维持3h,以模拟失代偿期的失血性休克即不可逆性休克。多种死因下的研究可以提高PMI推断的灵敏度和精确度,从而增加其实际应用价值。
实时荧光定量PCR技术在检测基因表达水平时有很好的灵敏性与特异性,与传统的半定量RT-PCR技术相比,具有高效稳定的优点,利用Ct值与起始模板浓度的对数呈反比关系来计算RNA的表达水平,可有效避开平台反应带来的误差,是理想的定量技术。主要影响其结果的两大因素是人为操作误差和内对照的选择。因此在每个样本重复3次以减小误差的基础上,内对照的选择对RNA表达的准确定量是至关重要的。geNorm PLUS软件是选择内对照的良好工具,被广泛应用于基因表达的分析[6]。该软件可以计算基因平均表达稳定度,并对所有候选内对照的表达稳定性进行排序。本研究选取的7个指标中,U6 snRNA的M值在3个组别中都是最小的,说明其受死亡原因和PMI的影响都相对较小,与人体心肌组织中的研究结果[7]一致。U6 snRNA是核内小RNA,长度只有100~200bp,只存在于细胞核内,通常状态snRNA不是游离存在,而是与蛋白质结合成复合物,形成小核核糖核蛋白(small nuclear ribonucleoprotein particle,snRNP),这为U6 snRNA提供了一个相对稳定的环境,接触核酶的机会较少,不易受内外环境的影响而降解[8]。U6 snRNA在生物体内表达稳定而且高度保守,是理想的内对照,可用其排除个体差异带来的误差,使统计结果更加客观、准确。
利用U6 snRNA作为内对照,计算出各个指标在不同PMI下的相对表达量,其随死因的不同呈现出特异性的改变。在死亡24h之前,断颈组各指标皆呈现缓慢下降的趋势,而窒息组和失血性休克组的各指标(除β-actin)呈现不同程度的增高趋势;在死亡24 h之后,各指标不论组别都随着PMI延长而不断降低,这说明在死亡早期时间内,体内RNA的转录表达并没有停止,而是随着死因的不同而呈现不同的改变,之后细胞彻底死亡,随着核酶持续释放,RNA时序性的降解,各指标相对表达量随着PMI延长不断降低。
GAPDH和β-actin是管家基因,在体内呈高丰度且稳定的表达,是普通分子生物学实验定量mRNA表达时常用的内对照[9]。本研究发现β-actin在3个组内表达几乎没有差异,均随着PMI不断降低。这说明β-actin作为细胞骨架的基本成分,受死因的影响较小,但与PMI的线性关系良好,可作为推断PMI的指标。而各时间点下GAPDH的相对表达量表现为窒息组>失血性休克组>断颈组,说明缺氧会引起GAPDH表达上调,而且窒息造成的缺氧程度要比失血性休克造成的缺氧更为严重。GAPDH作为糖酵解的关键酶在缺氧情况下表达上调,可提高葡萄糖的利用率和转运利用,以补偿缺氧时ATP的下降,从而改善缺氧时的能量代谢过程[10]。在死亡模型下,虽然机体已经死亡,但是组织细胞仍能保持一定的生物活性,故细胞依然能感受缺氧的状态,在死亡早期GAPDH可不断增高。
HIF-1是受缺氧诱导的关键因子,在通常状态下其α亚基通过泛素-蛋白酶体系迅速降解,但在缺氧状态下HIF-1 α亚基降解受阻聚集,有报道[11]称其早期调节主要通过蛋白转录后水平而不是通过mRNA的转录水平增加表达。本研究证实HIF-1在窒息组表达增高不明显,峰值出现在死后3h且只有对照0h的1.4倍,与张更谦等[4]的研究一致,推测是窒息造成的缺氧状态并不能刺激心肌细胞RNA转录的升高,而是在蛋白水平有所增高。HIF-1在失血性休克组在24 h前均处于高表达水平,这与我们采用的模型有关,即降压稳定后维持3h,失血性休克已达到失代偿期即不可逆性期。有研究[12]表明,HIF-1在严重失血性休克中参与了能量代谢、炎症反应失控和脂质过氧化损伤的途径,而不是单纯的缺氧,故其可能在死后一定时间内呈现出转录水平的增高。
iNOS在基本状态下不表达或者表达量很低,但在缺氧、损伤、炎症介质、内毒素等因素刺激下,编码基因被激活,可在一定时间内持续表达mRNA[13]。在断颈组iNOS均检测不到表达,在窒息组和失血性休克组24 h前持续表达增高,说明缺氧可以导致iNOS成倍表达增加。失血性休克组在3h前较窒息组表达增高,可能是重症失血性休克组除了缺血缺氧之外,已经有全身不同程度的全身炎症反应发生,而iNOS正是促炎反应的核心分子。
TNF-α和IL-6作为体内重要的细胞因子,介导参与体内多种生物学反应,如抗肿瘤和调节机体免疫功能等,同时在失血性休克中促进着炎症的发生,也被称为促炎细胞因子[14-15]。正常情况下,单核巨噬细胞内含有少量TNF-α的mRNA,受炎性刺激能快速上调mRNA表达。本研究发现,在单纯的窒息缺氧下,TNF-α表达也可以上调且窒息组的峰值出现在HIF-1峰值之后,推测是作为HIF-1的下游因子,TNF-α可在缺氧状态下被诱导而表达增高,与余娴[14]的研究一致。在失血性休克组,TNF-α在0h已处于最高峰,且高于窒息组,Yao等[15]认为,失血性休克发生30 min TNF-α水平已经开始升高,其可能是炎症介质连锁反应中最早的启动因子,故在死后0h已达到高峰。IL-6是一种重要的急性反应期炎症介质,多在受到TNF-α刺激后产生,同时也可以对TNF-α进行反馈调节,调控网络相对复杂[15]。IL-6在窒息组和失血性休克组的峰值皆晚于TNF-α出现,推测其可能是随着TNF-α的上调而增高。
用一种死亡模型来推断PMI,可用的指标就会比较少,相应推断的精确度也会降低,因此推广应用受到限制。在窒息和失血性休克状态下,体内的多种RNA参与了组织细胞缺血、缺氧、炎症反应等一系列复杂的病理生理变化,而且在死后也能维持一段时间。这其中的一些RNA指标在不同的死因下呈现出了有意义的变化趋势,其表达量与PMI的特定关系可提高利用RNA来推断PMI的准确性和可靠性,并能为死因的分析提供一定的实验依据。
本研究通过实时荧光定量PCR技术对断颈死、窒息死、失血性休克死大鼠不同PMI心肌内各RNA指标相对表达量的研究发现:U6 snRNA表达量非常稳定,受PMI和死因的影响较小,适合作为内对照。在死亡早期,GAPDH、HIF-1、iNOS、TNF-α和IL-6的表达量在窒息组和失血性休克组比断颈组呈现不同程度的增加,且峰值出现的时间点不同,而β-actin在3个组皆呈现表达量下降趋势。在死亡晚期,随着mRNA的不断降解,表达量持续下降。各RNA表达量特征性的变化可为不同死因下PMI的推断提供参考。如何选择、优化各RNA指标并综合应用于不同死因下人体样本的PMI推断,是我们进一步研究的方向。
(本研究受复旦大学研究生创新基金项目资助。)
[1]Zhao D,Ishikawa T,Quan L,et al.Postmortem quantitative mRNA analyses of death investigation in forensic pathology:an overview and prospects[J].Leg Med(Tokyo),2009,11(S1):43-45.
[2]李文灿,马开军,张萍,等.大鼠心肌组织中microRNA和18S rRNA的降解与死亡时间的相关性[J].法医学杂志,2010,26(6):413-417.
[3]Maeda H,Zhu BL,Ishikawa T,et al.Forensic molecular pathology of violent deaths[J].Forensic Sci Int,2010,203(1-3):83-92.
[4]张更谦,周斌,杜冰,等.鼠窒息后缺氧诱导因子1-α在心、肺中的表达[J].法医学杂志,2006,22(6):407-410.
[5]张恒,李文灿,张萍,等.组织RNA检测用于死亡时间推断的研究进展[J].中国法医学杂志,2012,27(4):292-295.
[6]Vandesompele J,De Preter K,Pattyn F,et al.Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J].Genome Biol,2002,3(7):Research0034.
[7]张萍,马开军,张恒,等.实时RT-PCR常用内对照在死亡早期人心肌内的稳定性[J].法医学杂志,2012,28(2):81-84.
[8]Burke JE,Sashital DG,Zuo X,et al.Structure of the yeast U2/U6 snRNA complex[J].RNA,2012,18(4):673-683.
[9]Romanowski T,Markiewicz A,Bednarz N,et al.Housekeeping genes as a reference in quantitative real-time RT-PCR[J].Postepy Hig Med Dosw(Online),2007,61:500-510.
[10]Sirover MA.New insights into an old protein:the functionaldiversityofmammalianglyceraldehyde-3-phosphate dehydrogenase[J].Biochim Biophys Acta,1999,1432(2):159-184.
[11]Greijer AE,van der Groep P,Kemming D,et al.Up-regulation of gene expression by hypoxia is mediated predominantly by hypoxia-inducible factor 1(HIF-1)[J].J Pathol,2005,206(3):291-304.
[12]Hierholzer C,Billiar TR.Molecular mechanisms in the early phase of hemorrhagic shock[J].Langenbecks Arch Surg,2001,386(4):302-308.
[13]Iadecola C,Zhang F,Casey R,et al.Inducible nitric oxide synthase gene expression in vascular cells after transient focal cerebral ischemia[J].Stroke,1996,27(8):1373-1380.
[14]余娴.缺氧通过HIF-1α诱导心肌细胞分泌TNF-α的机制研究[D].武汉:华中科技大学,2010.
[15]Yao YM,Redl H,Bahrami S,et al.The inflammatory basis of trauma/shock-associated multiple organ failure[J].Inflamm Res,1998,47(5):201-210.
