金边黄杨和大叶黄杨的光能吸收分配特征及其机制分析
2014-04-08张开明祝亚军李永华李永刚
张开明,王 珂,祝亚军,李永华,李永刚
(1.河南农业大学林学院,河南 郑州 450002;2.河南省林业科学研究院,河南 郑州 450002;3.郏县农业局,河南 平顶山 467100 )
斑叶植物是指植物叶面上呈现出异色斑点或条纹的植物[1],因具有较高的观赏价值而被广泛应用于城市绿化中.叶片特殊斑块的形成与叶绿素及花色素等色素含量或成分发生有关,其中黄、白斑主要由叶绿素a和叶绿素b的降解引起,而橙至红斑则是由于类胡萝卜素和花色素的积累引起.研究表明大部分彩叶植物的叶片中基粒发育不良,LHCⅡ色素蛋白复合物的单体和三聚体明显减少,突变体的天线系统相对较小、捕光效率较低,且PSⅡ活性低于正常绿色叶片[2].彩叶植物的光合能力一般较绿色植物低,通常认为是由叶色突变减少了捕光色素蛋白复合体的含量,因而影响到光系统Ⅱ供体侧的稳定性而造成的[3].外部环境因素(光照、温度、水分等)对植物叶片色素含量具有显著地影响,已有研究表明,许多斑叶植物的斑点(块)在强光下较为清晰,而遮阴或者光照不足时则斑点(块)面积比例减小甚至完全消失[4,5],这表明斑块的出现有可能是对强光的一种防御机制.而斑叶植物叶片的斑点(块)区域叶绿素含量往往显著减少,如花叶芒(Miscanthussinensis‘Varigatus’)[5]和秋海棠(Begonia)[6]等,从而削弱了叶片的光合能力[7].大叶黄杨(Euonymusjaponica)在栽培过程中因叶片叶绿素含量减少而形成了一个栽培品种金边黄杨(E.japonicacv. Aure-ma),其叶片边缘能较长时间地呈现金黄色,为园林绿化中用途非常广泛的一种斑叶植物.庄猛等[7]研究表明金边黄杨总叶绿素含量极显著低于大叶黄杨.还有报道认为花叶类植物的白色或黄色部分几乎没有光合能力,而只是作为叶片光合作用产物的一个“库”[8,9],然而金边黄杨的黄色边缘区域的光合特性尚不清楚.因此,本研究对金边黄杨黄色边缘区域的光合特性进行探讨,旨在为斑叶植物光合特性的栽培生产及园林应用提供理论基础.
1 材料与方法
1.1材料
本试验采用5 a生,长势一致的金边黄杨和大叶黄杨健康植株为材料.
1.2方法
试验选用金边黄杨与大叶黄杨植株的2 a生枝条第2对长势一致的叶片为材料,进行色素、叶黄素含量和叶绿素荧光参数的测定和切片观察.
光抑制试验用金边黄杨与大叶黄杨的离体叶片进行处理:所有叶片先置于正常的环境中(温度为25 ℃,光照为400 μmol·m-2·s-1),稳定2 h后,再置于模拟光抑制环境中(温度为13 ℃,光照为1 000 μmol·m-2·s-1),4 h后,再放置在正常环境中恢复3.5 h.整个过程保证叶柄基部一直处于水中,并分别在光抑制前、光抑制后、恢复后测定叶绿素荧光参数.
1.3叶绿素荧光参数测定
叶片暗适应30 min后,用Imaging-PAM(Walz公司,德国)调制式荧光成像系统,以LED作为光源测定叶绿素荧光参数.
试验所用光化光和饱和脉冲光的光合有效辐射(Photosynthetic Active Radiation PAR)分别为185 μmol·m-2·s-1和4 000 μmol·m-2·s-1叶片吸光值直接测定读数;参照AIT等[10]的方法计算光系统Ⅱ光化学量子效率(ΦPSⅡ),可调节的能量耗散量子效率,即非光化学量子效率(ΦNPQ),不可调节的能量耗散量子效率(ΦNO)等参数;参照KOOTEN等[11]的方法计算暗适应下PSⅡ最大光化学效率(Fv/Fm).
1.4色素含量测定
采用ARNON[12]的方法,用直径为0.864 cm的打孔器在每片叶上取5片样品,测定叶绿素a(Chla)、叶绿素b(Chlb)和类胡萝卜素(Car)含量.用80 % 丙酮提取,UV-2410 PC分光光度计(Shimadzu公司,日本)分别测定445,644和662 nm处的吸光值,并计算叶绿素和类胡萝卜素的含量.
1.5叶黄素含量测定
分别取金边黄杨与大叶黄杨叶片的绿色区域和金边黄杨的黄色边缘进行叶黄素各组分含量的测定.叶黄素循环色素(紫黄质V,Violaxanthin;环氧玉米黄质A,Anroxanthin;玉米黄质Z,Zeaxanthin)用丙酮在黑暗中研磨提取2 500 g离心10 min后,上清液用FA 0.45 pm的微孔滤膜过滤,采用THAYER等[13]的方法用高效液相色谱法测定.叶黄素循环的脱环氧化程度用(A+Z)/(V+A+Z)表示.
1.6显微切片
从金边黄杨的植株上取正常健康的叶片,用锋利的双面刀片切成约50 μm宽的切片,以水封片,用正置荧光显微镜(Leica MZ 95,德国)观察,用彩色相机(Leica DFC 300FX,德国)输出图像,背景用Adobe Photoshop 7.0(Adobe System,美国)处理.
1.7统计分析
所有数值均以平均值±标准差表示,每测定重复5次,采用DPS3.01软件进行分析,用邓肯测验进行差异显著性分析(P<0.05).
2 结果与分析
2.1金边黄杨与大叶黄杨色素含量和光能吸收差异
金边黄杨与大叶黄杨其不同区域的叶绿素含量差异如表1所示.就绿色区域来说,金边黄杨的各色素(Chla ,Chlb和Car)含量均显著低于大叶黄杨,但Chla/b和Car/Chl(a+b)比值在金边黄杨与大叶黄杨间无显著差异;就金边黄杨的黄色和绿色区域来说,各色素(Chla,Chlb和Car)含量在黄色区域均显著降低,但各组分色素降低的程度不同,Chlb仅减少了19%,而Car和Chla分别减少了97%和83%,因此,金边黄杨黄色区域的Chla/b和Car/Chl(a+b) 比值极显著低于其绿色区域和大叶黄杨.结果表明,金边黄杨与大叶黄杨之间的光合物质基础在量上存在显著差异,而在金边黄杨的黄色边缘区域,Chla和Car 功能显著衰退,仅保留部分Chlb的功能.
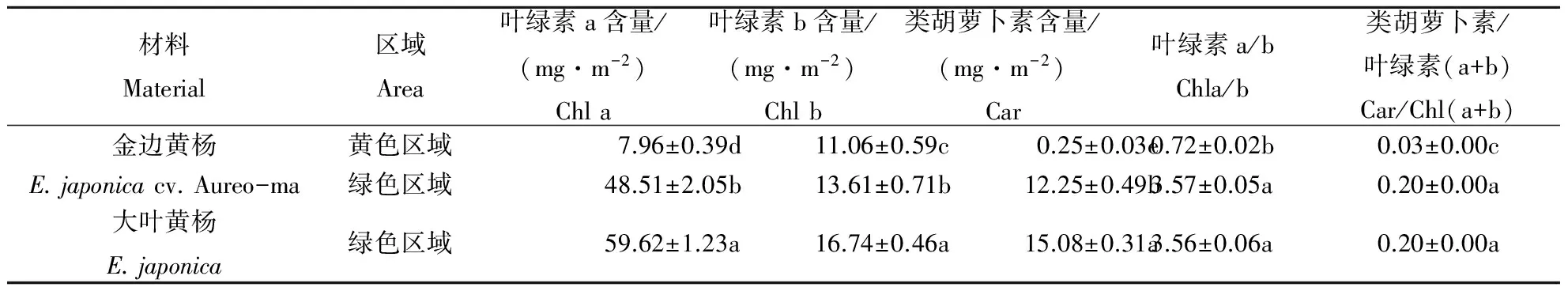
表1 金边黄杨与大叶黄杨不同部位的叶绿素和类胡萝卜素含量
为进一步探讨金边黄杨黄色边缘色素含量变化带来的影响,本研究分析了金边黄杨与大叶黄杨其不同区域在光能的吸收和反射方面的差异(图1).由图1看出,金边黄杨绿色区域的吸光系数和发射率与大叶黄杨差别不大,但金边黄杨的黄色边缘区域吸光系数较绿色区域显著降低,而反射率则显著增加,与表1的结果一致.同时,金边黄杨的叶片横切面(图2)表明,黄色边缘区域叶肉细胞无栅栏组织和海绵组织之分,且细胞间排列紧密,所以横切面显著变薄,减少了叶片对光能的吸收.此外,栅栏组织含有较多的叶绿素,在叶片光合作用中起到重要作用[14],植物在遭受胁迫或叶色发生变异时,栅栏组织较海绵组织易受到影响[15].因此,本研究中金边黄杨部分栅栏组织退化,叶肉细胞间隙变小,排列紧密可能是在栽培过程中,降低其光合能力,这可能是对环境强光的一种适应.

图1 金边黄杨和大叶黄杨对光能的吸光和反射的比较
2.2金边黄杨与大叶黄杨的光能分配差异
基于金边黄杨的色素含量和光能吸收反射等差异,对金边黄杨与大叶黄杨间的光能分配利用情况进行了分析测定(图3).在经过充分的暗适应之后,用Imaging-PAM在相同的光化光下(185 μmol·m-2·s-1)对金边黄杨与大叶黄杨的叶片激发300 s后,植物吸收的光能已经基本稳定地分为3部分:光化学能量转换(ФPSⅡ);调节性的热耗散(ФNPQ);非调节热耗散(ФNO).在相同的PAR(185 μmol·m-2·s-1)下,随时间的延长,2者的非调节热耗散(ФNO)无显著差异(约为0.2),表明金边黄杨与大叶黄杨均未受到明显的光损伤.但2者用于光化学能量转换和调节性能量耗散的比例明显不同,大叶黄杨叶片将吸收的能量主要用于转化为光化学反应(ФPSⅡ),而金边黄杨的正常绿色部分则主要将能量用于调节性的热耗散(ФNPQ).结果表明,金边黄杨的光化学效率虽然较低,但热耗散及光保护能力较强.

图2 显微镜下金边黄杨的横切面
2.3金边黄杨与大叶黄杨的叶黄素循环库差异
金边黄杨的绿色区域较大,叶黄杨具有较高的热耗散效率(ФNPQ),那么是否与叶黄素循环有关,本研究又比较了金边黄杨与大叶黄杨各个部位的叶黄素含量.由表2看出,叶黄素的各组分含量未能检测出来,这是由于金边黄杨黄色边缘部分的Car含量极低的缘故(表1);而金边黄杨的绿色区域虽然具有和大叶黄杨同等程度的脱环氧化能((A+Z)/(A+Z+V)),但其叶黄素循环库(A+Z+V)总含量却显著高于大叶黄杨,因此,可能使金边黄杨的热耗散效率(ФNPQ)较高.
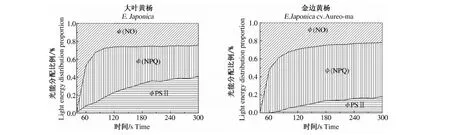
图3 金边黄杨和大叶黄杨(绿色区域)光能分配的差异
表2金边黄杨与大叶黄杨不同部位的色素组成
Table2PigmentcompositionofE.japonicacv.Aureo-maandE.japonicaindifferentareas

材料Material区域Area叶黄素循环库/(ug·g-1)A+Z+V脱环氧化程度(A+Z)/(Z+A+V)金边黄杨E.Japonicacv.Aureo⁃ma黄色部分绿色部分———679.77±79.38a———0.06±0.01a大叶黄杨E.Japonica绿色部分566.20±12.30b0.06±0.001a
2.4金边黄杨与大叶黄杨的光抑制及恢复的差异
根据以上结果分析推测:金边黄杨较大叶黄杨具有较好的光保护能力.为了证明这一推断,本研究仍选用2 a生枝条上的第2对叶片进行光抑制处理4 h,之后恢复3.5 h;同时测定Fv/Fm值.结果表明,处理前,金边黄杨与大叶黄杨的Fv/Fm均无显著差异;光抑制处理后,金边黄杨与大叶黄杨均发生显著的光抑制现象(Fv/Fm显著下降),且抑制程度相近(均下降了8 %左右,金边黄杨与大叶黄杨无显著差异),但在恢复3.5 h之后,金边黄杨可恢复至处理前水平,而大叶黄杨仅恢复至处理前的82.92%. 此表明,相对大叶黄杨,金边黄杨在试验的光抑制环境下,虽未表现出较强的光保护能力,但对光抑制过程中的伤害修复能力较强.
3 讨论
光虽然是植物光合作用所必需的,但当植物吸收的光能超出所能利用的范围时,会导致光合功能降低,表现为量子效率和光能量转换效率降低,即光合作用的光抑制[16].植物在长期的进化中也形成了许多相应的防御和抵抗机制:首先是减少光能吸收(如改变叶片伸展方向和表面结构,减少叶绿素含量等);其次是改变光能的分配利用情况(如降低光化学能量、增强热耗散等);最后是增强抗氧化防御系统(包括酶促和非酶促2种)[17].
本研究中,金边黄杨的黄色边缘部分带来的主要影响源于叶绿素和类胡萝卜素的改变,因此,其光能的吸收和分配利用也可能发生了很大的变化.
金边黄杨的黄色区域色素含量(Chla,Chlb和Car)显著低于正常的绿色区域,因此,叶片对光能的吸收和光合作用将显著降低. 本研究结果表明,金边黄杨的黄色边缘区域在光能吸收方向存在显著障碍,吸光值几乎为0. 同时,金边黄杨的黄色边缘区域对光线的反射相较绿色区域大大增加. 同时,黄色边缘区域的叶绿体结构退化,色素含量减少,横切面较薄,减少了光能的吸收和传递. 因此,就金边黄杨来说,黄色边缘减少了整个叶片对光能的吸收和传递,而增加了对光能的反射.这些措施都直接减少了整个叶片的光能吸收量和吸收效率[18],从而可能在强光下起到积极的作用.
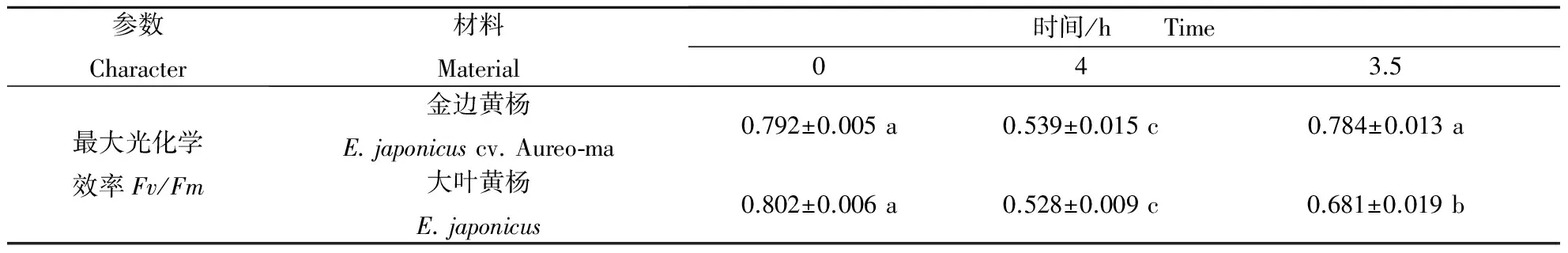
表3 金边黄杨与大叶黄杨的光抑制4 h和恢复3.5 h后的Fv/Fm变化
就金边黄杨与大叶黄杨的绿色区域来说,金边黄杨的绿色部分具有较低的Chla,Chlb和Car含量,但Chla/b和Car/Chl(a+b)比值相当,具有较低光能吸收能力和较高的反射率,但差异不大. 因此,本研究又对金边黄杨绿色区域吸收光能的分配和利用进行了比较,结果显示,金边黄杨的光能分配以热耗散占优势,而对照则光化学能量转换较多;同时,虽然金边黄杨的(A+Z)/(A+Z+V)并不比大叶黄杨高,但却具有较高的(A+Z+V)含量,从而造成了金边黄杨与对照在光能分配上存在显著差异.
从以上结果推测出,金边黄杨可能具有潜在较强的光保护能力.为了证明这一推测,本研究又用金边黄杨与大叶黄杨进行了光抑制试验,结果表明,金边黄杨虽未表现出较强的光保护能力,但对光抑制过程中的伤害修复能力较强.
综上,金边黄杨的黄色边缘部分降低了整个叶片的光能吸收和传递,而增加了光的反射,从而降低了整个叶片的光能吸收量和吸收效率;而绿色区域具有较高的热耗散效率,因此使金边黄杨具有较强的光保护能力.
参考文献:
[1]POHLHEIM F. Vergleichende undersuchungen zur sprossvariation beiPlectranthusL’ Herit.(Lamiaceae) [J]. Faddes Repertorium,2003,114(7): 488-496.
[2]姜卫兵,庄 猛,韩浩章,等. 彩叶植物呈色机理及光合特性研究进展 [J].园艺学报,2005,32(2): 352-358.
[3]HAVANX M,TARDY F. Thermostability and photostability of photosystem Ⅱ in leaves of the Chorina-F2 barley mutant deficient in light-harves-ting chorophyll a/b protein complexes [J].Plant Physiol,1997,113(3): 913-923
[4]MAREOTRIGIANO M. Chimeras and variegation:patterns of deceit [J]. Hort Science:a publication of the American Society for Horticultural Science,1997,32(5): 773-784.
[5]武菊英,滕文军,袁小环,等. 分株和遮荫对花叶芒生长的影响 [J]. 园艺学报,2009,36(11): 1691-1696.
[6]SHEUE CR,PAO SH,CHIEN LF,et al. Natural foliar variegation without costs? The case ofBegonia[J]. Annals of Botany,2012,109(6): 1065-1074.
[7]庄 猛,姜卫兵,花国平,等. 金边黄杨与大叶黄杨光合特性的比较 [J]. 植物生理学通讯,2006,42(1): 39-42.
[8]赵 琦,唐崇钦,匡廷云. 玉米突变体 (zb/zb) 的叶绿体光合特性 [J]. 植物学报,1997,39(11): 1082-1084.
[9]RAVEH E,WANG N,NOBEL P S. Gas exchange and metabolite fluctuations in green and yellow bands of variegated leave of the monocotyledonous CAM species Agave Americana [J].Physiol Plant,1998,103(1): 99-106.
[10]AIT NA,JUNEAU P,DIDUR O,et al. Effect of dichromate on photosystemⅡ activity in xanthophylls-deficient mutants ofChlamydomonasreinhardtii[J]. Photosynthesis Research,2008,95(1): 45-53.
[11]KOOTEN O,SNEL J F H. The use of chlorophyll fluorescence nomenclature in plant stress physiology [J]. Photosynthesis Research,1990,25(3): 147-150.
[12]ARNON D I. Copper enzymes in isolated chloroplasts. Polyphenoloxidase inBetavulgaris[J]. Plant physiology,1949,24(1): 1-15.
[13]THAYER S S,BJORKMAN O. Leaf xanthophyll content and composition in sun and shade determined by HPLC [J]. Photosynthesis Research,1990,23(3): 331-343.
[14]王宝华,吴帼英,黄静勋. 烟叶植物学特性的观察Ⅱ烤烟烟叶的栅栏组织和海绵组织 [J]. 中国烟草,1984(2): 10-15.
[15]PARIDA A K,DAS A B,MITTRA B. Effects of salt on growth,ion accumulation,photosynthesis and leaf anatomy of the mangrove,Bruguier a parviflora [J]. Trees,2004,18(2): 167-174.
[16]魏爱丽,王志敏. 高等植物PSⅡ的光抑制与光破坏研究进展 [J]. 西北植物学报,2004,24(7): 1342-1347.
[17]ESTEBAN R,FARNNDEZ-MARN B,BECERRIL J M,et al. Photoprotective implications of leaf variegation inE.dens-canisL. andP.officinalisL [J]. Journal of Plant Physiology,2008,165(12): 1255-1263.
[18]CHEN MCM,CHAO PY,HUANG MY,et al. Chlorophyllase activity in green and non-green tissues of variegated plants [J]. South African Journal of Botany,2012,(81): 44-49.
