Maspin和MMP-2在乳腺浸润性导管癌中的表达及其临床意义
2014-04-08王瑞月张学义
张 伟,王瑞月,李 娟,张学义
乳腺癌是威胁女性健康最常见的恶性肿瘤之一[1],占女性恶性肿瘤死亡原因的首位[2],全世界每年有大约120万的新增病例。近几年来,中国乳腺癌的发病率每年增长达3%~4%,远远高于0.5%的世界平均水平[3]。肿瘤的侵袭和转移是导致患者死亡的主要原因[4]。Maspin是一种抑癌基因,具有抑制肿瘤细胞的生长、增加肿瘤细胞间粘附性及抑制肿瘤性血管形成等作用。MMP-2是一种基质金属蛋白酶,具有的主要功能是降解细胞外基质,维持细胞外基质的动态平衡。本实验采用免疫组织化学SP法检测乳腺浸润性导管癌组织中Maspin和MMP-2的表达,探讨其临床意义。
1 材料与方法
1.1 材料 选取抚顺矿务局总医院2012年至2013年手术切除的60例乳腺浸润性导管癌组织的存档蜡块。每例均有详细的临床病理资料,所有病例术前未进行放疗、化疗和免疫治疗。年龄28~64岁,平均年龄50岁,≤50岁者34例,>50岁者26例;肿瘤直径≤2 cm者16例,>2 cm且≤5 cm者30例,>5 cm者14例;组织学分级:Ⅰ级15例,Ⅱ级35例,Ⅲ级10例;无淋巴结转移者26例,有淋巴结转移者34例;临床分期:Ⅰ期15例,Ⅱ期32例,Ⅲ+Ⅳ期13例。另随机选取同期乳腺癌改良根治术后距离原发灶5 cm外正常乳腺组织标本20例作为对照。所有标本均经4%中性甲醛固定,常规脱水,石蜡包埋、切片。
1.2 试剂与方法 鼠抗人Maspin单克隆抗体为美国Lab Vision公司产品,鼠抗人MMP-2单克隆抗体为福州迈新公司产品。采用免疫组织化学SP法对乳腺浸润性导管癌组织中Maspin和MMP-2进行检测,实验步骤严格按照试剂盒说明书进行,用已知阳性的切片做阳性对照,PBS代替一抗为阴性对照。
1.3 结果判定 切片均采用双人双盲法半定量观察。Maspin染色结果以染色强度结合阳性细胞数百分比综合计分作定性分析。组织切片中细胞浆染为淡黄色至棕褐色者为阳性细胞标志。染色强度以多数细胞呈现的染色特性计分:0分为无色,1分为淡黄色,2分为棕黄色,3分为棕褐色。阳性细胞百分比即某类细胞5个视野(每400×高倍视野计数100个此类细胞)的阳性细胞平均数:0分为阴性,1分为阳性细胞≤10%,2分为11%~50%,3分为51%~75%,4分为>75%。染色强度与阳性细胞百分比的乘积0~2分为阴性;3~12分为阳性。MMP-2镜下肿瘤细胞浆中出现棕黄色颗粒为阳性细胞。染色细胞数>25%定为阳性,≤25%为表达阴性。
1.4 统计学分析 应用SPSS18.0统计软件包进行统计,采用χ2检验及Spearman等级相关分析,检验水准α=0.05。
2 结果
2.1 Maspin和MMP-2在乳腺浸润性导管癌中和正常乳腺组织中的表达 Maspin蛋白在正常乳腺组织中主要表达于细胞浆内,细胞核与细胞膜上有少许表达,阳性表达率为95.0%(图1),在乳腺浸润性导管癌细胞中Maspin主要表达于细胞浆内,并且其阳性率显著降低,为45.0%(图2);MMP-2蛋白阳性表达主要位于乳腺浸润性导管癌细胞胞浆中,在高倍镜下呈棕黄色颗粒,以强阳性和中度阳性为主,阳性表达率为75.0%(图4),高于正常乳腺组织中MMP-2阳性表达率为15.0%(图3)。Maspin和MMP-2在乳腺浸润性导管癌和正常乳腺组织中的表达的差异有统计学意义(P<0.05)。见表1。
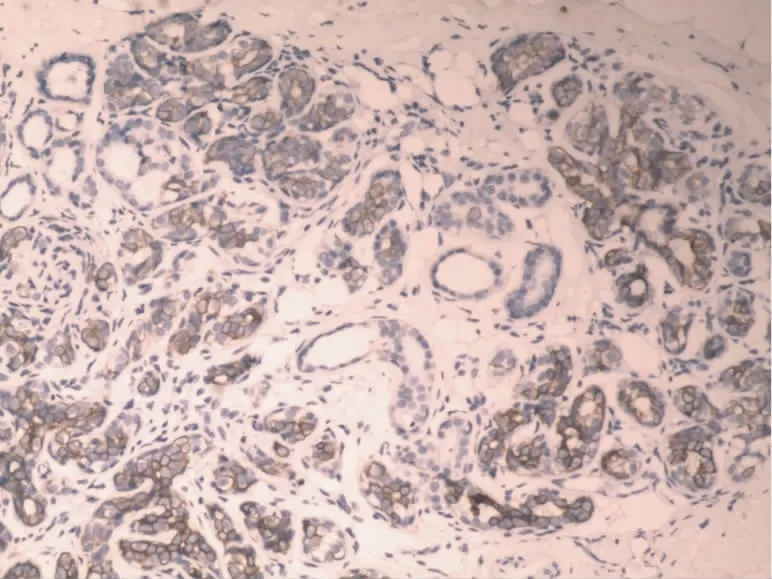
图1 Maspin在正常乳腺导管上皮细胞浆内的表达(SP,×100)
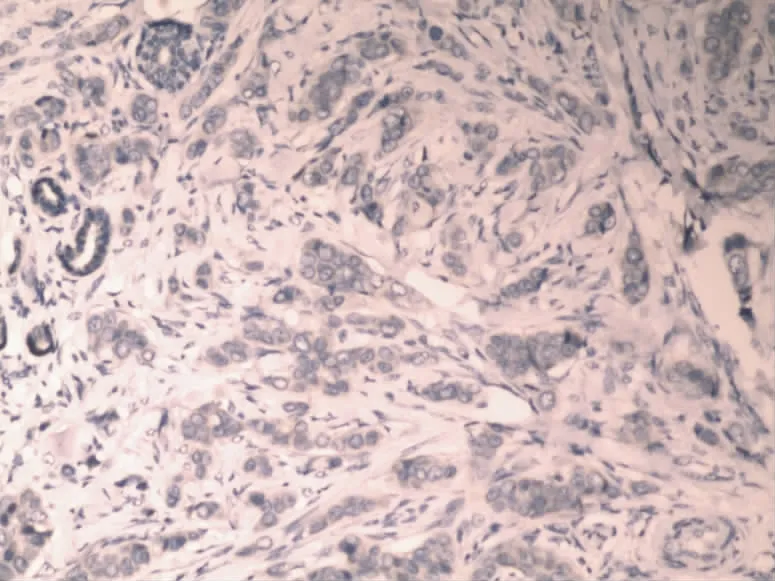
图2 Maspin在乳腺浸润性导管癌细胞浆内的表达(SP,×100)
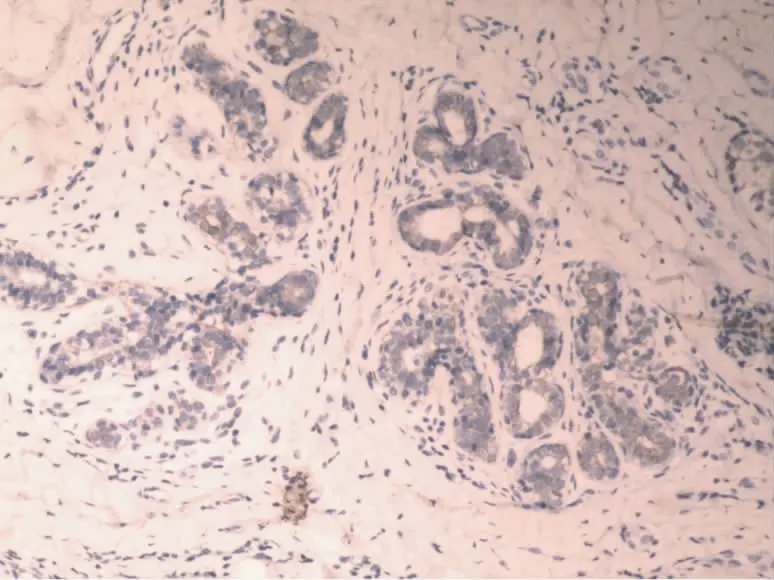
图3 MMP-2在正常乳腺导管上皮细胞浆内的表达(SP,×100)
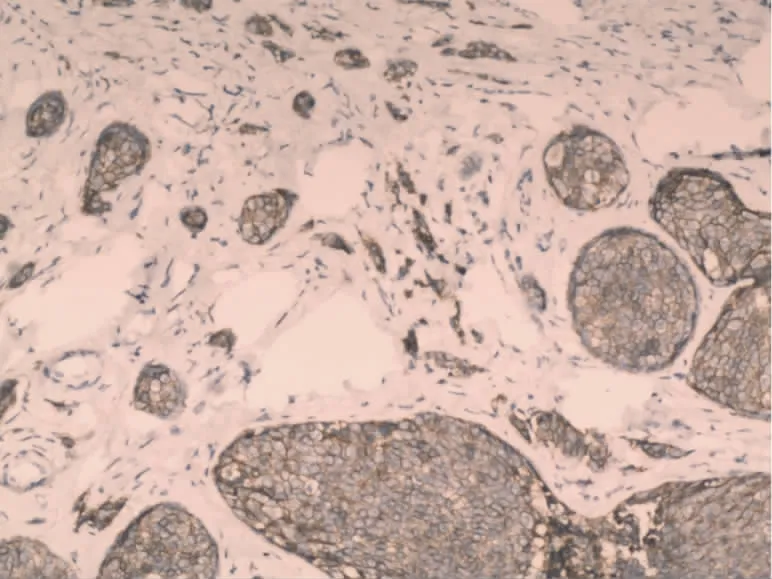
图4 MMP-2在乳腺浸润性导管癌细胞浆中的表达(SP,×100)

表1 Maspin和MMP-2在乳腺浸润性导管癌与正常乳腺组织中的表达
2.2 Maspin和MMP-2的表达与乳腺浸润性导管癌临床病理因素的关系 Maspin和MMP-2的表达与乳腺浸润性导管癌患者的年龄、肿瘤直径和组织学分级均无关,差异无统计学意义(P>0.05);Maspin和MMP-2的表达均与乳腺浸润性导管癌淋巴结转移有关,差异有统计学意义(P<0.05),MMP-2的表达还与乳腺浸润性导管癌的临床分期相关,随着乳腺浸润性导管癌临床分期越晚,MMP-2的阳性表达率增高,差异有统计学意义(P<0.05)。见表2。
2.3 Maspin和MMP-2在乳腺浸润性导管癌组织中表达的相关性 Spearman等级相关分析显示,Maspin和MMP-2在乳腺浸润性导管癌组织中的表达呈负相关(r=-0.11,P<0.05)。见表3。

表2 Maspin和MMP-2的表达与乳腺浸润性导管癌临床病理因素的关系

表3 Maspin和MMP-2在乳腺浸润性导管癌组织中表达的相关性
3 讨论
肿瘤的发生、发展是一个多环节、多步骤、多种基因参与的错综复杂的过程,其中癌基因的激活和抑癌基因的失活是细胞癌变的分子基础,肿瘤侵袭和转移与肿瘤细胞外基质降解增加、肿瘤细胞间粘附性降低以及肿瘤新血管形成相关。
Maspin基因是1994年Zou等[5]用消减杂交技术发现的,证实其为新的丝氨酸蛋白酶抑制剂基因。近年来,越来越多的证据表明,Maspin基因在肿瘤的发生、进展中起到重要的作用。大量研究表明,Maspin基因发挥其抑癌作用主要通过两种途径,一种是直接抑制肿瘤的浸润转移,另一种是间接调控其他抑癌相关基因的转录活性来影响癌变组织的行为[6-8]。研究证实,Maspin存在于正常的口腔黏膜、乳腺、前列腺、胃肠道上皮中,在相应的恶性肿瘤中,其含量明显下降。本研究结果显示Maspin在正常乳腺组织中高表达,阳性率为95.0%,而在乳腺浸润性导管癌组织中低表达,阳性率为45.0%,差异有统计学意义(P<0.05),提示Maspin的低表达可能是导致乳腺浸润性导管癌发生的原因之一。发生机制可能是由于Maspin的基因沉默、组蛋白的去乙酰化等原因使其表达下调,导致其对癌细胞的抑制作用减弱,具体途径可能为,Maspin通过Bax介导的细胞凋亡抑制肿瘤作用减弱,另外,Maspin基因可作用于纤维母细胞生长因子和血管内皮生长因子,阻断细胞的有丝分裂和管道的形成,抑制培养的内皮细胞向基质的转移,从而对血管中肿瘤的生长起到抑制作用[9-10],当Maspin表达下调时这种作用亦减弱。本研究结果还显示Maspin的表达与淋巴结转移相关,提示Maspin的低表达与乳腺浸润性导管癌的进展和恶化相关。其机制可能为,Maspin可以增加细胞的粘附能力并减低细胞的运动能力;Maspin可以通过调节G蛋白Racl和Pakl(p21-活性激酶)的活性来抑制细胞运动,通过磷酸肌醇-3激酶(PI3K)和细胞外信号调节激酶(ERK)途径来调节细胞的粘附[11]。还可以抑制细胞周围uPA对蛋白水解和细胞运动的调节作用而阻断细胞的浸润和运动[12]。
MMP-2又称明胶酶A、Ⅳ型胶原酶,是金属基质蛋白酶(matrix metalloproteinases,MMPs)的一种。MMPs属于锌依赖性内肽酶家族,该家族包括20多个成员[13]。MMP-2可以降解细胞外基质中主要成分Ⅳ型胶原,促进肿瘤性新生血管形成,与肿瘤的恶性进展关系密切[14]。大量研究表明,MMP-2与结肠癌、乳腺癌、卵巢癌、肺癌的发生及发展密切相关[15-18]。本研究结果显示,MMP-2在乳腺浸润性导管癌中的表达高于在正常乳腺组织,差异有统计学意义(P<0.05)。乳腺浸润性导管癌中MMP-2的表达与年龄、肿瘤直径和组织学分级无关。有淋巴结转移组的表达高于无淋巴结转移组,差异有统计学意义(P<0.05),随着临床分期的升高,MMP-2的表达率随之升高,差异有统计学意义(P<0.05)。这提示MMP-2在乳腺浸润性导管癌的发生和发展过程中起到重要的作用,在乳腺浸润性导管癌的发生过程中,MMP-2释放生长因子,活化并刺激肿瘤细胞的生长,另外MMP-2可以通过把转化生长因子β的前体转化为活性形式,来促进肿瘤细胞的增殖。在乳腺浸润性导管癌的侵袭和转移过程中,MMP-2可能通过以下3种途径来发挥其作用:其一,MMP-2通过降解细胞外基质,破坏以Ⅳ型胶原为主要成分的基底膜的完整性,有利于肿瘤细胞的浸润和转移。其二,肿瘤的生长离不开新生的血管,MMP-2可以降解血管基底膜,导致血管内皮细胞的向外转移形成新的血管,还可以分裂层粘连蛋白-5增加血管内皮细胞的存活及释放VEGF,从而刺激血管的形成。其三,MMP-2的过表达在上皮间质转化过程中亦起到重要作用[19],导致癌细胞的侵袭,具体机制有待于进一步研究。
本研究发现,乳腺浸润性导管癌中Maspin和MMP-2的表达存在负相关,其机制可能为,uPA通过酪氨酸激酶信号传导途径,对MMPs起到调节的作用,可以激活MMPs,发挥其对细胞外基质的降解作用,Maspin蛋白可以使细胞的表面uPA和uPAR水平降低,对uPA起到抑制作用[20]。Maspin通过抑制uPA从而下调MMP-2的表达,但具体机制也有待于进一步研究。
综上所述,Maspin和MMP-2与乳腺浸润性导管癌的发生、发展密切相关,联合检测二者,对判断乳腺浸润性导管癌的预后及临床治疗有一定的指导意义。
参考文献:
[1] Ivkovic-Kapicl T,Knezevic-Usaj S,Panjkovic M,et al.The influence of aging on pathologic and immunobiologic parameters of invasive ductalbreast carcinoma[J].Vojnosanit Pregl,2006,63(11):921-927.
[2] Sinclair AH,Berta P,Palmer MS,et al.A gene from the human sex-determining region encodes a protein with homology to a conserved DNA-binding motif[J].Nature,1990,346(6281):240-244.
[3] Weigel MT,Dowsett M.Current and emerging biomarkers in breast cancer:prognosis and prediction[J].Endocr Relat Cancer,2010,17(4):R245-262.
[4] Bowles J,Sehepers G,Koopman P.Phylogeny of the SOX family of developmental transcription factors based on sequeuce and structural indicators[J].Dev Biol,2000,227(2):239-255.
[5] Zou Z,Anisowicz A,Hendrix MJ.Maspin,a serpin with tumor-suppressing activity in human mammary epithelial cells[J].Science,1994,263(5146):526-529.
[6] Kashima K,Ohike N,Mukai S,et al.Expression of the tumor suppressor gene maspin and its significance in intraductal papillary mucinousneoplasms of the pancreas[J].Hepatobiliary Pancreat Dis Int,2008,7(1):86-90.
[7] Marioni G,D′Alessandro E,Giacomelli L,et al.Maspin nuclear localization is related to reduced density of tumour-associated micro-vessels in laryngeal carcinoma[J].Anticancer Res,2006,26(6C):4927-4932.
[8] Li Z,Shi HY,Zhang M.Targeted expression of maspin in tumor vasculatures induces endothelial cell apoptosis[J].Oncogene,2005,24(12):2008-2019.
[9] Loo JA,Yan W,Ramachandran P,et al.Comparative human salivary and plasma proteomes[J].J Dent Res,2010,89(10):1016-1023.
[10] Sopel M,Surowiak P,Berdowska I.Nuclear maspin expression as a good prognostic factor in human epithelial ovariancarcinoma[J].Folia Morphol (Warsz),2010,69(4):204-212.
[11] Odero-Marah VA,Khalkhali-Ellis Z,Chunthapong J,et al.Maspin regulates different signaling pathways for motility and adhesion in aggressive breast cancer cells[J].Cancer Biol Ther,2003,2(4):398-403.
[12] Biliran H Jr,Sheng S.Pleiotrophic inhibition of pericellular urokinase-type plasminogen activator system by endogenous tumor suppressive maspin[J].Cancer Res,2001,61(24):8676-8682.
[13] Mizoguchi H,Yamada K,Nabeshima T.Neuropsychotoxicity of abused drugs:involvement of matrix metalloproteinase-2 and -9 and tissue inhibitor of matrix metalloproteinase-2 in methamphetamine-induced behavioral sensitization and reward in rodents[J].J Pharmacol Sci,2008,106(1):9-14.
[14] Jadhav U,Chigurupati S,Lakka SS,et al.Inhibition of matrix metalloproteinase-9 reduces in vitro invasion and angiogenesis in human microvascular endothelial cells[J].Int J Oncol,2004,25(5):1407-1414.
[15] Langers AM,Verspaget HW,Hawinkets LJ,et al.MMP-2 and MMP-9 in normal mucosa are independently associated with outcome of colorectal cancer patients[J].Br J Cancer,2012,106(9):1495-1498.
[16] 苏书娟,邢鲁奇,陈登庭,等.MMP-2、MMP-9和col Ⅳ在乳腺导管癌中的表达及其相关性[J].中国肿瘤外科杂志,2010,2(4):202-206.
[17] Coticchia CM,Curatolo AS,Zurakowski D,et al.Urinary MMP-2 and MMP-9 predict the presence of ovarian cancer in women with normal CA125 levels[J].Gynecol Oncol,2011,123(2):295-300.
[18] Peng WJ,Zhang JQ,Wang BX,et al.Prognostic value of matrix metalloproteinase-9 expression in patients with non-small cell lung cancer[J].Clin Chim Acta,2012,413(13-14):1121-1126.
[19] Egeblad M,Werb Z.New functions for the matrix metalloproteinases in cancer progression[J].Nat Rev Cancer,2002,2(3):161-174.
[20] Festuccia C,Angelucci A,Gravina G,et al.Bombesin-dependent pro-MMP-9 activation in prostatic cancer cells requires beta1 integrin engagement[J].Exp Cell Res,2002,280(1):1-11.
