不同浓度钠对甜菜生长及生理特性的影响
2014-04-01彭春雪於丽华孙学伟赵慧杰
彭春雪, 耿 贵, 於丽华, 杨 云, 邳 植,孙 菲, 孙学伟, 赵慧杰
(1 黑龙江大学生命科学院,哈尔滨 150080; 2 黑龙江省普通高等学校甜菜遗传育种重点实验室,哈尔滨 150080;3 中国农业科学院甜菜研究所,哈尔滨 150080)
普遍认为,过量Na+是造成植物盐害的主要因素之一,但是有些植物的生长是需要适量Na+[1]。近年来,有学者致力于研究低浓度Na+对农作物的生长的影响,并且证明了低浓度的Na+可以促进农作物的生长[2]。
甜菜是我国乃至全世界重要的糖料作物之一[3]。甜菜是喜钠作物,在适当的Na+的条件下可生长良好[4-5]。我国甜菜的种植区域主要分布在“三北”地区,而这些地区土壤水溶性钠或交换性钠含量较高[6],多为盐渍化土壤。以往的研究通常集中在高Na+浓度条件下甜菜的耐盐性和适应能力上[7-8],而对在不同低浓度Na+条件下,甜菜生长状况的研究较少。本研究以甜菜为材料,通过营养液培养的方法,对不同低浓度Na+处理下甜菜生理生化指标变化进行了研究,为探索Na+对甜菜的有益作用提供一定的理论基础。
1 材料与方法
1.1 试验设计
1.2 测定项目与方法
株高为从子叶叶柄的基部所在的水平面到整株甜菜顶端叶片的最高处所在的水平面。叶片面积扫描部位为甜菜幼苗真叶,扫描后使用WinRHIZO软件分析。叶片相对含水量和叶片相对电导率测定方法参考刘祖祺的测定方法[9]。叶片水势测定为取甜菜幼苗的第二对真叶用压汁器取其汁液,用露点水势仪测定叶片水势。叶绿素测定采用丙酮比色法[10]。抗氧化酶取样部位为甜菜幼苗第二对真叶, 超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)光化还原法,谷胱甘肽过氧化物酶(GPX)活性测定采用愈创木酚法,过氧化氢酶(CAT)活性测定采用聚乙烯吡咯烷酮法,丙二醛(MDA)含量测定采用硫代巴比妥酸(TBA)比色法[11]。
植株样品收获后测定鲜重,分为根、 叶柄及叶片三个部分,按各项指标要求取样后,105℃杀青30 min,70℃烘干至恒重,测定干重。烘干样品采用混合酸(HNO3∶HClO4=4 ∶1)消煮法提取Na+、 K+,Na+用原子吸收分光光度计测定,K+用火焰分光光度计测定;采用浓硫酸-混合加速剂(硫酸钾 ∶硫酸铜 ∶硒=100 ∶10 ∶1)消煮法提取N、 P,全N含量用凯氏定氮法测定,全P用偏钒酸铵方法进行测定[12]。
2 结果与分析
2.1 不同Na+浓度对甜菜幼苗株高、 叶面积和生物量的影响



表1 不同Na+浓度对甜菜幼苗株高和叶面积的影响Table 1 Effects of different Na+ concentrations on height and area of leaf of sugar beet seedlings
注(Note): 同列数据后不同字母代表处理间差异显著(P<0.05)Different letters in a column mean significant at the 5% level.
2.2 不同浓度Na+对植株水势和叶片相对含水量的影响
水势是表示植物水分亏缺或表示水分状况的一个直接生理指标。由图1看出, 甜菜叶片的水势随Na+浓度的升高而降低,0.75 mmol/L和1.5 mmol/L Na+浓度处理与CK差异不显著,其余三个处理均显著低于CK,营养液中Na+浓度为3 mmol/L、 6 mmol/L和9 mmol/L的处理,分别比CK下降了4.00×105Pa、 11.03×105Pa和12.13×105Pa。试验中Na+浓度越高叶片水势越低,说明Na+可提高甜菜幼苗叶片细胞的吸水能力。
由图2看出, 甜菜叶片的相对含水量随Na+浓度的升高呈先升后降规律。在Na+浓度为1.5 mmol/L时达到最大值81.68%,3 mmol/L处理时略低,为81.46%,两处理间差异不显著,两者皆与CK差异显著。说明在Na+浓度为1.5 mmol/L和3 mmol/L时,甜菜幼苗的自由水含量高,保水能力高于其余处理。

图1 不同Na+浓度对甜菜幼苗叶片水势的影响Fig.1 Effects of different Na+ concentrations on leaf water potential of sugar beet seedlings[注(Note): 图中正负误差线表示标准差大小 Values in the chart are mean±standard error;不同字母代表处理间差异显著(P<0.05) Different letters mean significant among different treatments at P<0.05 level.]

图2 不同Na+浓度对甜菜幼苗叶片相对含水量的影响Fig.2 Effects of different Na+ concentrations on relative water content of leaf of sugar beet seedlings[注(Note): 图中正负误差线表示标准差大小 Values in the chart are mean±standard error;不同字母代表处理间差异显著(P<0.05) Different letters mean significant among different treatments at P<0.05 level.]
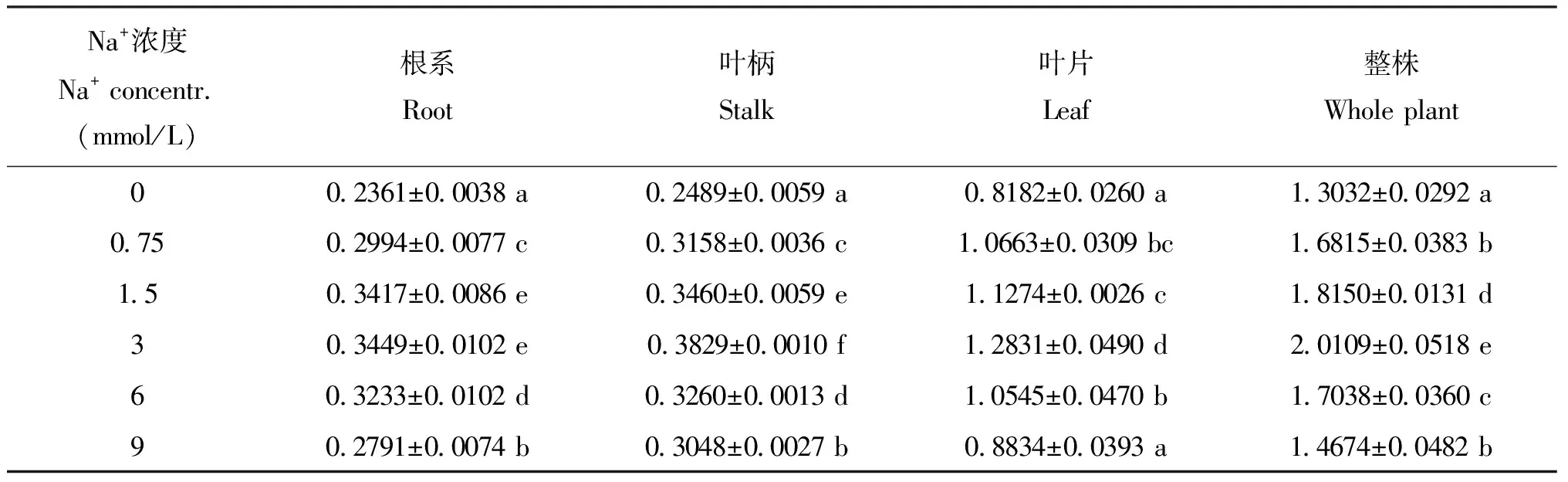
表2 不同Na+浓度对甜菜幼苗干物质量的影响(g/pot)Table 2 Effects of different Na+ concentrations on dry weight of sugar beet seedlings
注(Note): 同列数据后不同字母代表处理间差异显著(P<0.05)Different letters in a column mean significant atP<0.05 level.
2.3 不同浓度Na+对植株叶片叶绿素含量的影响

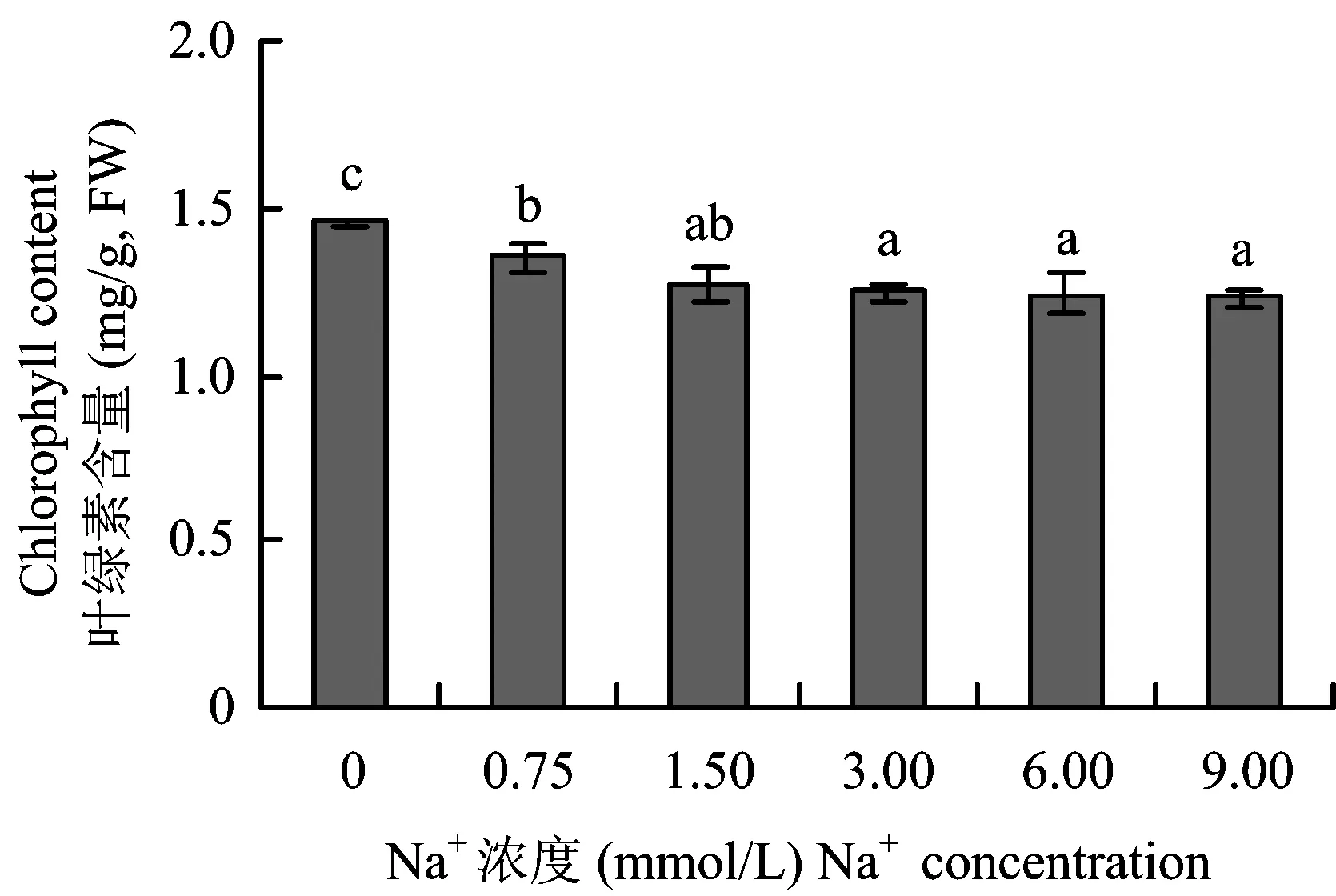
图3 不同Na+浓度对甜菜幼苗叶绿素含量的影响Fig.3 Effects of different Na+ concentrations on chlorophyll content of sugar beet seedlings[注(Note): 图中正负误差线表示标准差大小 Values in the chart are mean±standard error;不同字母代表处理间差异显著(P<0.05) Different letters above the bars mean significant among different treatments at P<0.05 level.]
2.4 不同浓度Na+对植株叶片中的SOD、 CAT和GPX活性的影响

当Na+浓度由0.75 mmol/L提高至9 mmol/L时,与CK相比叶片GPX活性均有提高。甜菜叶片的GPX活性随Na+浓度的提高呈现先升后回落趋势;当Na+浓度在3 mmol/L时,GPX的活性达到最高值13.32 U/(g·min), FW,比CK升高了22.76%,与CK和其余处理的GPX活性的差异均达到显著水平。
随Na+浓度的提高,甜菜叶片的CAT活性变化较小。3 mmol/L Na+处理的CAT活性最高[42.06 U/(g·min), FW],但与CK差异不显著。当Na+浓度升高至9 mmol/L时,CAT活性明显降低为39.54 U/(g·min), FW。

表3 不同Na+浓度对甜菜幼苗叶片SOD、 CAT和GPX活性的影响Table 3 Effects of different Na+ concentrations on SOD, CAT and GPX activity of sugar beet seedlings
注(Note): 同列数据后不同字母代表处理间差异显著(P<0.05)Different letters in a column mean significant among treatments atP<0.05 level.
2.5 不同浓度Na+对MDA含量和电导率的影响
MDA是膜脂过氧化的重要产物之一,其含量的多少常用以衡量膜脂过氧化程度的大小。由图4看出, 甜菜幼苗叶片MDA含量随Na+浓度的升高而先降低后提高,在Na+浓度为 3 mmol/L时,达到最小值0.1395 nmol/g, FW。在Na+浓度为 3 mmol/L时,甜菜幼苗叶片膜脂过氧化程度最小,甜菜幼苗生长最好。

图4 不同Na+浓度对甜菜幼苗MDA含量的影响Fig.4 Effects of different Na+ concentrations on MDA content of sugar beet seedlings[注(Note): 图中正负误差线表示标准差大小 Values in the chart are mean±standard error;不同字母代表处理间差异显著(P<0.05) Different letters mean significant among different treatments at P<0.05 level.]
相对电导率是衡量质膜透性的指标之一。由图5看出: 甜菜幼苗叶片相对电导率随Na+浓度的升高而先降低后提高,在Na+浓度为 3 mmol/L时,达到最小值18.55%。在Na+浓度为 3 mmol/L时,甜菜幼苗叶片相对电导率最小,即质膜透性最小,甜菜幼苗生长最佳。
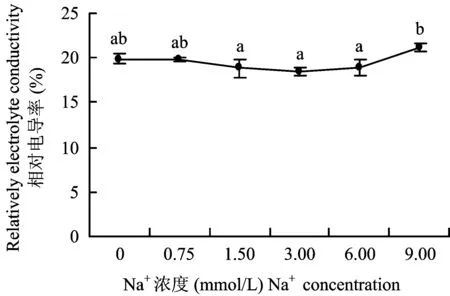
图5 甜菜幼苗叶片相对电导率与Na+浓度的关系Fig.5 Effects of different Na+ concentrations on relatively electrolyte conductivity of sugar beet seedlings[注(Note): 图中正负误差线表示标准差大小 Values in the chart are mean±standard error;不同字母代表处理间差异显著(P<0.05) Different letters mean significant among different treatments at P<0.05 level.]
2.6 不同浓度Na+对植株各部分Na+、 K+含量影响
随Na+浓度的升高,甜菜幼苗根系、 叶柄和叶片中的Na+含量呈逐渐提高,且均达到显著水平(见表4),当Na+浓度为 9 mmol/L时达到最大值。Na+在甜菜叶片中的含量最高,叶柄其次,根系最低。
K元素是植物生长过程中重要的必需营养元素。甜菜幼苗根系和叶柄中K+含量随Na+浓度的升高无明显变化,而叶片中K+含量随Na+浓度的提高呈现不同的变化(表4)。当Na+浓度由0 mmol/L升至3 mmol/L时,叶片K+含量呈增加趋势,但是未达到显著水平;Na+浓度继续升至6和9 mmol/L时,叶片K+含量明显降低。结果说明在Na+浓度不高于3 mmol/L时,Na+并未明显影响到甜菜体内K+含量,而在Na+浓度升高至6和9 mmol/L时Na+明显降低甜菜叶片K+含量。
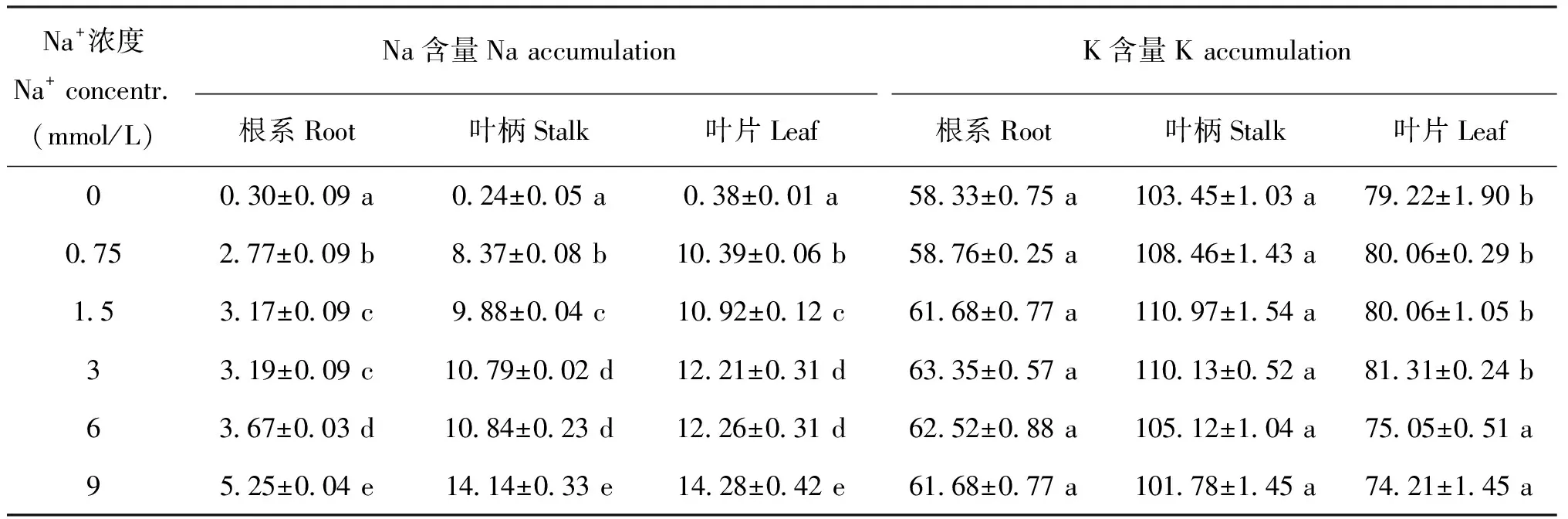
表4 不同浓度Na+对甜菜不同部位Na+和K+含量影响(mg/g, DW)Table 4 Effects of different Na+ concentrations on Na+and K+ content of sugar beet seedlings
注(Note): 同列数据后不同字母代表处理间差异显著(P<0.05)Different letters mean significant among different treatments atP<0.05 level.
2.7 不同浓度Na+下植株全N和全P含量


图6 不同Na+浓度对甜菜幼苗的N、 P含量影响Fig.6 Effects of different Na+ concentrations on N, P contents of sugar beet seedlings[注(Note): 图中正负误差线表示标准差大小 Values in the chart are mean±standard error;不同字母代表处理间差异显著(P<0.05) Different letters above the bars mean significant among different treatments at P<0.05 level.]
3 讨论与结论


陈国安在研究硝酸钠施用水平(0、 30、 60、 90、 120 kg/hm2)对土培甜菜植株中钾含量影响的试验结果表明,苗期甜菜植株钾含量逐渐降低(6.130%、 6.031%、 5.811%、 5.687%、 5.828%),低剂量钠处理未明显降低植株钾含量,高剂量钠处理植株钾含量降低幅度较大[18]。刘国栋等在研究土培水稻不同基因型对钾、 钠的反应时指出,茎叶的钾钠含量互成显著的反相关[19]。本试验发现,营养液中Na+浓度的增至3 mmol/L,仍然未降低甜菜幼苗体内钾素含量;Na+浓度的增加至6 mmol/L和 9 mmol/L,甜菜幼苗只有叶片钾素含量明显下降。这些差异可能是由作物种类以及土培和水培的差异造成的,这种影响有待于进一步研究。
当植物处于盐胁迫环境下,恶劣的环境会诱导植物产生过多的活性氧,引发膜脂过氧化,破坏生物膜的分子结构,可导致植物细胞的死亡[20]。MDA是膜脂过氧化的重要产物之一,其含量的多少常用以衡量膜脂过氧化程度的大小。王宝增等的研究表明,低浓度的Na+可以降低小麦幼苗中MDA的含量,表明适当的盐浓度可以减弱或降低膜脂过氧化程度,其原因可能是植物体内应激产生的活性氧自由基较少[21]。本试验中,当Na+浓度为3 mmol/L时,甜菜幼苗叶片中MDA含量和相对电导率都要低于CK,说明了甜菜幼苗细胞所受到膜脂过氧化程度比较弱,质膜透性降低。
抗氧化酶系统是植物体重要的保护系统之一,用于清除对植物体有害的超氧阴离子及其歧化产物。SOD、 GPX和CAT是主要的抗氧化酶。低盐浓度下GPX和CAT的活性提高,可以更好的清除植物体内超氧阴离子的歧化产物,如过氧化氢等,起到保护作用[21]。本试验中,当Na+浓度为3 mmol/L时,GPX和CAT的活性均高于CK,SOD的活性与CK无差异,说明了适宜的Na+浓度对SOD活性无影响,但可提高GPX和CAT的活性,使其能更有效地清除甜菜幼苗体内过多超氧阴离子的歧化产物,维持甜菜幼苗的正常生长。

参考文献:
[1] 邹邦基. 钠的植物营养与生理生态[J]. 植物生理学通讯, 1985, (5): 5-11.
Zou B J. Plant nutrition and physiological ecology of sodium[J]. Plant Physiol. J., 1985, (5): 5-11.
[2] 王宝增, 刘玉杰, 王桂香, 等. 低浓度NaCl对植物有益作用的研究概况[J]. 北方园艺, 2008, (3): 63-65.
Wang B Z, Liu Y J, Wang G Xetal. Study of beneficial effect on plants under low concentration NaCl[J]. Northern Hortic., 2008, (3): 63-65.
[3] 李承业, 王燕飞, 黄润, 等. 我国甜菜抗逆性研究进展[J]. 中国糖料, 2001, (1): 56-58.
Li C Y, Wang Y F, Huang Retal. Research progress in stress resistance of sugar beet[J], Sugar Crops China, 2001, (1): 56-58.
[4] 王铁军,梁启全,於丽华,等. 钠钾替代对甜菜生长的影响[J]. 中国糖料, 2012, 3: 33-35, 44.
Wang T J, Liang Q Q, Yu L Hetal. Substitution effect of Na for K on sugarbeet growth[J]. Sugar Crops China, 2012, (3): 33-35, 44.
[5] 於丽华, 耿贵. 不同浓度 NaCl 对甜菜生长的影响[J]. 中国糖料, 2007, (3): 14-16.
Yu L H Geng G. Effect of different NaCl concentrations on sugarbeet growth[J]. Sugar Crops China, 2007, (3): 14-16.
[6] 张彦才, 周晓芬, 李巧云, 等. 冀中南棉区土壤钠的形态与棉花吸收的关系[J]. 植物营养与肥料学报, 2004, 10(1): 34-39.
Zhang Y C, Zhou X F, Li Q Yetal. Relationship between the forms of soil sodium and sodium absorbed by cotton in the south centre area of Hebei[J]. Plant Nutr. Fert. Sci., 2004, 10(1): 34- 39.
[7] 陈燕, 秦树才, 邵世勤, 等. 不同甜菜品种钠素吸收性能的初步研究[J]. 中国糖料, 2008, (1): 18-21.
Cheng Y, Qin S C, Shao S Qetal. Study on Na absorption in different sugar beet varieties[J]. Sugar Crops China, 2008, (1): 18-21.
[8] 惠菲, 梁启全, 於丽华, 等. NaCl 和 KCl 胁迫对甜菜幼苗生长的影响[J]. 中国糖料, 2008, (3): 30-32.
Hui F, Liang Q Q, Yu L Hetal. Influence of NaCl and KCl stress on sugar beet seedling growth[J]. Sugar Crops China, 2008, (3): 30-32.
[9] 刘祖祺, 张石城. 植物抗性生理学[M]. 北京: 中国农业出版社, 1993.222-285.
Liu Z Q, Zhang S C. Plant resistance physiology[M]. Beijing. China Agricultural Press, 1993.222-285.
[10] 李合生. 植物生理生化试验原理和技术[M]. 北京. 高等教育出版社, 2000. 134-137.
Li H S. Principle and technology of plant physiological and biochemical experiment[M]. Beijing: Higher Education Press, 2000. 134-137.
[11] 丁海东, 万延慧, 齐乃敏, 等. 重金属(Cd2+、 Zn2+)胁迫对番茄幼苗抗氧化酶系统的影响[J]. 上海农业学报, 2004, 20(4): 79-82.
Ding H D, Wan Y H, Qi N Metal. Effects of Cd2+and Zn2+stress on antioxidant enzyme system of tomato seedlings[J]. Acta Agric. Shanghai, 2004, 20(4): 79-82.
[12] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. 191-192, 309-310.
Lu R K. Soil agricultural chemical analysis method[M]. Beijing: China Agricultural Science and Technology Press, 2000. 191-192, 309-310.
[13] Subbarao G V, Wheeler R M, Stutte G Wetal. How far can sodium substitute for potassium in redbeet[J]. J. Plant Nutr., 1999, 22: 1745-1761.
[14] Haneklaus S, Knudsen L, Schnug E. Relationship between potassium and sodium in sugar beet[J]. Soil Sci. Plant Anal., 1998, 29: 1793-1798.
[15] 李三相, 周向睿, 王锁民. Na在植物中的有益作用[J]. 中国沙漠, 2008, 28(3): 485-488.
Li S X, Zhou X R, Wang S M. Positive functions of sodium in plants[J]. J. Desert Res., 2008, 28(3): 485-488.
[16] 胡月楠, 贺康宁, 王占林, 等. 盐胁迫对霸王水势的影响[J]. 中国沙漠, 2009, 29(5): 905-910.
Hu Y N, He K N, Wang Z Letal. Effect of salt stress on water potential of common beancaper[J]. J. Desert Res., 2009, 29(5): 905-910.
[17] 王宝增, 刘玉杰. 低浓度NaCl对非盐生植物小麦的生理效应[J]. 南京农业大学学报, 2009, 32 (2): 15-19.
Wang B Z, LiuY J. Physiological effects of low concentration of NaCl on nonhalophyteTriticumaestivumL[J]. J. Nanjing Agric. Univ., 2009, 32 (2): 15-19.
[18] 陈国安. 硝酸钠对甜菜产质量和钾钠吸收的影响[J]. 中国甜菜, 1990, (3): 31-35.
Cheng G A. Effect of NaNO3on yield, quality and absorption of sodium and potassium of sugar beet[J]. China Sugar Beet, 1990, (3): 31-35.
[19] 刘国栋, 刘更另. 籼稻不同基因型对钾、 钠的反应[J]. 植物营养与肥料学报, 1999, 4 (4): 360-365.
Liu G D, Liu G L. The response of indica rice genotypes to different levels of potassium and sodium[J]. Plant Nutr. Fert. Sci., 1999, 4 (4): 360-365.
[20] 杨淑慎, 高俊凤. 活性氧、 自由基与植物的衰老[J]. 西北植物学报, 2001, 21(2): 215-220.
Yang S S, Gao J F. Influence of active oxygen and free radicals on plant senescence[J]. Acta Bot. Boreali-Occid. Sin., 2001, 21(2): 215-220.
[21] 王宝增, 赵可夫. 低浓度NaCl对玉米生长的效应[J]. 植物生理学通讯, 2006, 42(4): 628-632.
Wang B Z, Zhao K F. Effect of low concentration NaCl on the growth ofZeamaysL[J]. Plant Physiol. J., 2006, 42(4): 628-632.
