核桃壳吸附剂对水中Pb2+的吸附
2014-03-29鲁秀国党晓芳鄢培培
鲁秀国,党晓芳,鄢培培
(华东交通大学 土木建筑学院,江西 南昌 330013)
频繁的工业活动导致环境污染和生态问题日益凸显。重金属是一种危害较大的污染物,且具有不可降解性。因其毒性大,即使在较低浓度下也会对环境造成严重污染。环境中的Pb2+主要来自于电池生产车间和石油化工厂,尤其是电池厂在生产过程中将产生大量的含Pb2+废水,废水中Pb2+含量超出国家标准上百倍,如果不进行处理而任意排放,必然给环境与社会带来极大危害。
目前,处理含Pb2+废水的方法包括化学沉淀法、离子交换法、膜分离法和吸附法等[1]。化学沉淀法是应用最为广泛的一种方法,方法简单、易操作,但对低浓度废水处理效果较差,且易产生大量污泥;离子交换法选择性高,可去除多种重金属,但离子交换树脂价格高,运行费用也偏高;生物吸附法可利用廉价生物材料对重金属进行吸附,尤其对低浓度废水处理效果明显[2-4]。核桃壳为农林废弃物,产量大、成本低,且本身性质稳定。
本工作以核桃壳为吸附剂,利用静态吸附法,考察吸附剂的粒径及加入量、初始废水pH、吸附时间对核桃壳吸附剂吸附模拟含Pb2+废水中Pb2+的影响因素及其吸附性能。
1 实验部分
1.1 试剂和仪器
硝酸铅、硝酸、氢氧化钠:分析纯。
ZD-8808型恒温振荡器:金坛市华城开元实验仪器厂;AA 280FS型火焰原子分光光度计:VARIAN公司;PHS-3E 型pH计:上海精科雷磁仪器厂;AB204-N型电子分析天平:中国科学仪器公司;DHG-9101-2S恒温鼓风干燥机:上海三发科学仪器。
1.2 实验方法
1.2.1 吸附剂的制备
不同产地的核桃壳对实验效果有一定影响。经数据比对,选用新疆产核桃壳。将核桃壳碾碎,依次过孔径为5.00,3.00,2.50,1.60,1.25,0.50 mm的方孔筛,筛分之后洗净核桃壳表面杂质,用蒸馏水浸泡并振荡,直至上清液清澈无浮色。将洗净的核桃壳于60 ℃下恒温干燥,制得核桃壳吸附剂。
1.2.2 模拟含Pb2+废水的配制
室温下称取1.598 9 g硝酸铅,用少量蒸馏水溶解,加入质量浓度为1.49 g/m L硝酸20 m L,转移至1 000 m L容量瓶中,定容,摇匀。得到Pb2+的质量浓度为1 000 mg/L的溶液。实验所需其他浓度废水均由此溶液稀释获得。
1.2.3 吸附—解吸实验
取100 m L一定Pb2+含量的废水,用硝酸或氢氧化钠溶液调节初始废水pH,加入一定量吸附剂于25 ℃下吸附一段时间,过滤,取滤液测定Pb2+的质量浓度,计算Pb2+去除率和吸附量。
采用浓度为0.1 mol/L的硝酸为解吸剂,将吸附饱和的吸附剂放入烧杯中,加入解吸剂解吸120 m in(解吸剂的体积以浸没吸附剂表面稍有盈余为准),过滤,清洗,直至洗后的溶液呈中性,烘干,备用。
1.3 分析方法
采用火焰原子吸收分光光度法测定Pb2+的质量浓度。
2 结果与讨论
2.1 吸附剂粒径对Pb2+去除率的影响
当初始Pb2+的质量浓度 20.00 mg/L、初始废水pH=5.5、吸附剂加入量 12 g/L、吸附时间 720 m in时,吸附剂粒径对Pb2+去除率的影响见图1。由图1可见:随吸附剂粒径的增大,Pb2+的去除率先增大后略有减小,这是因为,吸附剂粒径的增大,使吸附面积减小,提供的活性点数量减少,导致吸附率下降;当吸附剂粒径为1.60~2.50 mm时,Pb2+的去除率最大(为77.6%);而当吸附剂粒径为0.50~1.25 mm时,Pb2+的去除率最小,根据文献[5]的报道,核桃壳碾压过细,破坏了核桃壳内部的孔结构,导致Pb2+去除率减小。因此,选择吸附剂粒径为1.60~2.50 mm较适宜。

图1 吸附剂粒径对Pb2+去除率的影响
2.2 吸附剂加入量对Pb2+去除率的影响
当初始Pb2+的质量浓度 20.00 mg/L、初始废水pH=5.5、吸附剂粒径 1.60~2.50 mm、吸附时间 720 m in时,吸附剂加入量对Pb2+去除率的影响见图2。由图2可见:随吸附剂加入量的增加,Pb2+的去除率增大,当吸附剂加入量 为12 g/L时Pb2+的去除率为95.9%;此后,随吸附剂加入量的增加,Pb2+去除率基本均保持在95.0%以上。这主要是因为吸附剂加入量为4~12 g/L时,随吸附剂加入量的增加,使吸附面积增大,Pb2+去除率增大;当吸附剂加入量超过12 g/L时,即使增加吸附剂加入量,但溶液中Pb2+的质量浓度已经很小,故 Pb2+去除率基本稳定,但吸附量持续减少[6]。因此,选择吸附剂加入量为12 g/L较适宜。

图2 吸附剂加入量对Pb2+去除率的影响
2.3 初始废水pH对Pb2+去除率的影响
多数生物材料的吸附能力受pH的影响。当pH>7.0时,溶液中有Pb(OH)2沉淀生成[7],为避免沉淀干扰Pb2+的吸附,使用硝酸或氢氧化钠调节初始废水pH<7.0。当初始Pb2+的质量浓度 20.00 mg/L、吸附剂加入量12 g/L、吸附剂粒径 1.60~2.50 mm、吸附时间 720 m in时,初始废水pH对Pb2+去除率的影响见图3。由图3可见:当初始废水pH=2.0时,Pb2+的去除率仅为1.7%,这是因为H+与重金属离子之间存在竞争吸附关系[8];当初始废水pH=5.0时,Pb2+的去除率迅速增至90.8%,主要原因是pH=2.0~5.5时,溶液中分散的羧酸形成羧酸盐,从而阻碍羧酸与吸附剂表面活性电位的结合,使得金属离子的去除率显著增大[9];当初始废水pH=6.0时,重金属离子开始形成不溶解态氢氧化物,致使Pb2+的去除率降至30.9%;当初始废水pH=5.5时,Pb2+的去除率最大(为94.9%)。因此,选择初始废水pH=5.5较适宜。

图3 初始废水pH对Pb2+去除率的影响
2.4 吸附时间对Pb2+去除率的影响
当初始废水pH=5.5、吸附剂加入量 12 g/L、吸附剂粒径 1.60~2.50 mm时,吸附时间对Pb2+去除率的影响见图4。由图4可见:随吸附时间的延长,Pb2+的去除率增大;在吸附时间0~90 m in时,Pb2+的去除率增加较快;当吸附时间大于120 m in时,Pb2+的去除率变化很小,基本达到吸附平衡;当初始Pb2+的质量浓度20.00 mg/L、吸附时间 120 m in时,Pb2+的去除率为91.7% ,吸附量为1.108 mg/g。因此,选择吸附时间为120 m in较适宜。
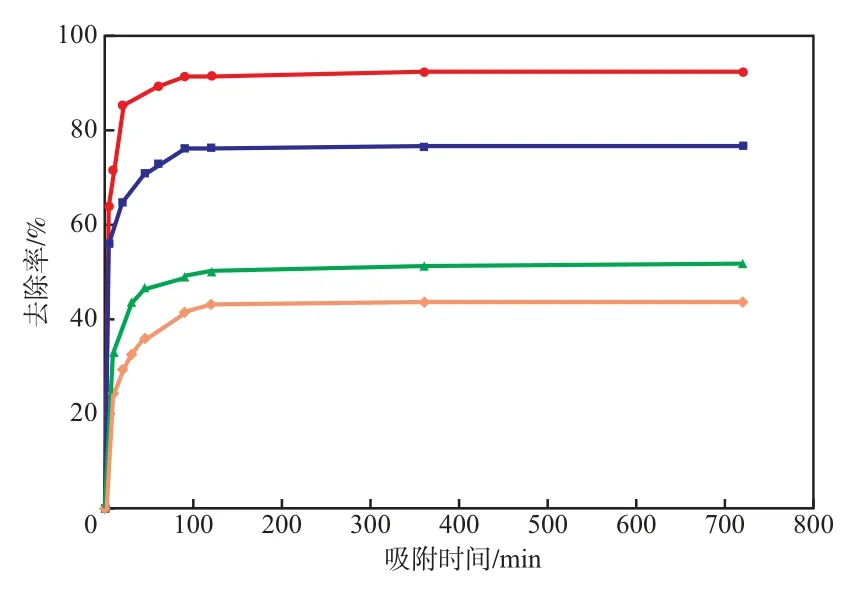
图4 吸附时间对Pb2+去除率的影响
2.5 Pb2+吸附动力学方程的拟合
为了更好地研究吸附剂对Pb2+吸附动力学的影响,分别采用拟一级、拟二级方程对图4的数据进行拟合,拟一级动力 学方程见式(1),拟二级动力学方程见式(2)。
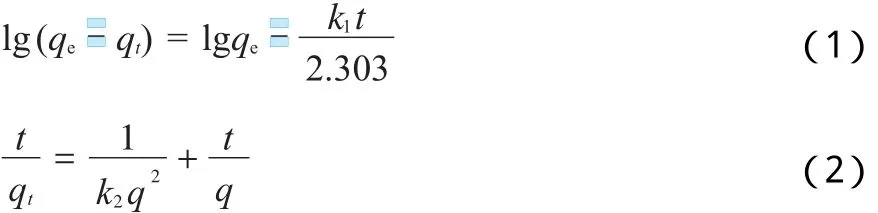
式中:qt,qe分别代表t时刻和吸附平衡时的吸附量,mg/g;t为吸附时间,m in;k1为拟一级动力学模型的吸附速率常数,m in-1;k2为拟二级动力学模型的吸附速率常数,g/(mg·m in)。拟一级与拟二级动力学模型的拟合参数见表1。

表1 拟一级与拟二级动力学模型的拟合参数
由表1可见,拟二级动力学模型拟合结果更好,相关系数高于拟一级动力学模型,且由拟二级动力学模型得出的平衡吸附量与实验数值更相符,说明吸附剂对Pb2+的吸附符合拟二级动力学模型,核桃壳对Pb2+的吸附速率由化学吸附所控制,而非步骤控制[10]。
2.6 Pb2+的吸附等温线
当初始Pb2+的质量浓度为 20.00,30.00,50.00,80.00,100.00 mg/L及初始废水pH=5.5、吸附剂加入量 12 g/L、吸附剂粒径1.60~2.50 mm、反应温度 25 ℃、吸附时间为120 min时,Langmuir方程的拟合曲线见图5,Freundlich方程的拟合曲线见图6。由图5和图6可见,Langmuir方程和Freundlich方程对数据拟合的相关系数分别为0.981 0,0.887 3;当初始Pb2+的质量浓度为80.00 mg/L时,采用Langmuir方程拟合得到的饱和吸附量为3.903 mg/g,与实验数据(3.542 mg/g)接近。Langmuir吸附等温式是单分子层吸附模式,说明核桃壳对Pb2+的吸附以化学吸附为主,从吸附状态看属于单层吸附[11]。因此,在探讨吸附剂的吸附能力时可用Langmuir方程数据。

图5 Langmuir方程的拟合曲线
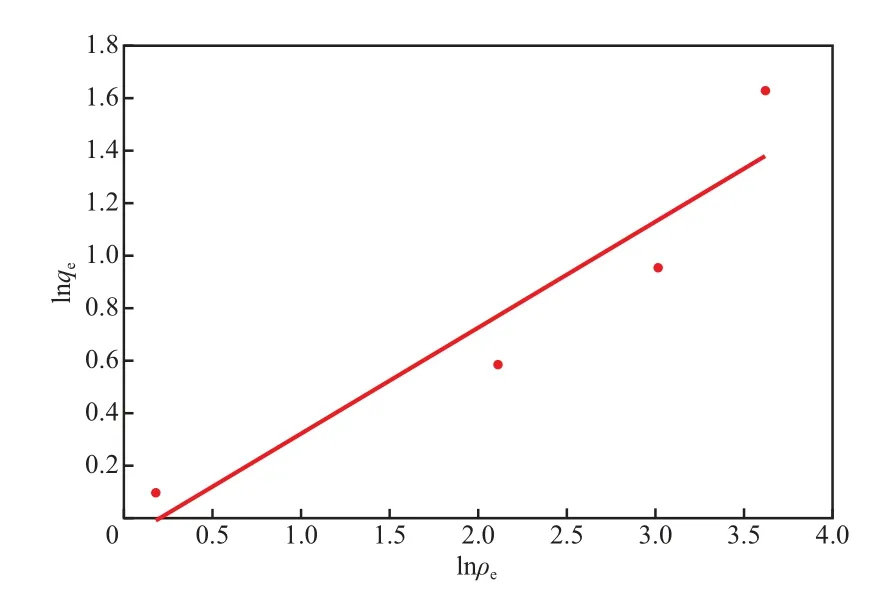
图6 Freundlich方程的拟合曲线
2.7 吸附剂的再生利用
吸附剂的再生方法很多,针对金属离子吸附而言,有报道指出盐酸、硫酸、硝酸等酸性物质通常是很好的解吸再生剂[12-13]。当初始Pb2+的质量浓度 20.00 mg/L、吸附剂加入量 12 g/L、初始废水pH=5.5、吸附时间120 m in时,吸附剂重复使用次数对Pb2+去除率的影响见表2。由表2可见:吸附剂重复使用6次时,Pb2+的去除率从95.9%减至90.3%,处理后废水中Pb2+的质量浓度 1.94 mg/L,不能满足GB8978—1996《污水综合排放标准》[14]中规定的要求(工业废水中Pb2+的质量浓度不能超过1.00 mg/L);但当重复使用3次时,Pb2+的去除率为95.1%,处理后废水中Pb2+的质量浓度达到0.98 mg/L,故工业使用时,吸附剂的重复使用次数为3次较适宜。

表2 吸附剂重复使用次数对Pb2+去除率的影响
3 结论
a)当初始Pb2+的质量浓度 20.00 mg/L、初始废水pH=5.5、吸附剂加入量 12 g/L、吸附剂粒径1.60~2.50 mm、吸附时间 120 m in时,自制核桃壳吸附剂对Pb2+的去除率达91.7%。
b)吸附剂对Pb2+的吸附行为满足拟二级动力学方程,吸附等温线满足Langmuir等温方程,饱和吸附量 3.903 mg/g。
c) 吸附饱和的吸附剂用浓度 0.1 mol/L的硝酸解吸,吸附剂重复使用3次后,Pb2+的去除率从95.9%减至95.1%,吸附后废水中Pb2+的质量浓度小于1.00 mg/L,满足GB8978—1996《污水综合排放标准》中规定的要求。
[1] 门彬,王东升. 重金属废水处理方法综述[J]. 水工业市场,2011(8):65-68.
[2] 周隽,翟建平,吕慧峰,等. 木屑和花生壳吸附去除水溶液中Cr3+的试验研究[J]. 环境污染治理技术与设备,2006,7(1):122-125.
[3] Johnson P D,Watson M A,Brown J,et al. Peanut hull pellets as a single use sorbent for the capture of Cu(Ⅱ) from wastewater[J]. Waste Manag,2002,22(3):471-480.
[4] Taty-Costodes V C,Fauduet H,Porte C,et al. Removal of Cd(Ⅱ) and Pb(Ⅱ) ions from aqueous solutions by adsorption onto sawdust of Pinus sylvestris[J]. J Hazard Mater,2003,105(1/2/3):121-142.
[5] 钟璐. 核桃壳与花生壳对模拟废水中Cr(Ⅵ)的吸附特性研究[D]. 华东交通大学土木建筑学院,2012.
[6] Vaghetti J C P,Lima E C,Royer B,et al. Pecan nutshell as biosor-bent to remove Cu (Ⅱ),Mn(Ⅱ)and Pb(Ⅱ)from aqueous solu-tions[J]. J Hazard Mater,2009,162(1):270-280.
[7] 冯宁川. 橘子皮化学改性及其对重金属离子吸附行为的研究[D]. 中南大学冶金科学与工程学院,2009.
[8] 杨凤,吴云海. 重金属废水的生物吸附研究进展[J].环境科学与管理,2006(4):81-83.
[9] Roberts J D,Caserio M C. Basic principles of organic chemistry[M]. 2 edition. London:Benjamin W A,1977:61.
[10] Ozacar M,Sengil I A. Adsorption of reactive dyes on calcined alunite from aqueous solutions[J]. J Hazard Mater,2003,B98:211-224.
[11] 崔龙哲,吴桂萍,邓克俭. 质子化剩余污泥吸附染料的性能及机理[J]. 化工学报,2007,58(15):1290-1295.
[12] Gong R,Ding Y,Liu H,et al. Lead biosorption and desorption by intact and pretreated Spirulina maxima biomass[J]. Chemosphere,2005,58(1):125 -130.
[13] Jana K,Edita V. Comparison of differences between copper bioaccumulation and biosorption[J]. Environ-Intern,2005,31(2):227-232.
[14] 原国家环境保护总局. GB8978—1996污水综合排放标准[S]. 北京:中国标准出版社,1996.
