混凝—Fenton法深度处理维生素B12废水
2014-03-29任洪强丁丽丽耿金菊
陈 琳,许 柯,任洪强,丁丽丽,耿金菊
(南京大学 环境学院污染控制与资源化研究国家重点实验室,江苏 南京 210046)
维生素B12(简称VB12)是一种由含钴的卟啉类化合物组成的B族维生素。我国是VB12生产大国,华北制药集团、石药集团、河北玉峰集团、宁夏多维药业等均是VB12生产企业[1]。VB12生产过程中会产生大量废水,废水中含有培养基残渣、大分子蛋白、酮类、丙酸、二甲基苯并咪唑等难降解物质[2]。冯斐等[2]用微电解—MBR工艺处理VB12生产废水的厌氧处理出水,出水COD达到230~280 mg/L。邢奕等[3]用微电解联合膨润土吸附处理VB12生产废水,COD和色度去除率分别达71%和88%。河北石家庄某VB12生产企业废水的处理工艺为厌氧—好氧生物处理,但出水无法满足GB8978—1996《污水综合排放标准》[4]规定的COD≤300 mg/L的要求。
本工作采用混凝—Fenton法对河北石家庄某VB12生产企业的废水进行深度处理,考察了各操作参数对COD和色度去除效果的影响,确定了最佳工艺条件,并从经济角度分析了工艺可行性,可为VB12废水的达标处理提供参考和借鉴。
1 实验部分
1.1 材料、试剂和仪器
废水取自河北石家庄某VB12生产企业厌氧—好氧工艺生化出水,水质情况:COD=640~820 mg/L,色度600~700倍,BOD5/COD=0.03,可生化性很差。
H2O2(26%(w)),FeSO4·7H2O,NaOH,H2SO4:分析纯;聚合硫酸铁(PFS):工业纯。
FE20型pH计:Mettler Toledo公司;SW 6型六联搅拌机:英国Armfield公司。
1.2 实验方法
1.2.1 混凝实验
取500 m L废水,用浓度为2 mol/L的NaOH或4 mol/L的H2SO4调节废水的混凝pH,加入5%(w)PFS溶液,以150 r/min的搅拌速率快搅3 min,以50 r/min的搅拌速率慢搅10 min,静置沉降后取上清液测定COD和色度。1.2.2 Fenton实验
取混凝出水500 m L,用浓度为2 mol/L的NaOH或4 mol/L的H2SO4调节废水的氧化pH,加入一定量的FeSO4·7H2O,搅拌溶解后,加入H2O2,以100 r/m in的搅拌速率氧化反应一段时间。反应结束后,立即取少量反应液测定H2O2的含量(加碱前H2O2的剩余量);然后加碱调节溶液pH至中性,搅拌均匀取混合液测COD;静置沉淀一段时间,待溶液分层后,取上清液测定COD、色度和H2O2的含量(加碱后H2O2的剩余量)。COD按文献 [5]报道的方法校正。混凝实验和Fenton实验均在室温(25±1)℃下进行。
1.3 分析方法
采用重铬酸钾法测定COD[6];采用稀释倍数法测定色度[6];采用硫酸钛分光光度法测定H2O2含量[7]。
2 结果与讨论
2.1 混凝实验结果
2.1.1 混凝pH对混凝效果的影响
当PFS加入量为300 mg/L时,混凝pH对混凝段COD和色度的去除率的影响见图1。当pH=3.5~6.5时,COD和色度的去除率的变化趋势基本相同;当pH=6.5~8.5时,混凝效果很差,COD去除率只有5%左右;当pH=4.5时,COD和色度的去除率达最大值(分别为28.5%和60.7%)。这是因为废水中含有较多的腐殖酸类物质,在酸性条件下,PFS混凝去除腐殖酸的效果较好[8-9]。故混凝pH为4.5较适宜。
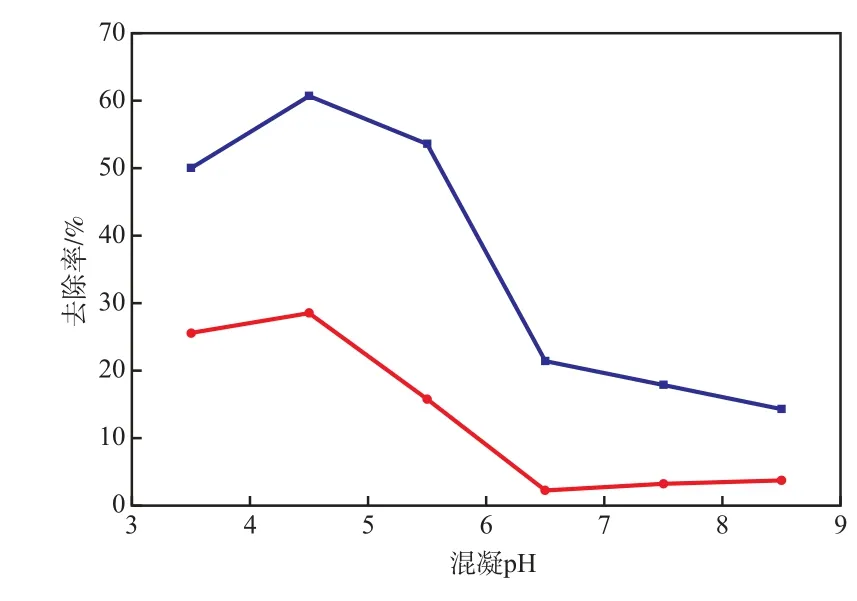
图1 混凝pH对混凝段COD和色度的去除率的影响
2.1.2 PFS加入量对混凝效果的影响
当混凝pH为4.5时,PFS加入量对混凝段COD和色度的去除率的影响见图2。由图2可见:PFS加入量从100 mg/L增至300 mg/L时,COD去除率从1.1%增至28.5%,色度去除率从21.4%增至60.7%;当PFS加入量大于300 mg/L时,COD和色度的去除率变化趋缓。故选择PFS加入量为300 mg/L较适宜。
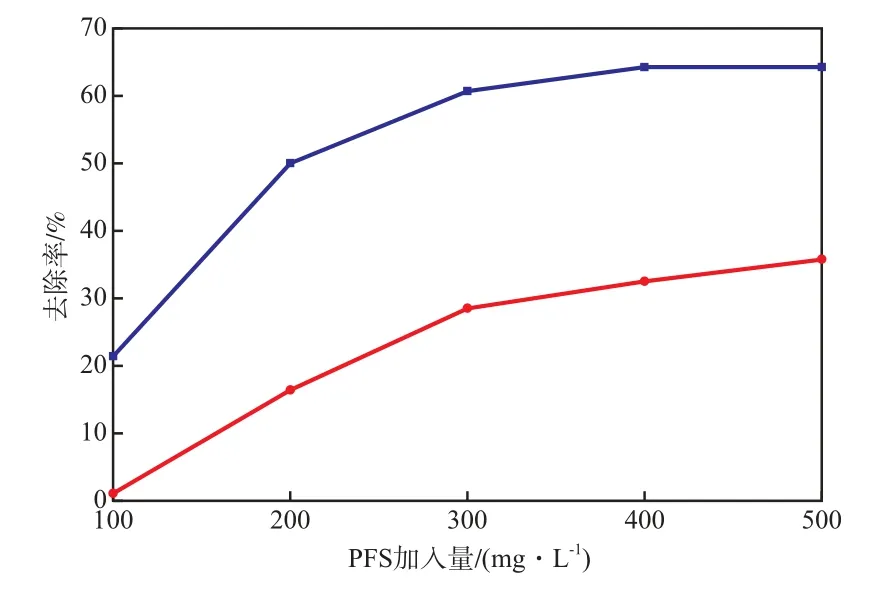
图2 PFS加入量对混凝段COD和色度的去除率的影响
2.2 Fenton实验结果
2.2.1 H2O2加入量对处理效果的影响
当氧化pH 3.0、 FeSO4·7H2O加入量300 mg/L、反应时间3 h时,H2O2加入量对Fenton 段COD和色度的去除率的影响见图3。由图3可见:当H2O2加入量小于420 mg/L时,COD和色度的去除率随H2O2加入量的增加而增大;当H2O2加入量大于420 mg/L时,COD和色度的去除率变化不大,H2O2的消耗量(H2O2加入量和加碱前H2O2剩余量的差值)却持续增大。这可能是因为在Fenton反应过程中,生成了一些难降解有机物(如短链有机酸等)[10-11],而过量H2O2与·OH发生反应[12],消耗了H2O2。故选择H2O2加入量为420 mg/L较适宜。
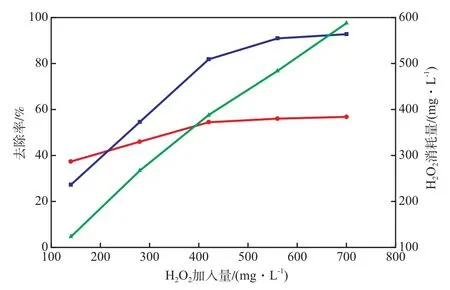
图3 H2O2加入量对Fenton段COD和色度的去除率的影响
2.2.2 FeSO4·7H2O加入量对处理效果的影响
当氧化pH 3.0、H2O2加入量420 mg/L、反应时间3 h时,FeSO4·7H2O加入量对Fenton段COD和色度的去除率的影响见图4。
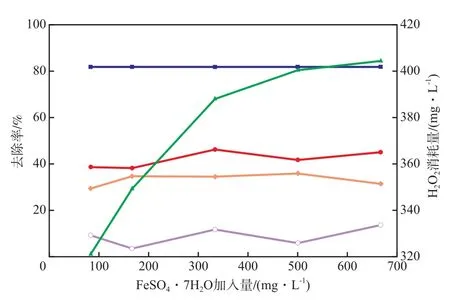
图4 FeSO4·7H2O加入量对Fenton段COD和色度的去除率的影响
Fenton法对有机物的去除作用可分为Fenton氧化作用和Fenton混凝作用,Fenton氧化作用去除的COD为进水COD 和反应混合液COD的差值;Fenton混凝作用去除的COD为Fenton法去除的全部COD 和Fenton氧化作用去除的COD的差值[12]。由于废水已经过混凝处理,所以Fenton混凝作用去除的COD较小,在10%左右波动。由图4可见,当FeSO4·7H2O加入量小于167 mg/L或大于500 mg/L时,Fenton氧化作用对COD的去除率均有减小的趋势。这是因为:Fe2+较少时,分解H2O2产生·OH的速率较慢;Fe2+过量时,会与·OH反应[13],与废水中的有机物形成竞争。考虑到COD和色度的去除效果以及减少H2O2的残留,选择FeSO4·7H2O加入量为334 mg/L较适宜。
2.2.3 氧化pH对处理效果的影响
当H2O2加入量420 mg/L、FeSO4·7H2O加入量334 mg/L、反应时间3 h时,氧化pH对Fenton段COD和色度的去除率的影响见图5。由图5可见:当pH=2.5~5.0时,COD和色度的去除率均较高,COD去除率为43.3%~45.2%,色度去除率为78.1%~81.8%;当pH=2.0时,COD和色度的去除率均减小,H2O2消耗量随之减小。这是因为:pH过低时,Fe2+在水溶液中形成了分解H2O2速率相对较慢的[Fe(H2O)]2+,产生的·OH减少[14],但H+含量过高也会抑制Fe3+与H2O2之间的反应[15];当pH>5.0时,COD和色度的去除率降低,H2O2消耗量减少,这可能是因为Fe3+形成了不溶性的Fe(OH)3絮体,打断了·OH产生链。混凝工艺出水的pH在4.0左右时,可不调节pH,直接进行Fenton反应。
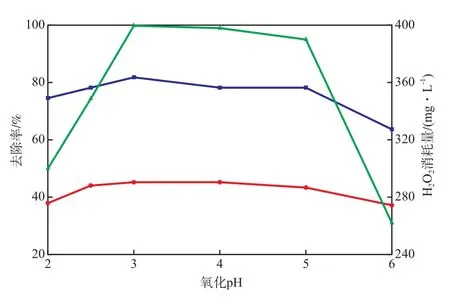
图5 氧化pH对Fenton 段COD和色度的去除率的影响
2.2.4 反应时间对处理效果的影响
当氧化pH 4.0、H2O2加入量420 m g/L、FeSO4·7H2O加入量334 mg/L时,反应时间对Fenton段COD和色度的去除率的影响见图6。由图6可见:当反应时间为1 h时,COD和色度的去除率已基本稳定,H2O2的消耗量较小;反应时间为3 h时,COD和色度的去除率分别为45.3%和78.2%,大部分H2O2已消耗。剩余的H2O2在加碱中和时会分解产生氧气,不利于Fenton反应的絮体沉降。故选择反应时间为3 h较适宜。
2.3 混凝—Fenton法与Fenton法的比较
在较适宜的条件下采用混凝—Fenton法对VB12废水生化出水进行优化时,试剂消耗量为:H2SO4830 mg/L,PFS 300 mg/L,H2O2420 mg/L,FeSO4·7H2O 334 mg/L,NaOH 480 mg/L;在此条件下,总COD去除率为62.1%,总色度去除率为90.0%。
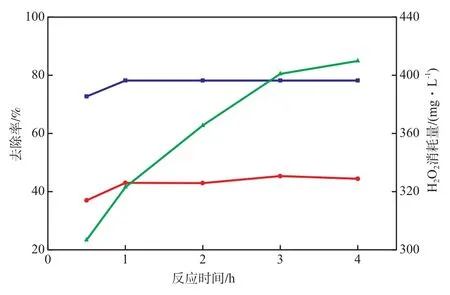
图6 反应时间对Fenton段 COD和色度的去除率的影响
在较适宜的条件下采用Fenton法对VB12废水生化出水进行优化时,试剂消耗量为:H2SO4830 mg/L,H2O2700 mg/L,FeSO4·7H2O 834 mg/L,NaOH 480 mg/L;在此条件下,COD去除率为52.9%,色度去除率为79.1%。
与Fenton法相比,混凝—Fenton法的COD和色度去除率更大,处理效果更好,COD和色度去除率的提高率分别为17.4%和13.8%。两种方法的药剂成本见表1。由表1可见,混凝—Fenton法的药剂成本为4.51 元/m3,Fenton法的药剂成本为5.75 元/m3。与Fenton法相比,混凝—Fenton法的药剂成本降低了21.6%。
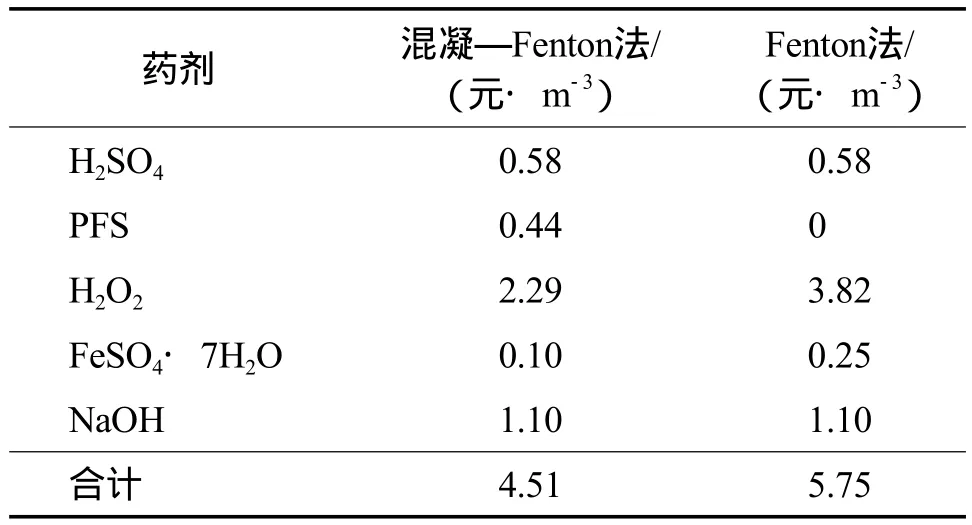
表1 两种方法的药剂成本
3 结论
a)当混凝pH 4.5、PFS加入量300 mg/L时,混凝对COD和色度的去除率分别为28.5%和60.7%。
b)对混凝出水进行Fenton法处理,当氧化pH 4.0、H2O2加入量420 mg/L、FeSO4·7H2O加入量334 mg/L、反应时间3 h时,Fenton段对COD和色度的去除率分别为45.3%和78.2%。
c)混凝—Fen ton法在较适宜的条件下,总COD和总色度的去除率分别为62.1%和90.0%;与Fenton法相比,COD和色度的去除率的提高率分别为17.4%和13.8%,且药剂成本降低了21.6%。
[1] 马蕙,王丽丽,张春晓,等. 维生素B12的生物合成、发酵生产与应用[J]. 生物工程学报,2008,24(6):927-932.
[2] 冯斐,许振良,王锦龙,等. 微电解-MBR工艺处理VB12废水的实验研究[J]. 工业水处理,2009,29(5):61-64.
[3] 邢奕,鲁安怀,李慧军,等. 微电解联合物化法处理维生素B12难降解废水的研究[J]. 环境工程学报,2010,(10):2267-2272.
[4] 原国家环境保护总局. GB8978—1996 污水综合排放标准[S]. 北京:中国标准出版社,1996.
[5] Kang Y W,Cho M J,Hwang K Y. Correction of hydrogen peroxide interference on standard chemical oxygen demand test[J]. Water Res,1999,33(5):1247-1251.
[6] 原国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法[M]. 4版. 北京:中国环境科学出版社,2010:211-213.
[7] 刘小为,陈忠林,沈吉敏,等. 硫酸钛光度法测定O3/H2O2体系中低浓度H2O2[J]. 中国给水排水,2010,26(16):126-129.
[8] Cheng W P,Fung H C. A study of coagulation mechanisms of polyferric sulfate reacting with humic acid using a fluorescence quenching method[J]. Water Res,2002,36( 18):4583-4591.
[9] 李辉,王毅力,孙文童. 聚合硫酸铁(PFS)混凝腐殖酸(HA)的过程中典型操作因素的影响研究[J]. 环境科学学报,2012,32 (12):2912-2920.
[10] Rivas F J,Beltran F J,Frades J,Buxeda P. Oxidation ofp-hydroxybenzoic acid by Fenton’s reagent[J].Water Res,2001,35:387-396.
[11] Guinea E,Brillas E,Centellas F,et al. Oxidation of enrofloxacin with conductive-diamond electrochemical oxidation,ozonation and Fenton oxidation A comparison[J]. Water Res,2009,43:2134.
[12] Kang Y W,Hwang K Y. Effects of reaction conditions on the oxidation efficiency in the Fenton process[J].Water Res,2000,34(10):2786-2790.
[13] Buxton G V,Greenstock C L. Critical review of rate constants for reactions of hydrated electrons[J]. J Phys Chem Ref Data,1988,17 (2):513-886.
[14] Gallard H,De Laat J,Legube B. Effect of pH on the oxidation rate of organic compounds by Fe-II/H2O2,mechanisms and simulation[J]. New J Chem,1998,22(3):263-268.
[15] Pignatello J J. Dark and photoassisted Fe3+-catalyzed degradation of chlorophenoxy herbicides by hydrogenperoxide[J]. Environ Sci Technol,1992,26(5):944-951.
