主要营养素源对工业化养殖豹纹鳃棘鲈生长、体色和消化吸收的影响
2014-03-28周邦维高婷婷赵宁宁于学权胡金城
周邦维 李 勇* 高婷婷 柳 阳 赵宁宁 于学权 胡金城
豹纹鳃棘鲈(Plectropomus leopardus),俗称东星斑,属鲈形目,科,石斑鱼亚科,鳃棘鲈属。其营养丰富,肉味鲜美,同时艳丽的体色又赋予其很好的观赏价值,故经济价值极高,具有广阔的市场前景。国内对豹纹鳃棘鲈的育苗及养殖已经取得成功[1-2],国内外学者已对其生态学、繁殖生理、分子分类、仔鱼行为、胚胎发育等[3-11]进行了研究,但针对其营养需求的研究十分鲜见。目前,对其他石斑鱼种如点带石斑鱼(Epinephelus coioides)、赤点石斑鱼(Epinephelus akaara)等营养需求的研究[12-13]较多,可为同一亚科的豹纹鳃棘鲈营养需求研究提供借鉴。另外,豹纹鳃棘鲈的体色对其市场价格影响较大,亮泽肤色可在很大程度上提高其经济价值。有关饲料营养对观赏鱼体色影响的研究[14-15]较为丰富,但对食用养殖鱼体色影响的研究较少,而关于通过蛋白质源色素原料组合改善豹纹鳃棘鲈体色的研究尚未见报道。
本试验拟在封闭循环水养殖条件下,通过对营养素(蛋白质和脂肪)水平与蛋白质源色素(含色素原料)进行组配,探寻其对豹纹鳃棘鲈生长、体色和消化吸收的影响,初步确定其适宜的营养素水平与蛋白质源色素组合,从而得到生长速率快、体色鲜艳的豹纹鳃棘鲈养殖产品,为提高豹纹鳃棘鲈工业化养殖的营养调控和饲料配制技术提供科学依据和应用借鉴。
1 材料与方法
1.1 试验设计
在工业化海水养殖条件下进行动物养殖试验,采用2×2×2三因素试验设计,2个营养素因素:蛋白质水平——46%蛋白质(P46)、50%蛋白质(P50),脂肪水平——8%脂肪(L8)、10%脂肪(L10);1个营养源因素:蛋白质源色素——植物性蛋白质源色素(VPP)(玉米蛋白粉和棉籽蛋白粉)、动物性蛋白质源色素(APP)(鱼粉和血粉),共形成8种试验饲料(1#~8#处理,表1),每个处理设3个重复。试验用鱼由天津市海发珍品实业发展有限公司提供,从同一生产车间养殖池的同源同批豹纹鳃棘鲈幼鱼中挑选规格整齐、体格健壮、平均体重在(64.2±1.1)g 的幼鱼 720 尾,随机分配到24个养殖桶(重复)中,每个重复30尾鱼。
1.2 试验饲料
8种试验饲料组成及营养水平见表2。按照配方组成和比例,在大型饲料车间将相关原料一次混合、超微粉碎,再经二次混合后用双螺杆挤压膨化机(瑞士布勒机型)制成直径为5 mm的缓沉型膨化颗粒配合饲料,经烘干、冷却、打包后待用。随机抽取各试验饲料样品进行有关营养成分分析。

表1 试验设计Table 1 Experimental design
1.3 饲养管理
养殖试验在天津市海发珍品实业发展有限公司封闭循环水养殖场2车间进行,预试期10 d,正试期 94 d,试验鱼养殖在内径 1.0 m、水深 0.5 m 的圆形桶中。养殖桶内水24 h循环,循环量为480 L/h,水温(25.4±1.0)℃,盐度 22‰ ~ 23‰,pH 7.2~7.5,溶氧浓度 12.1~12.3 mg/L。试验期间,每天 07:20、11:00、15:00、19:00 进行投喂,每次投喂至出现少许残饵视为饱食,残饵及粪便以虹吸法清除。每天记录投喂量、残饵量和采食量,出现死鱼及时捞出并称重记录。
1.4 样品采集与测定
试验结束后,试验鱼饥饿24 h空腹称重。从每个养殖桶中各选取3尾中等体重的健康试验鱼,经40 mg/kg鱼安定(MS-222)麻醉处理后,在冰盘中解剖取得背鳍两侧的皮肤组织以及胃肠道组织,样品-20℃保存待测。试验饲料营养成分测定参考 GB/T 14924.9—2001。
1.5 检测指标及方法
1.5.1 生长性能指标计算


表2 试验饲料组成及营养水平(风干基础)Table 2 Composition and nutrient levels of experimental diets(air-dry basis) %
1.5.2 皮肤中色素含量测定
选择皮肤中胡萝卜素、叶黄素、黑色素含量3个指标进行测定。取出皮肤组织样品,室温解冻,生理盐水清洗,滤纸吸干后冰浴匀浆、离心处理。使用 RD Fish Carotene ELISA、RD Fish Lutein ELISA、RD Fish Melanin ELISA试剂盒,按照试剂盒说明书将匀浆样品与生物素抗体(胡萝卜素抗体、叶黄素抗体、黑色素抗体)、辣根过氧化物酶(HRP)标记链霉亲和素进行酶联免疫反应,通过酶联免疫检测仪(华东电子DG5033A酶标仪)在450 nm处进行比色,分别测定皮肤中胡萝卜素、叶黄素、黑色素含量。
试验测定过程中注意:在测定前将试剂盒在室温下放置40 min,所有试剂在使用前都轻轻摇匀;加样时将样本加于酶标板底部,尽量不触及孔壁,轻轻晃动混匀。
1.5.3 消化吸收相关指标测定
使用南京建成生物工程研究所生产的试剂盒,按照试剂盒说明书操作测定胃肠道中消化相关酶(脂肪酶、淀粉酶、胃蛋白酶、胰蛋白酶)及吸收相关酶(碱性磷酸酶、Na+,K+-ATP酶)活性。在测定前将组织样品冰浴匀浆、离心预处理,并通过预试验确定稀释倍数后进行正式测定。
1.6 统计分析
试验数据用SPSS 16.0统计分析软件进行三因素方差分析。因素间差异显著时,采用LSD法进行多重比较。结果均采用“平均值±标准差”表示。
2 结果与分析
2.1 生长性能
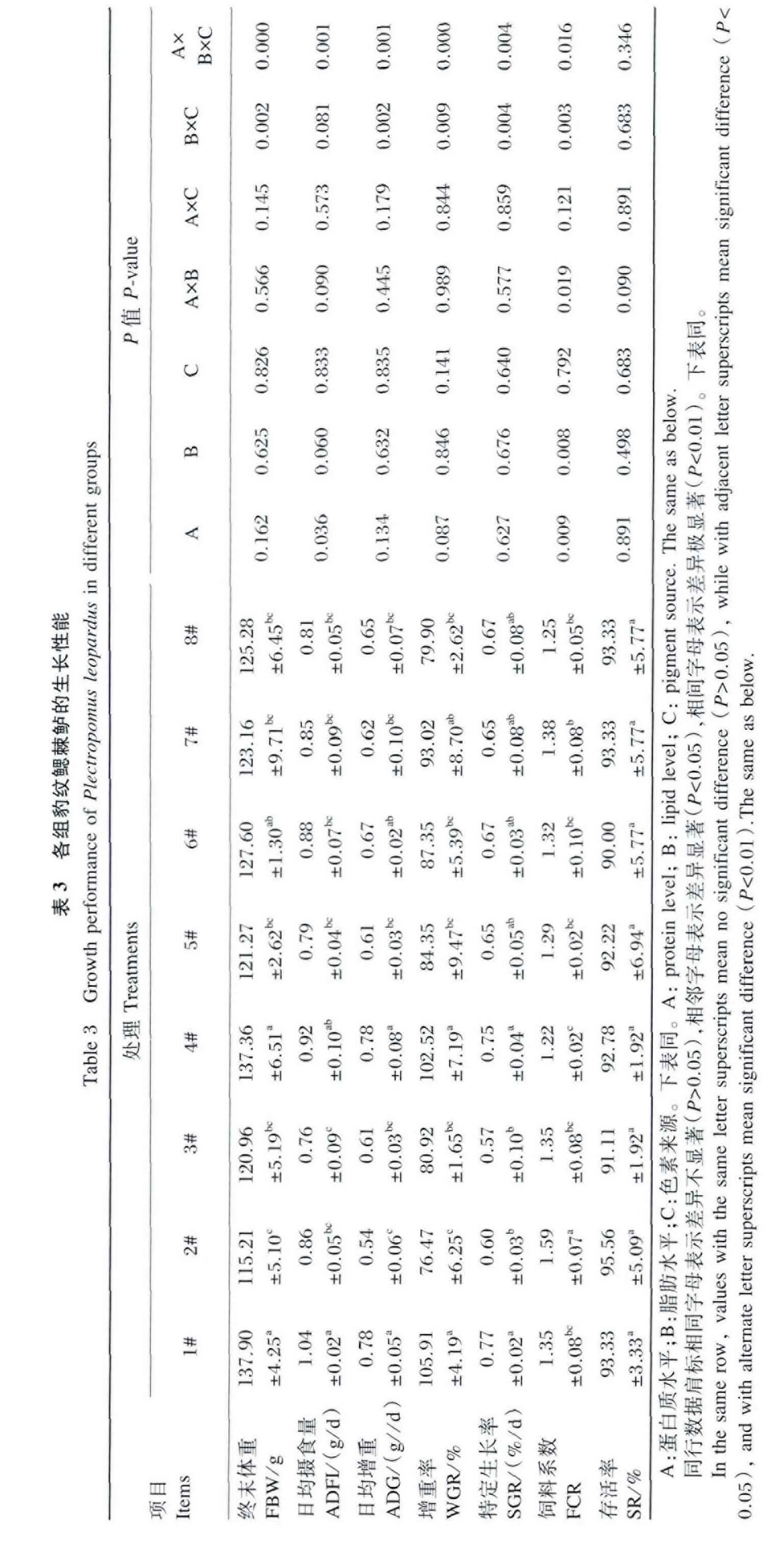
2.1.1 存活率
表3显示各处理试验鱼的存活率均在90%以上,处理间差异不显著(P>0.05)。
2.1.2 日均摄食量
图1显示了试验期间各处理试验鱼日均摄食量的变化情况,随试验时间的推移,日均摄食量呈缓慢上升趋势,表明试验鱼摄食处于正常状态。表3显示了各处理试验鱼94 d的日均摄食量。其中,蛋白质水平对其有显著影响(P<0.05),表现为P46组显著高于 P50组(P<0.05)(图2);蛋白质水平、脂肪水平与色素来源三因素互作对其有极显著影响(P<0.01),表现为 P46、L8与 VPP 组合的1#处理最高,P46、L10与APP组合的4#处理次之,1#处理显著或极显著高于除4#处理外的其他6个处理(P<0.05 或 P<0.01),提高幅度为18.2%~36.8%。

图1 试验期间各处理豹纹鳃棘鲈日均摄食量变化趋势Fig.1 Change trends of ADFI of Plectropomus leopardus in different treatments during experimental period
2.1.3 增重
由表3可知,蛋白质水平、脂肪水平、色素来源对日均增重、增重率、特定生长率的影响均不显著(P>0.05),但脂肪水平与色素来源两因素互作以及蛋白质水平、脂肪水平与色素来源三因素互作对这3个指标的影响均达到极显著水平(P<0.01)。由图3可知,L8VPP组的增重率极显著高于 L8APP组(P<0.01),显著高于 L10VPP 组(P<0.05);L10APP组的增重率显著高于 L8APP组(P<0.05)。由于 1#、4#处理日均摄食量较高,其增重率也相应较高,除与P50、L10和VPP组合的7#处理差异不显著(P>0.05)外,二者均显著或极显著高于其他 5 个处理(P<0.05 或 P<0.01)。

图2 蛋白质水平对豹纹鳃棘鲈日均摄食量的影响Fig.2 Effects of protein level on ADFI of Plectropomus leopardus
2.1.4 饲料系数
由表3可知,蛋白质水平、脂肪水平对饲料系数均有极显著影响(P<0.01),表现为P50组显著低于 P46组(P<0.05),L10组显著低于 L8组(P<0.05)(图4);蛋白质水平与脂肪水平两因素互作对饲料系数有显著影响(P<0.05),表现为P46L10、P50L8、P50L10组显著低于 P46L8组(P<0.05)(图5);脂肪与色素两因素互作对饲料系数有极显著影响(P<0.01),表现为L10APP组显著或极显著低于 L8APP、L10VPP组(P<0.05或 P<0.01),L8VPP、L10VPP 组显著低于 L8APP 组(P<0.05)(图 6)。8 个处理中,P46、L8 和 APP 组合的2#处理的饲料系数显著或极显著高于其他7个处理(P<0.05 或 P<0.01),而 4#处理具有最低的饲料系数。

图3 脂肪水平与色素来源互作对豹纹鳃棘鲈增重率的影响Fig.3 Effects of lipid level and pigment source interaction on WGR of Plectropomus leopardus
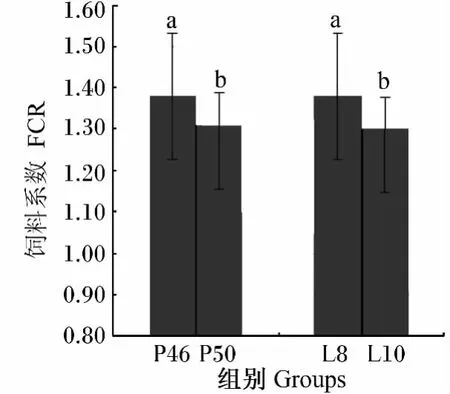
图4 蛋白质水平或脂肪水平对豹纹鳃棘鲈饲料系数的影响Fig.4 Effects of protein level or lipid level on FCR of Plectropomus leopardus
可见,P46、L8与VPP的组合可提高豹纹鳃棘鲈的摄食量。从单因素影响来看,虽然P50更有利于提高饲料利用率,但是P46与L10的组合效果更佳,又因L10与APP的组合显著提高了增重率,因而P46、L10与 APP的组合(4#处理)对提高豹纹鳃棘鲈的生长及饲料利用率具有最佳效果。
2.2 皮肤中色素含量
从表4可以看出,8个处理的豹纹鳃棘鲈每100 g皮肤中胡萝卜素含量范围为 87.06~150.10 ng,在3种色素中所占比例范围为76.1%~8 0.3%,是皮肤色素主导因子;黑色素次之,每100 g皮肤中含量范围为 25.88~43.97 ng,所占比例范围为 19.5%~23.4%;叶黄素最少,每 100 g皮肤中含量范围为 0.64~1.21 ng,仅占0.4% ~0.7%。

图5 蛋白质水平与脂肪水平互作对豹纹鳃棘鲈饲料系数的影响Fig.5 Effects of protein level and lipid level interaction on FCR of Plectropomus leopardus

图6 脂肪水平与色素来源互作对豹纹鳃棘鲈饲料系数的影响Fig.6 Effects of lipid level and pigment source interaction on FCR of Plectropomus leopardus
2.2.1 胡萝卜素含量
由表4可知,蛋白质水平对皮肤中胡萝卜素含量有显著影响(P<0.05),脂肪水平对皮肤中胡萝卜素含量有极显著影响(P<0.01),表现为P50组显著高于 P46组(P<0.05),L8组极显著高于L10 组(P<0.01)(图 7)。8 个处理中,以 P50、L46与APP组合的6#处理皮肤中胡萝卜素含量最高,显著高于 8#处理(P<0.05),极显著高于 3#、4#处理(P<0.01)。

图7 蛋白质水平或脂肪水平对豹纹鳃棘鲈皮肤中胡萝卜素及黑色素含量的影响Fig.7 Effects of protein level or lipid level on carotene and melanin contents in skin of Plectropomus leopardus
2.2.2 叶黄素含量
由表4可知,蛋白质水平、脂肪水平和色素来源对皮肤中叶黄素含量均无显著影响(P>0.05);蛋白质水平与脂肪水平两因素互作对皮肤中叶黄素含量有显著影响(P<0.05),表现为 P46L8、P50L10组显著高于 P46L10、P50L8组(P<0.05)(图8);蛋白质水平与色素来源两因素互作对皮肤中叶黄素含量有显著影响(P<0.05),表现为P46VPP、P50APP组显著高于 P46APP、P50VPP组(P<0.05)(图 9)。8个处理中,P46、L8 和 VPP 组合的1#处理皮肤中叶黄素含量最高,显著高于2#~7#处理(P<0.05),比含量最低的 4#处理提高了 80.6%。

图8 蛋白质水平与脂肪水平互作对豹纹鳃棘鲈皮肤中叶黄素含量的影响Fig.8 Effects of protein level and lipid level interaction on lutein content in skin of Plectropomus leopardus
2.2.3 黑色素含量
由表4可知,脂肪水平对皮肤中黑色素含量有极显著影响(P<0.01),表现为L10组极显著低于 L8组(P<0.01)(图 7)。8 个处理中,P46、L10分别与VPP、APP组合的3#、4#处理皮肤中黑色素含量均较低,显著低于 1#和 6#处理(P<0.05),3#处理较 1#、6#处理分别降低了 36.4%、41.1%,4#处理较 1#、6#处理分别降低了 30.9%、36.0%。
综合来看,P50、L8均可提高豹纹鳃棘鲈皮肤中胡萝卜素含量,同时L8还可提高皮肤中黑色素含量。P50、L8与APP的组合(6#处理)使豹纹鳃棘鲈皮肤中胡萝卜素和黑色素含量均达到最高。相对于胡萝卜素和黑色素,豹纹鳃棘鲈皮肤中叶黄素含量相对很少,对体色的影响小,可忽略。
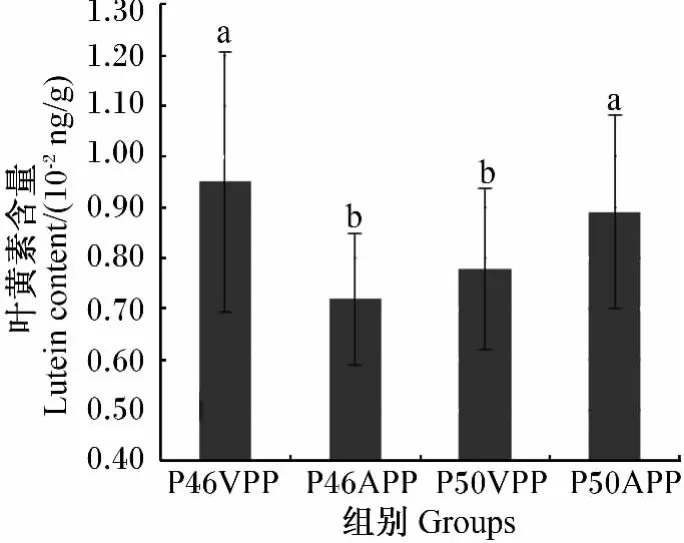
图9 蛋白质水平与色素来源互作对豹纹鳃棘鲈皮肤中叶黄素含量的影响Fig.9 Effects of protein level and pigment source interaction on lutein content in skin of Plectropomus leopardus
2.3 消化吸收相关酶活性
2.3.1 脂肪酶活性
由表5可知,蛋白质水平对脂肪酶活性有显著影响(P<0.05),脂肪水平对脂肪酶活性有极显著影响(P<0.01),表现为P50组显著高于 P46组(P<0.05),L10 组极显著高于 L8 组(P<0.01)(图10)。此外,P50、L10与VPP组合的7#处理具有最高的脂肪酶活性,显著高于除4#处理外的其他各处理(P<0.05),提高了 64.9%~109.3%。

图10 蛋白质水平或脂肪水平对豹纹鳃棘鲈胃肠道中脂肪酶活性的影响Fig.10 Effects of protein level or lipid level on lipase activity in gastrointestinal tract of Plectropomus leopardus
2.3.2 淀粉酶活性
由表5可知,蛋白质水平、脂肪水平对淀粉酶活性均有极显著影响(P<0.01),表现为P50组极显著高于P46组(P<0.01),L10组极显著高于L8组(P<0.01)(图 11)。8 个处理中,P50、L10 分别与VPP、APP组合的7#、8#处理具有相对较高的淀粉酶活性,二者的均值比1#和2#处理的均值提高了 215.4%。

图11 蛋白质水平或脂肪水平对豹纹鳃棘鲈胃肠道中淀粉酶活性的影响Fig.11 Effects of protein level or lipid level on amylase activity in gastrointestinal tract of Plectropomus leopardus
2.3.3 胃蛋白酶活性
由表5可知,蛋白质水平、脂肪水平对胃蛋白酶活性均有极显著影响(P<0.01),色素来源对胃蛋白酶活性有显著影响(P<0.05),具体表现为P50组极显著高于 P46组(P<0.01),L10组极显著高于L8组(P<0.01),VPP组显著高于 APP组(P<0.05)(图 12)。在 8 个处理中,P50、L10 与VPP组合的7#处理具有最高的胃蛋白酶活性,显著高于其他 7个处理(P<0.05),提高了25.3%~93.7%。
2.3.4 胰蛋白酶活性
由表5可知,脂肪水平对胰蛋白酶活性有极显著影响(P<0.01),表现为L10组极显著高于L8组(P<0.01)(图13);脂肪水平与色素来源两因素互作对胰蛋白酶活性有显著影响(P<0.05),表现为L10APP组显著高于 L10VPP组(P<0.05),极显著高于 L8VPP、L8APP 组(P<0.01)(图 14)。在8个处理中,P46、L10与APP组合的4#处理具有最高的胰蛋白酶活性,比最低的2#处理提高了65.6%(P<0.01)。

图12 蛋白质水平、脂肪水平或色素来源对豹纹鳃棘鲈胃肠道中胃蛋白酶活性的影响Fig.12 Effects of protein level,lipid level or pigment source on pepsin activity in gastrointestinal tract of Plectropomus leopardus

图13 蛋白质水平对豹纹鳃棘鲈胃肠道中胰蛋白酶活性的影响Fig.13 Effects of protein level on trypsin activity in gastrointestinal tract of Plectropomus leopardus
2.3.5 碱性磷酸酶活性
由表5可知,蛋白质水平对碱性磷酸酶活性有极显著影响(P<0.01),表现为P50组极显著高于P46组(P<0.01)(图15);蛋白质水平与脂肪水平两因素互作对碱性磷酸酶活性有显著影响(P<0.05),表现为 P50L8组显著高于 P46L10组(P<0.05),极显著高于 P46L8 组(P<0.01),且 P50L10组显著高于P46L8组(P<0.05)(图16)。在8个处理中,P50、L8与APP组合的6#处理具有最高的碱性磷酸酶活性,显著或极显著高于1#~3#处理(P<0.05 或 P<0.01),较 1#~3#处理分别提高了109.3%、306.9%、112.2%。
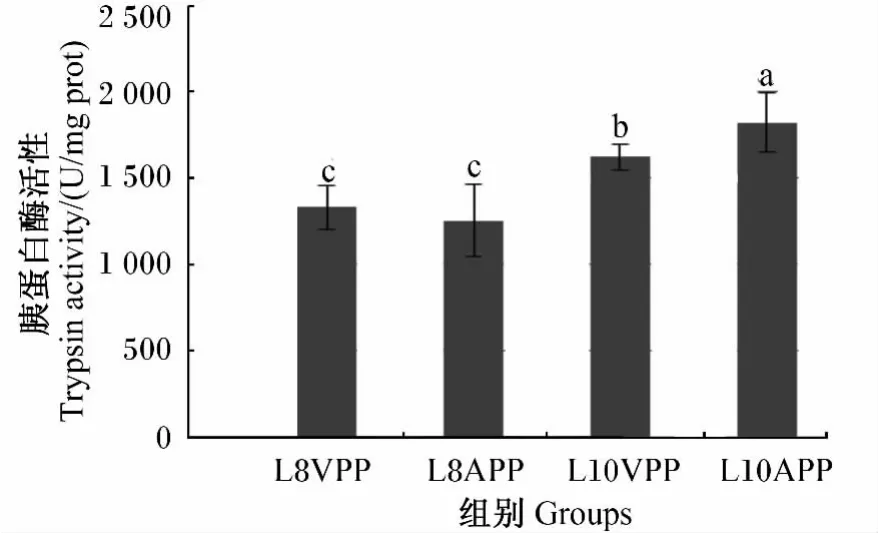
图14 脂肪水平与色素来源互作对豹纹鳃棘鲈胃肠道中胰蛋白酶活性的影响Fig.14 Effects of lipid level and pigment source interaction on trypsin activity in gastrointestinal tract of Plectropomus leopardus

图15 蛋白质水平对豹纹鳃棘鲈胃肠道中碱性磷酸酶活性的影响Fig.15 Effects of protein level on AKP activity in gastrointestinal tract of Plectropomus leopardus
2.3.6 Na+,K+-ATP 酶活性
由表5可知,蛋白质水平对Na+,K+-ATP酶活性有极显著影响(P<0.01),表现为P50组极显著高于 P46组(P<0.01)(图 17);脂肪水平对 Na+,K+-ATP酶活性有显著影响(P<0.05),表现为L10组显著高于L8组(P<0.05)(图17)。与碱性磷酸酶类似,Na+,K+-ATP酶的活性也在 P50、L8与APP组合的6#处理获得最高值,显著或极显著高于 1#~3#处理(P<0.05 或 P<0.01),较 1#~3#处理分别提高了 36.7%、101.2%、39.0%。
可见,P50、L10能提高相应消化酶的活性,VPP能够提高胃蛋白酶活性,因此 P50、L10与VPP的组合(7#处理)利于提高胃肠道中消化酶活性。与消化酶活性相对应,吸收酶活性也在P50、L10时表现较好,但P50、L8与APP的组合(6#处理)利于提高胃肠道中吸收酶活性。

图16 蛋白质水平与脂肪水平互作对豹纹鳃棘鲈胃肠道中碱性磷酸酶活性的影响Fig.16 Effects of protein level and lipid level interaction on AKP activity in gastrointestinal tract of Plectropomus leopardus

图17 蛋白质水平或脂肪水平对豹纹鳃棘鲈胃肠道中Na+,K+-ATP酶活性的影响Fig.17 Effects of protein level or lipid level on Na+,K+-ATPase activity in gastrointestinal tract of Plectropomus leopardus
?

?
3 讨论
3.1 主要营养素源对豹纹鳃棘鲈生长的影响
配合饲料中蛋白质和脂肪两大主要营养素对养殖鱼类生长发育具有重要意义。有关点带石斑鱼的研究表明,其幼鱼生长的最佳饲料蛋白质水平分别为 47.85%[16]和 48.00%[17],最佳饲料脂肪水平为9%[12];网箱养殖条件下,其最大生长所需的饲料脂肪水平为10%[18]。而尚未见有豹纹鳃棘鲈饲料中适宜蛋白质水平和脂肪水平的研究报道。本试验在封闭循环水条件下进行,结果显示,相比P46,P50更有利于提高豹纹鳃棘鲈的饲料利用率。但是,P46与L10的组合对其生长效果更佳,说明一定程度的提高脂肪水平能够降低豹纹鳃棘鲈对饲料蛋白质的需求,符合适量提高饲料脂肪水平可节约蛋白质的常规原理,也与三文鱼(Salmo salar)研究典型结果[19-20]相类似。至于 L8与 VPP的组合提高增重率的原因,可能与该组合植物蛋白质比例较高和低能量营养促使试验鱼采食量偏高有关。
本试验中,P46、L10与APP的组合最有利于提高豹纹鳃棘鲈的生长及饲料利用率,这与其日均摄食量较高且非最高的结果相一致。尚未见有类似的三因素组合效应的研究报道,本试验中APP为优质鱼粉和喷干血粉,对肉食性鱼类的生长发育优于VPP,故得到最优组合为该组合是合理的。
3.2 主要营养素源对豹纹鳃棘鲈体色的影响
本试验测定了豹纹鳃棘鲈皮肤中胡萝卜素、叶黄素及黑色素的含量,以此评估饲料主要营养素水平及色素来源对体色的影响,其中胡萝卜素与叶黄素利于形成鲜艳肤色,而黑色素反之。研究表明,饲料中添加富含虾青素的法夫酵母(Phaffia rhodozyma),可加深金鱼(Carassius auratus)的体色[14];螺旋藻投喂量越高,锦鲤(Cryprinus carpiod)体色越鲜艳[15];饲料添加类胡萝卜素后,花玛丽鱼(Molliensia)体色明显加深[21]。目前对豹纹鳃棘鲈体色效应的研究尚未见报道,关于封闭循环水养殖条件下饲料蛋白质水平、脂肪水平及蛋白质源色素对其体色影响的研究尚属空白。
本研究结果显示,L8较L10、P50较P46分别极显著和显著提高豹纹鳃棘鲈皮肤中胡萝卜素含量。因蛋白质水平为50%的各组均含有高量APP或VPP原料,加之通过提高胃肠道中脂肪酶活性而提高了对脂肪的消化能力,故能显著提高豹纹鳃棘鲈皮肤中胡萝卜素含量。虽然有报道称饲料脂肪水平偏低会影响鱼体消化道对饲料胡萝卜素的吸收[22],但本试验中8%的脂肪既满足了生长对脂肪的需要(表3),也满足了皮肤沉积胡萝卜素对脂肪的需要,至于其对皮肤中胡萝卜素含量的极显著提高作用的原因还需深入研究。蛋白质水平、脂肪水平与色素来源三因素互作效应显示,P50、L8与APP组合的6#处理豹纹鳃棘鲈皮肤中胡萝卜素含量最高,这一结果与该组合含有较多APP原料有关,也表明APP对胡萝卜素的沉积效果优于VPP。
本研究新发现,无论试验处理如何,都表现出胡萝卜素与黑色素含量增减同步的现象,如L8组、P50组和 6#处理等的同步增长,L10组、P46组、3#处理等的同步减少。这一新发现说明,优化或调控豹纹鳃棘鲈等鱼类的体色,并不是简单地增加胡萝卜素就能减少黑色素含量,而是一种对立统一的变化规律。当然,由于前者的绝对含量在3种色素(胡萝卜素、叶黄素、黑色素)中占主导地位(所占比例范围76.1%~80.3%),故通过营养调控增加胡萝卜素含量仍然会有效地改善肤色鲜艳度。另外,在养殖试验过程中观察到试验鱼偶然出现的应激反应均伴随其肤色变黑,说明皮肤黑色素对试验鱼是一种保护色素,从生物学角度不应视为影响其体色质量的因素。至于其作用机制以及如何更有效地顺应消费者需要,有待进一步深入研究。
3.3 主要营养素源对豹纹鳃棘鲈消化吸收的影响
3.3.1 对消化酶活性的影响
蛋白质、脂肪等饲料主要营养素水平对养殖鱼类消化酶活性有重要影响。Wang等[23]从生化与分子层面的研究得出,饲料蛋白质水平显著影响黄颡鱼(Pelteobagrus fulvidraco)胃蛋白酶、胰蛋白酶活性,相应其mRNA表达量也受到显著影响。饲料蛋白质水平和脂肪水平对大菱鲆(Scophthalmus maximus)胃肠道及肝胰脏中蛋白酶活性[24]、大西洋鲑胃肠道中消化酶活性也有显著影响[25]。其研究均表明,一定范围内提高饲料蛋白质水平或脂肪水平,胃肠道中蛋白酶、脂肪酶活性相应提高。本试验条件下,L10组较L8组显著提高了胃肠道中脂肪酶活性,符合此范围。但也与其他研究结果存在不一致,大西洋鲑和点带石斑鱼在饲料蛋白质水平为46%时胃肠道脂肪酶活性升高,增加脂肪的分解、供能[25-26];而本试验得出 P50 组反而较 P46组提高了胃肠道中脂肪酶活性。导致差异的原因可与试鱼种类、试验处理及条件等不同有关。
胰蛋白酶作为胃肠道中的主要蛋白酶,其活性单位在8个处理中的数值均在1 000 U/mg prot以上,是胃肠道中蛋白质消化的主导酶,此结果与本课题组在其他海水养殖肉食性鱼类,如大菱鲆[24]、半滑舌鳎(Cynoglossus semilaevis gunther)[25]、大西洋鲑[27]上的研究结果相一致。本研究结果显示,饲料高脂肪水平(10%)显著提高豹纹鳃棘鲈胃肠道胰蛋白酶活性,与Buchet等[28]关于红鼓鱼(Sciaenops ocellatus)的研究一致。Zhou等[29]在方斑东方螺(Babylonia areolate)上的研究发现,饲料脂肪水平在1.83%~11.73%范围内变化时胰蛋白酶活性先增后减,说明饲粮脂肪水平在一定范围内与胰蛋白酶活性呈正相关。此外,L10与APP的组合具有最高的胰蛋白酶活性,与生长性能中该两因素的组合显著提高增重率和降低饲料系数的结果相一致。从消化生理学角度分析,饲料脂肪水平较高时其蛋白质水平相应较少,需要加强对蛋白质的消化,而APP分解需要更具活力的蛋白质消化酶,从而共同促使该组合胰蛋白酶活性的提高。3.3.2 对吸收酶活性的影响
吸收与消化相辅相成,为评价各处理对豹纹鳃棘鲈营养吸收的效应,本试验测定了胃肠道中碱性磷酸酶和Na+,K+-ATP酶的活性。碱性磷酸酶与鱼类肠上皮细胞膜关联紧密,对脂肪与蛋白质营养的吸收与转运起到一定作用[30]。小肠对糖和蛋白质消化产物的吸收均依赖于钠离子偶联来实现,因此Na+,K+-ATP酶的活性可间接反映小肠黏膜的吸收功能[31]。已有研究报道,增加饲料蛋白质[32]、赖氨酸[33]、维生素 C[34]、乳酸杆菌[35]等的含量能够提高建鲤(Cyprinus carpio var.Jian)幼鱼消化道组织中碱性磷酸酶和Na+,K+-ATP酶活性。但是饲料脂肪水平及蛋白质源色素原料对鱼类消化系统碱性磷酸酶和Na+,K+-ATP酶活性影响的研究甚少,有关豹纹鳃棘鲈此方面的研究更是尚未见报道。
本研究结果显示,P50组较P46组极显著提高了胃肠道中碱性磷酸酶活性,L10组较L8组显著提高了胃肠道中碱性磷酸酶和Na+,K+-ATP酶活性。该结果与本试验中蛋白酶及脂肪酶活性变化特征具有一致性,说明饲料高蛋白质水平、高脂肪水平在提高鱼类消化道蛋白酶与脂肪酶活性的同时,也相应提高对蛋白质与脂肪的吸收能力,使其高效进入机体代谢利用环节。此结果与前人研究结果[30-31]相一致,且进一步证明脂肪吸收与碱性磷酸酶活性关系密切[30]。柳阳[25]在大西洋鲑的研究中发现,低蛋白质水平、低脂肪水平可提高胃肠道中碱性磷酸酶活性,与本研究结果存在差异,其原因可能与试验鱼种类、试验处理、养殖条件等因素不同有关。另外,本研究仅通过测定胃肠道中碱性磷酸酶及Na+,K+-ATP酶的活性来体现试验鱼的吸收功能,对其他营养吸收通道及指标的影响特征仍有待进一步研究。
4 结论
① P46、L10与APP的组合显著提高豹纹鳃棘鲈的增重率,并降低饲料系数;而P50、L8与APP的组合显著提高豹纹鳃棘鲈皮肤中胡萝卜素的含量。
② P50、L10与APP的组合有助于改善豹纹鳃棘鲈胃肠道对营养物质的消化和吸收。
③皮肤中胡萝卜素与黑色素含量在不同处理下均出现增减同步的现象,对调控和优化豹纹鳃棘鲈等鱼类的体色具有重要价值。
④主要营养素源的变化和互作影响着豹纹鳃棘鲈的生长、体色及消化吸收,初步确定P50、L8与APP的组合是兼顾豹纹鳃棘鲈生长、体色和消化吸收的优良组合。实践中可依照豹纹鳃棘鲈不同生长和生理阶段的生产和市场体色需求特点,调控配制适宜营养素源的饲料组合。
[1] 王锐,齐遵利,张秀文,等.东星斑苗种繁育技术[J].科学养鱼,2011(4):39-40.
[2] 张欣,孙向军,梁拥军,等.北方地区东星斑工厂化养殖技术[J].科学养鱼,2011(7):35.
[3] LIGHT P R,JONES G P.Habitat preference in newly settled coral trout(Plectropomus leopardus Serranidae)[J].Coral Reefs,1997,16(2):117-126.
[4] FRISCH A J,ANDERSON T A.The response of coral trout(Plectropomus leopardus)to capture,handling and transport and shallow water stress[J].Fish Physiology and Biochemistry,2000,23(1):23-34.
[5] DONG C L,BRUCE D M,GARRY R R,et al.Using otolith weight-age relationships to predict age based metrics of coral reef fish populations across different temporal scales[J].Fisheries Research,2007,83(2/3):216-227.
[6] ADAMS S.Morphological ontogeny of the gonad of three plectropomid species through sex differentiation and transition[J].Journal of Fish Biology,2003,63(1):22-36.
[7] FRISCH A J,MCCORMICK M I,PANKHURST N W.Reproductive periodicity and steroid hormone profiles in the sex-changing coral reef fish,Plectropomus leopardus[J].Coral Reefs,2007,26(1):189-197.
[8] MATTHEW T C,PHILIPA H.A molecular phylogeny of the groupers of the subfamily Epinephelinae(Serranidae)with a revised classification of the Epinephelini[J].Ichthyol Research,2007,54(1):1-17.
[9] ZHU Z Y,YUE G H.The complete mitochondrial genome of red grouper Plectropomus leopardus and its applications in identification of grouper species[J].Aquaculture,2008,276(1/2/3/4):44-49.
[10] LEIS JM,CARSON-EWART B M.In situ swimming and settlement behaviour of larvae of an Indo-Pacific coral reef fish,the coral trout Plectropomus leopardus(Pisces:Serranidae)[J].Marine Biology,1999,134(1):51-64.
[11] 王永波,陈国华,林彬,等.豹纹鳃棘鲈胚胎发育的初步观察[J].海洋科学,2009,33(3):21-26.
[12] LIN Y H,SHIAU S Y.Dietary lipid requirement of grouper,Epinephelus malabaricus,and effects on immune responses[J].Aquaculture,2003,225(1/2/3/4):243-250.
[13] 陈学豪,林利民,洪惠馨.赤点石斑鱼人工配合饵料中蛋白质最适含量的研究[J].台湾海峡,1995,14(4):407-412.
[14] 陈晓明,徐学明,金征宇.富含虾青素的法夫酵母对金鱼体色的影响[J].中国水产科学,2004,11(1):70-73.
[15] 何培民,张饮江,何文辉.螺旋藻对锦鲤生长和体色的影响[J].水产学报,1999,23(2):162-168.
[16] CHEN H Y,TSAI J C.Optimal dietary protein level for the growth of juvenile grouper,Epinephelus malabaricus,fed semipurified diets[J].Aquaculture,1994,119(2/3):265-271.
[17] SHIAU S Y,LAN C W.Optimum dietary protein level and protein to energy ratio for growth of grouper(Epinephelus malabaricus)[J].Aquaculture,1996,145(1/2/3/4):259-266.
[18] LUO Z,LIU Y J,MAI K S,et al.Effect of dietary lipid level on growth performance,feed utilization and body composition of grouper Epinephelus coioides juveniles fed isonitrogenous diets in floating netcages[J].Aquaculture International,2005,13(3):257 -269.
[19] AZEVEDO P A,LEESON S,CHO C Y,et al.Growth,nitrogen and energy utilization of juveniles from four salmonid species:diet,species and size effects[J].Aquaculture,2004,234(1/2/3/4):393-414.
[20] BENDIKSEN E Å,BERG O K,JOBLING M,et al.Digestibility,growth and nutrient utilisation of Atlantic salmon parr(Salmo salar L.)in relation to temperature,feed fat content and oil source[J].Aquaculture,2003,224(1/2/3/4):283-299.
[21] 向枭,曾学润,李晋华,等.类胡萝卜素对花玛丽鱼体色影响的最适量研究[J].渔业现代化,2000,3(1):16-18.
[22] 宋建婷,周光宏.影响 β-胡萝卜素吸收的因素[J].中国饲料,2002(22):16-17.
[23] WANG C F,XIES Q,ZHU X M,et al.Effects of age and dietary protein level on digestive enzyme activity and gene expression of Pelteobagrus fulvidracolarvae[J].Aquaculture,2006,254(1/2/3/4):554-562.
[24] 高婷婷,李勇,张家国,等.蛋白质营养对工业化养殖大菱鲆生长、消化和免疫的效应[J].海洋科学,2012,36(10):73-80.
[25] 柳阳.脂肪和蛋白质水平对工业化养殖大西洋鲑的效应和机制研究[D].硕士学位论文.青岛:中国科学院,2013:49-60.
[26] 林建斌,李金秋,朱庆国.不同蛋白水平和不同能量蛋白比饲料对点带石斑鱼生长的影响[J].上海水产大学学报,2008,17(1):88-92.
[27] 王美琴,李勇,车向荣,等.蛋白质与饱食度对工厂化养殖半滑舌鳎生长与免疫的影响[J].渔业科学进展,2009,30(4):27-37.
[28] BUCHET V,ZAMBONINO-INFANTE JL,CAHU C.Effect of lipid level in a compound diet on the development of red drum(Sciaenops ocellatus)larvae[J].Aquaculture,2000,184(3/4):339-347.
[29] ZHOU Q C,ZHOU J B,CHI S Y,et al.Effect of dietary lipid level on growth performance,feed utilization and digestive enzyme of juvenile ivory shell,Babylonia areolate[J].Aquaculture,2007,272(1/2/3/4):535-540.
[30] VILLANUEVA J,VANACORE R,GOICOECHEA O,et al.Intestinal alkaline phosphatase of the fish Cyprinus carpio:regional distribution and membrane association[J].Journal of Experimental Zoology,1997,279(4):347-355.
[31] KLEIN S,COHN SM,ALPERSD H.Alimentary tract in nutrition[M]//SHILS M E,SHIKE M,ROSS A C,et al.Modern nutrition in health and disease.10th ed.Philadephia:Lippincott Williams & Wilkins,2006:1132-1139.
[32] 刘勇.蛋白质对幼建鲤生长性能、消化功能和蛋白质代谢的影响[D].硕士学位论文.雅安:四川农业大学,2008:40-46.
[33] 鄢华.赖氨酸缺乏对幼建鲤肠道菌群、消化酶活力和免疫功能的影响[D].硕士学位论文.雅安:四川农业大学,2007:26-29.
[34] 刘扬,池磊,冯琳,等.不同来源和剂量维生素C对建鲤生长性能和消化功能影响的比较研究[J].动物营养学报,2011,23(8):1332-1341.
[35] 刘羽,冯琳,陈岗富,等.饲料中添加乳酸杆菌对幼建鲤生长性能和消化吸收功能的影响[J].动物营养学报,2011,23(8):1386-1393.
