饲料中添加α-酮戊二酸对草鱼热休克蛋白70和过氧化物酶体增殖物激活受体γmRNA表达的影响
2014-03-28赵玉蓉王红权金柏涛唐德约
梁 健 赵玉蓉 王红权 金柏涛 唐德约 伍 琴
近年来,由于水环境的恶化和病害的频发,严重影响草鱼的健康养殖,因此寻找绿色环保的免疫增强剂已成为当前水产动物营养的研究热点。谷氨酰胺(glutaminate,Gln)是近年来研究较多的营养素,它是动物体内含量最多的氨基酸,是肠黏膜细胞、淋巴细胞等快速生长的主要能源,已作为免疫增强剂在鲤鱼的试验中取得了很好的效果[1]。但是Gln不耐热,对酸敏感,在水中溶解度低,且在溶液中易环化成有毒性的焦谷氨酸[2]。α-酮戊二酸(α-ketoglutarate,AKG)具有 Gln 碳架,是三羧酸循环的中心物质,它通过谷氨酸脱氢酶或转氨酶作用生成谷氨酸,并能进一步通过谷氨酰胺合成酶迅速形成Gln[3]。AKG既是Gln的前体物,又有无毒稳定的特点,因此它可能成为Gln的最佳替代物。研究表明,AKG能促进机体蛋白质的合成,增强机体免疫力,防止疾病感染,可作为饲料添加剂来减轻畜禽动物生产过程中的代谢应激[4-5]。位莹莹等[6]研究发现,饲料中添加适量的AKG可以在一定程度上提高松浦镜鲤的增重率和蛋白质效率,降低饲料系数,促进鱼体蛋白质和脂肪代谢。
热休克蛋白(heat shock protein,HSP)是细胞受到各种刺激时产生的一类具有重要生理功能和高度保守的多肽类蛋白质分子家族,普遍存在于原核和真核生物细胞中[7]。研究表明,热休克蛋白70(HSP70)具有多项功能,主要包括协助新生蛋白质的折叠,参与细胞内蛋白质的转运,参与免疫复合物的形成和分解,降解冗余蛋白质。在医学上,HSP70具有排斥和治疗传染病,促进免疫反应的作用[8-12]。过氧化物酶体增殖物激活受体γ(peroxi someproliferator activated receptor gama,PPARγ)是一类能被内源性脂肪酸以及外源性过氧化物酶体增殖物作为配体激活的核转录因子,可通过与配体结合、活化,调节脂肪代谢,改善胰岛素抵抗,调节炎症、免疫以及细胞分化等[13-15]。研究表明,Gln能提高人肺巨噬细胞和上皮细胞HSP70和热休克蛋白72(HSP72)mRNA的表达,从而抵抗脓毒的损伤作用[16-17];能通过调节仔猪PPARγmRNA的表达缓解断奶应激产生的炎症[18]。但 AKG 能 否 通 过 调 控 HSP70、PPARγ mRNA的表达来提高草鱼抗应激和免疫能力尚未见报道。本试验拟采用实时荧光定量PCR方法检测饲料中添加不同浓度的AKG后HSP70和PPARγmRNA在草鱼不同组织的表达及其规律,以期为AKG作为鱼类抗应激饲料添加剂和免疫增强剂的开发提供理论参考。
1 材料与方法
1.1 试验饲料
根据《草鱼配合饲料营养标准》(SC/T 1024—1997)配制基础饲料,其组成及营养水平见表1。试验饲料所用AKG购自上海海曲化工有限公司,纯度为 99%,参照虹鳟稚鱼[19]、全雄奥尼罗非鱼[20]中 Gln 的添加标准,按质量分数 0.25%、0.50%、0.75%、1.00%分别等量替换基础饲料中的次粉。所有饲料原料先粉碎至全部通过0.425 mm的筛,微量成分采取逐级扩大法混合均匀后,所有饲料原料经充分混合,然后经SLX-80型颗粒饲料机制成直径为2.5 mm的颗粒料,自然风干后置于-20℃冰柜中保存备用。

表1 基础饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
1.2 试验动物与饲养管理
试验用草鱼购于湖南省水产科学研究所,为同批鱼种。选取平均体重为(35.66±0.39)g的健康草鱼450尾,随机分为5组(每组3个重复,每个重复30尾鱼):对照组饲喂基础饲料,试验组分别饲喂添加 0.25%、0.50%、0.75%、1.00%AGK 的试验饲料。
养殖试验在湖南农业大学水产养殖基地室外养殖池塘进行。试验前,将所有试验鱼集中驯养10 d,使其适应试验环境和试验饲料。试验开始时将鱼称重分组,并调整至各组间初始体重差异不显著(P>0.05)。试验鱼以重复为单位饲养于1 m×1 m×1 m的网箱中,为期60 d。分别于每天08:00和16:00进行投喂,日投喂量为鱼体重的2%~4%,观察并记录试验鱼的摄食及活动状况。试验期间,水温为 28~32 ℃,pH 为 6.7~7.2,溶氧浓度在5.0 mg/L以上。不定期对网箱进行清洗,尽量排除外界因素对试验结果的干扰。
1.3 样品采集和指标测定
饲养试验结束后,停食24 h,以网箱为单位称重,然后每箱随机取接近平均体重的鱼3尾,丁香油麻醉,用灭菌的解剖工具分别取第3鳃弓、肝胰脏、肾脏、脾脏,液氮中速冻,-80℃保存备用。
1.4 基因表达分析
1.4.1 引物设计及合成
参照陈亮等[21]的方法,以 β-肌动蛋白(β-actin)mRNA序列作为内参基因,根据 NCBI中草鱼的HSP70、PPARγ基因序列登录号(分别为GU475146、GU997136),用 Primer 5.0 软件设计引物(表2)。引物均由上海生工生物工程技术服务有限公司合成。

表2 HSP70、PPARγ和β-actin的引物设计Table 2 Primer design for HSP70,PPARγ andβ-actin
1.4.2 总RNA的提取和反转录
用天恩泽动物组织提取试剂盒进行总RNA的提取,所有过程均在无菌操作台上严格按照操作说明书进行。采用核酸蛋白质测定仪分别于260和280 nm处检测提取的总RNA的浓度和纯度。cDNA合成按照ReverAidTMFirst Strand cDNA Synthesis Kit操作说明书进行,反应结束后-20℃保存备用。
1.4.3 实时荧光定量PCR
实时荧光定量PCR采用SYBR GreenⅠ染料法,按照SYBR Premix EX TaqTM(TaKaRa公司)操作说明书在ABI 7300实时荧光定量PCR仪上进行扩增。20μL反应体系为:cDNA 2μL,上、下游引物各 0.8 μL,ddH2O 5.8 μL,SYBR Premix EX TaqTM10 μL,ROX Reference 0.6 μL。反应条件为:95 ℃ 30 s,95 ℃ 5 s,61℃ 31 s,共40个循环。PCR扩增完成后用熔解曲线分析法确定产物特异性。
1.4.4 扩增效率的检测
所有样品的cDNA各取1μL混匀后,进行10倍系列稀释,选取6个稀释度进行实时荧光定量PCR扩增反应,每个稀释度设3个重复,根据6个稀释系列实时荧光定量PCR反应结果,以循环阈(threshold cycle,Ct)值为纵坐标,以稀释倍数值为横坐标,获得相对定量标准曲线。β-actin、HSP70和PPARγ的标准曲线分别为 Y=-3.182 6X+14.944、Y= -3.191 8X+30.881 和 Y= -3.217 5X+15.632,相 关 系 数 分 别 为 0.991 5、0.992 3 和0.994 5,根据公式扩增效率 =10(-1/斜率)-1 计算出三者的扩增效率分别为1.061 5、1.057 3 和 1.045 5,符合实时荧光定量PCR中双Ct法对扩增效率的要求[22]。
1.5 数据统计分析
用公式 2-(△△Ct)[22]计算各基因 mRNA 的相对表达量,试验数据用Excel 2003初步整理后,采用SPSS 13.0统计软件进行单因素方差分析,并用Duncan氏法进行多重比较,试验结果用平均值±标准差表示,以 P<0.05 为差异显著,P<0.01 为差异极显著。
2 结果与分析
2.1 HSP70、PPARγ mRNA 在对照组草鱼不同组织中的表达
统计分析结果(图 1、图 2)表明,HSP70、PPARγmRNA在对照组草鱼的肝胰脏、肾脏、鳃和脾脏中均有表达,且在各组织间的相对表达量存在差异。二者均在肾脏中高度表达,且在肾脏中的相对表达量显著高于脾脏、鳃中(P<0.05)。HSP70 mRNA的相对表达量在肾脏、肝胰脏、脾脏、鳃中依次降低,而PPARγmRNA的相对表达量在肾脏、肝胰脏、鳃、脾脏中依次降低。
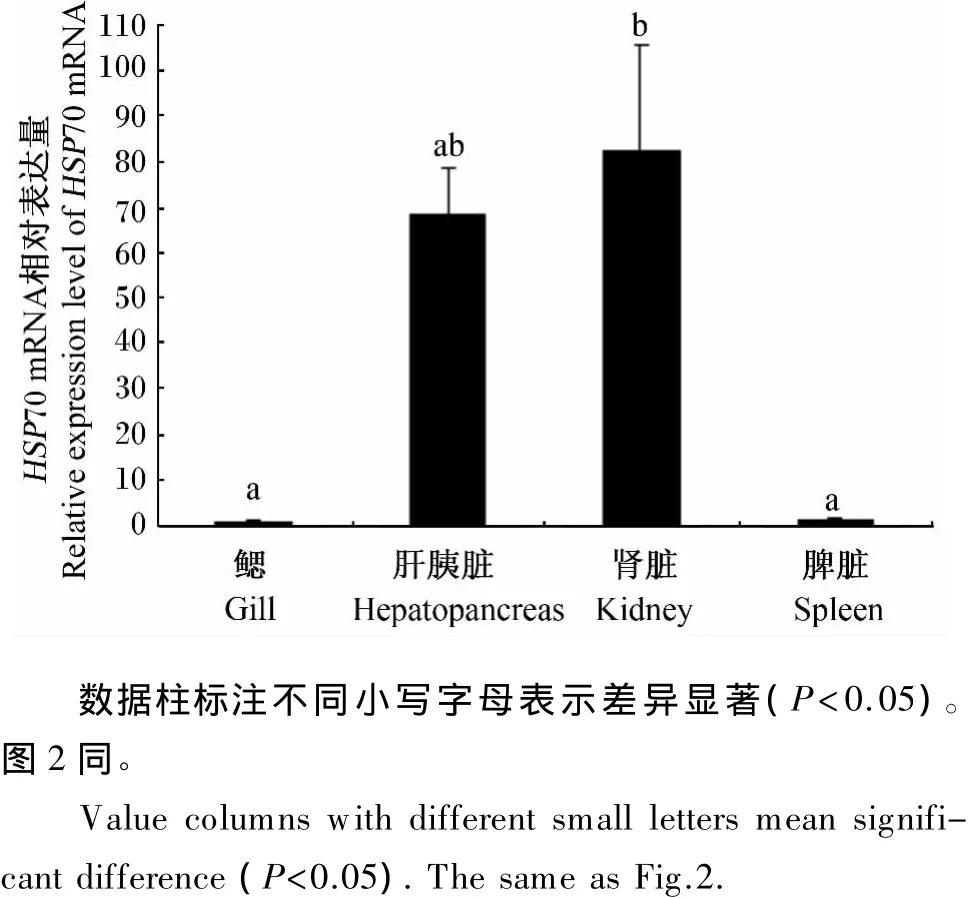
图1 HSP70 mRNA在不同组织中的相对表达量Fig.1 Relative expression level of HSP70 mRNA in different tissues

图2 PPARγmRNA在不同组织中的相对表达量Fig.2 Relative expression level of PPARγmRNA in different tissues
2.2 饲料中添加 AKG对草鱼 HSP70 mRNA相对表达量的影响
统计分析结果(表3)表明,饲料中添加AKG极显著影响HSP70 mRNA在草鱼鳃和脾脏中的表达(P<0.01),显著影响HSP70 mRNA在草鱼肾脏中的表达(P<0.05),而对HSP70 mRNA在草鱼肝胰脏中的表达无显著影响(P>0.05)。与对照组相比,0.25%、0.50%和 0.75%AKG 组鳃中 HSP70 mRNA的相对表达量虽有所增加,但差异不显著(P>0.05),而 1.00%AKG 组鳃中 HSP70 mRNA的相对表达量则极显著增加(P<0.01);饲料中添加AKG显著降低了HSP70 mRNA在肾脏中的相对表达量(P<0.05),但各 AKG添加组间差异不显著(P>0.05);随着饲料中AKG添加量的增加,HSP70 mRNA在脾脏中的相对表达量规律性不明显,但0.75%AKG组脾脏中 HSP70 mRNA的相对表达量最高,并极显著高于其他各组(P<0.01)。
2.3 饲料中添加 AKG对草鱼 PPARγmRNA相对表达量的影响
统计分析结果(表4)表明,饲料中添加AKG极显著影响PPARγmRNA在草鱼肝胰脏中的表达(P<0.01),显著影响 PPARγmRNA 在草鱼鳃、脾脏、肾脏中的表达(P<0.05)。随着饲料中AKG添加量的增加,PPARγmRNA在肝胰脏中的相对表达量规律性不明显,但0.25%AKG组肝脏中PPARγmRNA的相对表达量最高,并极显著高于其他各组(P<0.01);与对照组相比,各AKG添加组鳃中PPARγmRNA的相对表达量均有所增加,但仅1.00%AKG组与对照组达到显著差异(P<0.05);饲料中添加AKG显著降低了PPARγmRNA在肾脏中的相对表达量(P<0.05),但各AKG添加组间差异不显著(P>0.05);随着饲料中AKG添加量的增加,PPARγmRNA在脾脏中的相对表达量规律性不明显,但 0.75%AKG组脾脏中PPARγmRNA的相对表达量最高,并极显著高于其他各组(P<0.01)。
3 讨论
HSP70作为HSP家族中起重要作用的一员,关于其功能方面的研究已经有很多报道,在哺乳动物中都集中于其作为分子伴侣的作用,即帮助蛋白质折叠以及蛋白质转运[23]。HSP70还具有保护细胞免受损伤,增强机体对应激的抵抗力的作用;同时,其在抗细胞凋亡、抗氧化和免疫反应中也起着重要作用[24]。Lee 等[25]研究发现,HSP70的过量表达可以调节和抑制间质金属蛋白酶(应激时产生的一种丝氨酸蛋白酶,能加速细胞死亡和组织损伤)的活性来减少细胞、组织在缺氧应激情况下的损伤。Nakano等[26]研究发现,当潮间带杜父鱼体内HSP70含量较高时,机体具有更强的抗应激能力,能适应较大范围的温差变化。HSP70在细胞内的高表达或数量的增多可以改善细胞的生存能力,提高应激耐受力。石君霞等[27]研究发现,PPARγ对缓解仔猪炎症反应有一定作用,PPARγ可抑制肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)等促炎症细胞因子的形成,通过调控这些细胞因子的释放,从而减轻炎症反应。研究表明,PPARγ信号是重要的免疫调节途径,PPARγ信号影响着吞噬作用、细胞因子的生成及抗原呈递[15,28]。本试验结果表明,草鱼免疫器官肾脏和主要代谢器官肝胰脏中 HSP70、PPARγ mRNA的相对表达量均较高,这与周小飞[29]、陈亮等[21]的研究结果相似,与 HSP70和 PPARγ主要参与免疫反应和代谢调控的功能相符。在脾脏中,饲料中 AKG添加量为 0.75%时,HSP70和PPARγmRNA相对表达量显著或极显著高于对照组。这说明在草鱼饲料中添加适量的AKG能上调HSP70和PPARγmRNA的表达,草鱼的应激耐受力和免疫能力呈现上升的趋势,从而有利于草鱼的生长。本试验的生长性能数据和免疫指标数据也表明在饲料中添加适量AKG后草鱼免疫能力增强,生长性能显著提高[30]。本试验中,各AKG添加组草鱼肾脏中HSP70和PPARγmRNA的相对表达量均显著低于对照组,这是否是由于肾脏可能通过某些特殊的负调控机制参与HSP70和PPARγmRNA的表达调控还有待进一步探讨。

表3 饲料中添加AKG对草鱼HSP70 mRNA相对表达量的影响Table 3 Effects of dietary AKG on HSP70 mRNA relative expression level of grass carp

表4 饲料中添加AKG对草鱼PPARγmRNA相对表达量的影响Table 4 Effects of dietary AKG on PPARγmRNA relative expression level of grass carp
4 结论
① HSP70和PPARγmRNA的相对表达量在草鱼不同组织中存在差异,二者均在肾脏中高度表达,HSP70 mRNA的相对表达量在肾脏、肝胰脏、脾脏、鳃中依次降低,而PPARγmRNA的相对表达量在肾脏、肝胰脏、鳃、脾脏中依次降低。
②饲料中添加AKG显著或极显著影响HSP70 mRNA在鳃、肾脏、脾脏中的表达和PPARγ mRNA在鳃、肝胰脏、肾脏、脾脏中的表达。
③ 建议草鱼(体重在35 g左右)饲料中AKG的添加量为0.75%。
[1] 王桂芹,韩宇田,芦洪梅,等.丙氨酰-谷氨酰胺投喂方式对建鲤生长、抗氧化及免疫力的影响[J].水生生物学报,2012,36(5):837-842.
[2] 王蕾,刘坚,侯永清,等.α-酮戊二酸对LPS慢性应激仔猪小肠黏膜形态与功能的影响[J].畜牧兽医学报,2010,41(1):46-52.
[3] PIERZYNOWSKI S G,SJODIN A.Perspectives of glutamine and its derivatives as feed additives for farm animals[J].Journal of Animal Feed and Science,1998(7):79-91.
[4] 胡泉舟.α-酮戊二酸对断奶仔猪生长性能和肠道功能的影响[D].硕士学位论文.武汉:武汉工业学院,2008:5-7.
[5] LAMBERT B D,STOLL B,NIINIKOSKI H,et al.Net portal absorption of enterally fed alpha-ketoglutarate is limited in young pigs[J].The Journal of Nutrition,2002,132(11):3383-3386.
[6] 位莹莹,徐奇友,李晋南,等.不同蛋白质水平饲料中添加α-酮戊二酸对松浦镜鲤生长性能、体成分和血清生化指标的影响[J].动物营养学报,2013,25(12):2958-2965.
[7] 杨震国.热休克蛋白70的生物学功能及应用的研究进展[J].中国饲料,2010(23):11-14.
[8] PARRATT J R.Possibilities for the pharmacological exploitation of ischaemic preconditioning[J].Journal of Molecular and Cellular Cardiology,1995,27(4):991-1000.
[9] WELCH W J.The role of heat-shock proteins as molecular chaperones[J].Current Opinion in Cell Biology,1991,3(6):1033-1038.
[10] SRIVASTAVA P.Roles of heat-shock proteins in innate and adaptive immunity[J].Nature Reviews Immunology,2002,2(3):185-194.
[11] JACQUIER-SARLIN M R,FULLER K,DINH-XUAN A T,et al.Protective effects of HSP70 in inflammation[J].Experientia,1994,50(11/12):1031-1038.
[12] MEHLEN P,MEHLEN A,GODET J,et al.HSP27 as a switch between differentiation and apoptosis in murine embryonic stem cells[J].Journal of Biological Chemistry,1997,272(50):31657-31665.
[13] VOSPER H,KHOUDOLI G A,GRAHAM T L,et al.Peroxisome proliferator-activated receptor agonists,hyperlipidaemia,and atherosclerosis[J].Pharmacology Therapeutics,2002,95(1):47-62.
[14] BERGER J,MOLLER D E.The mechanisms of action of PPARs[J].Annual Review of Medicine,2002,53:409-435.
[15] GOSSET P,CHARBONNIER A S,DELERIVE P,et al.Peroxisome proliferator-activated receptor gamma activators affect the maturation of human monocyte-derived dendritic cells[J].European Journal of Immunology,2001,31(10):2857-2865.
[16] WANG J,CHEN L,LI P,et al.Gene expression isaltered in piglet small intestine by weaning and dietary glutamine supplementation[J].The Journal of Nutrition,2008,138(6):1025-1032.
[17] SINGLETON K D,SERKOVA N,BANERJEE A,et al.Glutamine attenuates endotoxin-induced lung metabolic dysfunction:potential role of enhanced heat shock protein70[J].Nutrition,2005,21:214-223.
[18] 肖英平,洪奇华,刘秀婷,等.谷氨酰胺对断奶仔猪生长性能、营养物质表观消化率、空肠碱性磷酸酶活性及与肠道健康相关因子基因表达的影响[J].动物营养学报,2012,24(8):1438-1446.
[19] 徐奇友,王常安,许红,等.外原性谷氨酰胺对虹鳟稚鱼生长和肠道形态的影响[J].中国粮油学报,2009,24(4):98-102.
[20] 杨奇慧,周歧存,谭北平,等.谷氨酰胺对杂交罗非鱼生长、饲料利用及抗病力的影响[J].中国水产科学,2008,15(6):1017-1023.
[21] 陈亮,梁旭方,瞿春梅,等.草鱼过氧化物酶体增殖物激活受体(PPAR)基因cDNA序列的克隆及其组成型表达[J].暨南大学学报:自然科学与医学版,2011,32(1):80-87.
[22] 唐永凯,贾永义.荧光定量PCR数据处理方法的探讨[J].生物技术,2008,18(3):89-91.
[23] 张玉秀,柴团耀.HSP70分子伴侣系统研究进展[J].生物化学与生物物理进展,1999,26(6):554-558.
[24] 任宝波,王玉艳,王纯净,等.HSP70家族的分类及基因结构与功能[J].动物医学进展,2005,26(1):98-101.
[25] LEE J E,KIM Y J,KIM J Y,et al.The 70 kDa heat shock protein suppresses matrix metalloproteinases in astrocytes[J].Neuroreport,2004,15(3):499-502.
[26] NAKANO K,IWAMA G.The 70-kDa heat shock protein response in two intertidal sculpins,Oligocottus maculosus and O.snyderi:relationship of HSP70 and thermal tolerance[J].Comparative Biochemistry Physiology Part A:Molecular& Integrative Physiology,2002,133(1):79-94.
[27] 石君霞,刘玉兰,鲁晶,等.脂多糖对断奶仔猪外周血免疫细胞和免疫器官中PPARγmRNA表达水平的影响[J].畜牧兽医学报,2008,39(5):608-613.
[28] BHATIA V,VISWANATHAN P.Insulin resistance and PPAR insulin sensitizers[J].Current Opinion in Investigational Drugs,2006,7(10):891-897.
[29] 周小飞.草鱼热休克蛋白Hsc70和Hsp70在免疫反应中不同基因表达、蛋白质合成和分泌的特征探讨[D].硕士学位论文.成都:电子科技大学,2011:19-20.
[30] 赵玉蓉,王红权,金柏涛,等.α-酮戊二酸的用途:中国,201310308401.9[P].2013-10-09.
