普安银鲫早期发育过程中消化酶活性变化及外源维生素C对其的影响
2014-03-28蒋左玉姚俊杰熊铧龙
蒋左玉 姚俊杰 熊铧龙
维生素C(vitamin C)又名抗坏血酸,是一种具有广泛生理和免疫作用的调节因子,是维持鱼类正常生理功能必不可少的微量营养素,能促进养殖动物快速生长。目前,补充鱼类维生素的方法有2种:一是向鱼类饲料中添加,这种方法应用较为广泛;二是通过维生素浸泡[1]。对于开口摄食以后的鱼类来说,可以通过饲料补充维生素C,而对于鱼类的胚胎和卵黄囊仔鱼发育阶段来说,在未开口摄食前营养物均来自卵黄,浸泡是获取维生素C的有效途径。目前,关于维生素C对鱼类消化酶活性影响的研究主要集中在成鱼,而将维生素C加入孵化水体中研究对胚胎和卵黄囊仔鱼的影响尚未见报道。已有研究表明,饲料中适宜水平的维生素C能促进鱼类发育和提高免疫力,增加鱼的活力与摄食,从而提高肠道消化酶活性,促进消化。在黄颡鱼(Pelteobagrus fulvidraco)饲料中分别添加1 014 mg/kg维生素C磷酸酯钙盐和919 mg/kg包被维生素C时,肠道蛋白酶活性达到最大值;而添加量分别为747和507 mg/kg时,肠道淀粉酶活性达到最大值;维生素C磷酸酯钙盐添加量为300 mg/kg时,肠道脂肪酶活性最高[2]。对建鲤(Cyprinus carpio var.Jian)仔鱼的研究也表明,饲料中维生素C添加量为150 mg/kg可使建鲤肠道的胰蛋白酶、淀粉酶和脂肪酶活性达到最大值[3]。当饲料维生素C含量分别达46.9和45.1 mg/kg时,建鲤仔鱼肠道胰蛋白酶、脂肪酶和淀粉酶活性分别达到最高平台期;而当添加量分别为 44.4、48.9 和 44.8 mg/kg 时,胰脏胰蛋白酶、脂肪酶和淀粉酶活性也达到最高平台期[4]。对于孵化后1~15 d的鲮鱼(Labeo rohita)水花,饲料中维生素C添加量从750 mg/kg增至2 000 mg/kg时,其肠道蛋白酶、脂肪酶和淀粉酶的活性随之升高[5]。
普安银鲫(Carassius auratus)属鲤形目,鲤科,鲤亚科,鲫鱼属,是在贵州省普安县青山镇一带独特高原环境条件下形成的一种天然雌核发育鲫鱼。其与黑龙江方正银鲫(C.auratus gibelio)同属于天然雌核发育的鲫鱼,但它们并非同一来源,而是在贵州省普安县青山镇一带独特高原环境条件下形成的一个鲫鱼类型或种群,成为贵州省宝贵的鱼类种质资源。用营天然雌核发育的普安银鲫为母本,鲤为父本繁殖的子1代具有肉质细嫩、营养丰富、生活力强、生长快、杂食性、群体产量高、育种简便等特点,宜在池塘、稻田、山塘和水库中养殖[6]。为了保护这一珍贵的种群,在本课题组前期对普安银鲫人工繁殖、胚胎发育及仔鱼生长特性等研究[7-9]的基础上,本试验探究了普安银鲫早期发育过程中消化酶的活性变化以及维生素C浸泡对其的影响,旨在进一步认识消化酶在不同发育阶段的消化生理特点,以便更好地了解仔鱼消化生理及其营养需求,为普安银鲫人工育苗的投饵和提高仔鱼的成活率提供理论指导,进而为普安银鲫的资源保护和开发利用提供理论基础。
1 材料与方法
1.1 试验材料
本试验在贵州省普安县普安银鲫原种场进行,挑选性腺成熟度好的普安银鲫雌鱼30尾,全长(27.91±1.53)cm,体重(446.64±59.36)g;用兴国红鲤(Cyprinus carpio)作为父本进行异源授精,其体 长 (35.21±5.74)cm,体 重 (518.14±121.70)g。经过人工催产、干法授精后将受精卵放在水箱(90 cm×50 cm×55 cm)内孵化,水温控制在24℃,每8 h全部换1次同浓度、同温度新水。通过参考文献[1]中的方法进行预试验,预试验中设置水体维生素 C浓度为 20、25、30和35 mg/L,进行胚胎孵化试验,结果表明,在水体维生素C浓度为30 mg/L能显著促进胚胎发育,缩短孵化时间,且出膜后仔鱼生长良好,因此,正式试验采用30 mg/L维生素C溶液进行胚胎孵化试验。本试验分为2组,孵化水体维生素C浓度分别为0(正常组)和30 mg/L(维生素C组),每组3个重复,仔鱼开口后投喂蛋黄。
用显微镜和解剖镜对试验材料进行连续观察,记录发育时间和发育时期。本试验取样标准为50%发育至某个时期为取样点,仔鱼的内源营养期为1日龄,混合营养期为2~3日龄,外源营养期为4~5日龄。在成熟卵、受精卵、原肠中期、晶体出现期、混合营养期(3日龄)及外源营养期(5日龄)6个时期分别取样,将样品用滤纸吸干水分后放入1.5 mL的eppendoff管中,所得样品立即置于-80℃冰箱保存。
1.2 样品制备
取不同时期的胚胎(500~600个为1个重复)或仔鱼样品(500~600条为1个重复),加入10倍体积(m/v)预冷重蒸水,在玻璃匀浆器中冰浴匀浆,9 000~10 000 r/min冷冻离心 30 min,上层为油层,下层为沉淀,小心取中间层,3 000 r/min再次离心后取上清液进行消化酶活性的测定。上清液置于4℃冰箱保存备用,在24 h内分析完毕。
1.3 酶活性测定方法
纤维素酶活性测定方法:试管中加入0.2 mol/L的醋酸缓冲液(pH 4.6)2 mL、0.5%羧甲基纤维素钠5 mL、酶液0.4 mL。加入重蒸水使总体积为10 mL,于40℃水浴中糖化30 min,取出后立即置于沸水中煮沸10 min。所得糖化液按Somogyi-Nelson 方法测定[10]。
胰蛋白酶活性参考文献[11]的方法测定。胃蛋白酶活性参考文献[12]的方法测定。淀粉酶、脂肪酶活性参考文献[13]的方法测定。总蛋白含量参考文献[14]的方法测定。
1.4 数据分析
试验数据用平均值±标准误(n=3)表示,采用SPSS 13.0统计软件进行单因素方差分析,用LSD多重比较分析试验结果的差异显著性,当P<0.05时为差异显著,P>0.05时为差异不显著。
2 结果
2.1 普安银鲫早期发育过程中总蛋白含量变化
普安银鲫早期发育过程中总蛋白含量变化见表1,早期发育过程中,正常组呈下降的趋势,由成熟卵的(0.705±0.041)mg/mL 下降至受精卵的(0.676±0.042)mg/mL,随之下降至晶体出现期的(0.478±0.090)mg/mL,又急剧下降至混合营养期的(0.150±0.009)mg/mL,最终外源营养期时下降至(0.101±0.003)mg/mL。维生素 C 组总蛋白含量在整个早期发育中也呈下降的趋势,由受精卵时期的(0.676±0.042)mg/mL 下降至晶体出现期的(0.556±0.020)mg/mL,又急剧下降至混合营养期的(0.283±0.014)mg/mL,最终下降至外源营养期的(0.189±0.037)mg/mL。
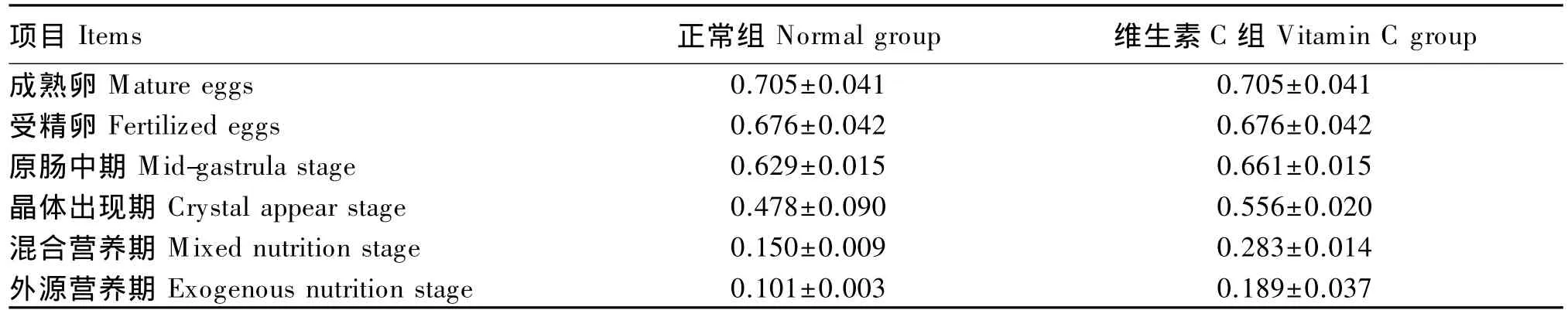
表1 普安银鲫早期发育过程中总蛋白含量变化Table 1 The variation of total protein content of Carassius auratus during early development mg/mL
2.2 普安银鲫成熟卵与受精卵消化酶活性变化
普安银鲫的成熟卵和受精卵中5种消化酶活性变化见表2。成熟卵中胰蛋白酶、胃蛋白酶、脂肪酶和纤维素酶的活性分别为(0.182±0.005)U/mg prot、(0.357 ± 0.002)U/mg prot、(0.104±0.003)U/mg prot和(0.049±0.001)U/mg prot,经人工异源授精后,这4种酶的活性分别 为 (0.188 ± 0.003)U/mg prot、(0.362 ±0.002)U/mg prot、(0.105±0.002)U/mg prot和(0.051±0.002)U/mg prot,授精前后差异不显著(P>0.05);成熟卵中淀粉酶活性为(0.147±0.004)U/mg prot,授精后活性增加,为(0.219±0.005)U/mg prot,差异显著(P<0.05)。

表2 普安银鲫成熟卵与受精卵中消化酶活性变化Table 2 The variation of digestive enzyme activities in mature eggs and fertilized eggs of Carassius auratus U/mg prot
2.3 正常组普安银鲫早期发育过程中消化酶活性的变化
普安银鲫早期发育过程中消化酶活性变化见表3,正常组胰蛋白酶和淀粉酶活性分别由原肠中期的 (0.094± 0.005)U/mg prot和 (0.479±0.022)U/mg prot上升至外源营养期的(0.688±0.013)U/mg prot和 (1.423 ± 0.032)U/mg prot,各时期间差异均显著(P<0.05)。胃蛋白酶、脂肪酶和纤维素酶活性分别从原肠中期的(0.446±0.007)U/mg prot、(0.178±0.004)U/mg prot和(0.051±0.001)U/mg prot稍上升至晶体出现期的(0.448±0.003)U/mg prot、(0.182±0.002)U/mg prot和(0.054±0.001)U/mg prot,表现为差异不显著(P>0.05);但从晶体出现期开始,这3种酶活性都大幅上升,至外源营养期时分别高达(2.410±0.004)U/mg prot、(0.642±0.005)U/mg prot和(0.069±0.001)U/mg prot,晶体出现期、混合营养期和外源营养期间差异均显著(P<0.05)。

表3 普安银鲫早期发育过程中消化酶活性变化Table 3 The variation of digestive enzyme activities of Carassius auratus during early development U/mg prot
2.4 维生素C组普安银鲫早期发育过程中消化酶活性的变化
由表3可见,胰蛋白酶、胃蛋白酶、脂肪酶和淀粉酶活性分别由原肠中期的(0.186±0.005)U/mg prot、(0.647 ± 0.001)U/mg prot、(0.184± 0.002)U/mg prot 和 (0.501 ±0.002)U/mg prot上升至外源营养期的(0.898±0.003)U/mg prot、(3.525 ± 0.004)U/mg prot、(0.718±0.002)U/mg prot和(1.493±0.003)U/mg prot,各时期间均为显著差异(P<0.05)。纤维素酶活性从原肠中期(0.051±0.001)U/mg prot稍上升至晶体出现期的(0.052±0.001)U/mg prot,表现为差异不显著(P>0.05);但从晶体出现期开始,至外源营养期其活性上升到(0.068±0.001)U/mg prot,晶体出现期、混合营养期和外源营养期间差异均显著(P<0.05)。
2.5 维生素 C对普安银鲫早期发育过程中消化酶活性的影响
由表3可见,发育的同一时期,维生素C能显著提高胰蛋白酶活性(P<0.05),尤其在外源营养期,维生素 C 组为(0.898±0.003)U/mg prot,正常组为(0.688±0.013)U/mg prot。发育的同一时期,维生素C能显著提高胃蛋白酶活性(P<0.05),尤其混合营养期时,维生素 C 组为(2.849±0.032)U/mg prot,正 常 组 为 (1.636 ±0.001)U/mg prot。原肠中期,维生素C对脂肪酶活性均无显著影响(P>0.05),但能显著提高晶体出现期、混合营养期与外源营养期脂肪酶活性(P<0.05),至外源营养期时维生素 C 组为(0.718±0.002)U/mg prot,正 常 组 为 (0.642 ±0.005)U/mg prot。在混合营养期和外源营养期,维生素C能够显著提高淀粉酶活性(P<0.05),但在其他2个时期无显著影响(P>0.05)。维生素C能略降低纤维素酶活性,但影响不显著(P>0.05)。
3 讨论
3.1 普安银鲫早期发育过程中总蛋白含量变化规律
在胚胎发育和卵黄囊仔鱼发育过程中,卵黄物质被各种消化酶分解代谢,从而为胚胎发育提供能量,同时为组织、器官的形成提供原料。在普安银鲫胚胎和卵黄囊仔鱼发育过程中,其总蛋白含量总体上呈下降的趋势。经异源授精后发育至原肠中期,总蛋白含量呈缓慢下降趋势,其原因为在此期间胚胎主要进行细胞的分裂和细胞的迁移,需要的能量相对少。而从晶体出现期发育至出膜1 d的仔鱼,是细胞增殖、分化和组织构建等生命活动进行的关键时期[15],同时仔鱼在出膜时脱落的卵膜中也有部分蛋白质,从而导致在此期间总蛋白含量急剧下降。出膜后的卵黄囊仔鱼处于饥饿状态,导致大量的蛋白质被分解用于维持其基本的生命活动,总蛋白含量继续呈下降趋势,至混合营养期时仔鱼开始摄食,由于仔鱼摄食量很少,以致总蛋白含量继续呈下降趋势。维生素C是维持鱼类正常生理功能必不可少的微量营养素,大多数鱼自身均不能合成,只能通过外界摄取。本试验采用30 mg/L维生素C对普安银鲫整个胚胎和卵黄囊仔鱼发育进行浸泡表明,整个发育过程中总蛋白含量也呈下降趋势,但下降幅度比正常组小,说明维生素C进入机体中产生了正面作用。王文辉等[2]研究表明,在黄颡鱼饲料中添加维生素C可以提高血浆总蛋白含量。本试验中,对普安银鲫进行浸泡试验表明,在混合营养期与外源营养期时,30 mg/L维生素C能使普安银鲫仔鱼蛋白质沉积量分别高于正常组5.81%和11.49%,说明维生素C可能在普安银鲫混合营养期能诱导仔鱼摄食量增加,从而促使蛋白质在仔鱼体内沉积,但具体原因还有待进一步研究。
3.2 普安银鲫早期发育过程中消化酶活性变化规律
碳水化合物是一种快速而有效的能源补充物质,普安银鲫成熟卵经异源授精后淀粉酶活性上升了48.98%,而其余4种消化酶活性无显著变化,显示淀粉酶在普安银鲫授精后优先发挥作用分解卵黄中的碳水化合物为胚胎发育迅速提供能量。说明淀粉酶对普安银鲫胚胎发育的起始发挥了主要作用。类似的研究结果在对罗氏沼虾(Macrochium rosenberg)胚胎营养研究中也得到证明[16]。鱼类胚胎、仔鱼发育过程中消化酶的活性变化对于促进鱼体的营养代谢发挥着至关重要的作用。本试验结果表明,普安银鲫的成熟卵细胞已经有消化酶活性的存在,说明此时的酶是由母体带来的,属于母源性酶类,且在成熟卵里就保持了较高的活性,从而为胚胎发育的顺利进行提供了保障。在整个胚胎发育过程中,5种消化酶活性总体上呈上升的趋势,发育至晶体出现期时,胚体的形态会发生很大变化,此时许多器官已分化形成,需要利用较多卵黄蛋白质,所以胰蛋白酶的活性显著升高。对淡水鱼类来说,在胚胎发育过程中,首先是以卵黄中的蛋白质作为代谢的能量来源,其次才是脂质[17]。本试验中脂肪酶活性从晶体出现期开始明显上升,说明此过程中各器官系统正处于快速发育阶段,脂类被大量分解利用;卵黄囊仔鱼发育至混合营养期与外源营养期时,脂肪酶其活性均很高,说明出膜后的仔鱼,其蛋白质己被大量分解利用而逐渐减少,此时脂类成为卵黄囊仔鱼发育阶段代谢的主要能量来源,这也见于其他淡水鱼类的仔鱼发育过程中[17-18];同时出膜后的仔鱼处于饥饿状态,也导致仔鱼大量消耗脂质以维持其基础代谢的需要。目前,已在在鲢(Hypophthalmichthys molitrix)、鳙(Aristichthys nobilis)、草鱼(Ctenopharyngodon idellus)等鱼类发现存在纤维素酶活性[19]。Das等[19]指出内源纤维素酶产生在消化道的前段,消化道后段的纤维素酶由微生物分泌产生。本试验中检测到了纤维素酶活性,尤其从晶体出现期开始,至外源营养期其活性显著上升,在此期间是大量器官不断建立和完善时期,可能引起消化道内纤维素酶的分泌,说明纤维素酶的活动对仔鱼的发育是有利的。
3.3 维生素 C对普安银鲫早期发育过程中消化酶活性的影响
鱼类胚胎发育是生命周期中最脆弱的时期,其质量好坏直接决定着个体存活力,胚胎期生理代谢活动很活跃,在代谢过程中会产生大量的自由基,进而影响胚胎的发育。而维生素C作为一种强抗氧化剂和自由基清除剂,能够保护胚胎免受氧化损伤,特别是保证卵膜结构的完整性,进而提高卵的质量[20]。Terova 等[21-22]认为,在鲈鱼(Dicentrarchus labrax L.)和鲷鱼(Sparus aurata L.)鱼卵中积累较多的维生素C后,会有效促进鲷鱼的早期胚胎发育;当鱼类的受精卵中积累一定的维生素C既可以保护卵子不被氧化损伤,也能调控胚胎发育过程中卵内物质和能量代谢。而本试验采用适宜浓度的维生素C溶液浸泡普安银鲫胚胎和卵黄囊仔鱼,降低了机体的损伤,提高普安银鲫胚胎及卵黄囊仔鱼的免疫力,从而为整个发育过程中正常的代谢提供了保障。有研究表明,采用40 mg/L的维生素C溶液对六须鲶(Silurus glanis)卵黄囊仔鱼进行浸泡表明,维生素C能促进卵黄物质的吸收,促使仔鱼提前8 h开口,并提高其成活率[1],说明维生素C能进入卵黄囊仔鱼体内,通过诱导与卵黄物质代谢相关的一些消化酶活性来加速卵黄物质的分解代谢,以满足自身生长发育的需求。鱼类可通过促进或减缓酶的合成与分泌,形成新的代谢水平,以适应营养条件的改变[2]。如饲料中添加维生素C对黄颡鱼的研究表明,维生素C能提高黄颡鱼的免疫力,增强鱼的活力和采食量,自然也提高了酶的活性,促进了消化[2]。本试验采用30 mg/L维生素C对普安银鲫胚胎发育及卵黄囊仔鱼的发育过程进行浸泡能显著的促进蛋白酶、脂肪酶和淀粉酶活性,说明在发育过程中维生素C能促进消化酶的活性来分解卵黄物质为普安银鲫早期发育提供能量。
4 结论
①普安银鲫成熟卵经异源授精后淀粉酶优先发挥作用,分解卵黄中的碳水化合物为胚胎发育迅速提供能量
②胰蛋白酶、淀粉酶、胃蛋白酶和脂肪酶分解卵黄物质,在器官形成及仔鱼发育中起着主要作用。
③30 mg/L的维生素C能显著提高胰蛋白酶、淀粉酶、胃蛋白酶和脂肪酶活性,并促进蛋白质的沉积。
[1] 季延滨,陈成勋,王祥,等.维生素在提高六须鲶育苗成活率中的应用[J].中国水产,2007,384(11):60-61.
[2] 王文辉,王吉桥,程鑫,等.不同剂型维生素C对黄颡鱼生长和几种免疫指标的影响[J].中国水产科学,2006,13(6):951-958.
[3] 刘扬,池磊,冯琳,等.不同来源和剂量维生素C对建鲤生长性能和消化功能影响的比较研究[J].动物营养学报,2011,23(8):1332-1341.
[4] LIU Y,CHI L,FENG L,et al.Effects of graded levels of dietary vitamin C on the growth,digestive capacity and intestinal microflora of juvenile Jian carp(Cyprinus carpio var.Jian)[J].Aquaculture Research,2011,42(4):534-548.
[5] MITRA G,MUKHOPADHYAY P K,AYYAPPAN S.Modulation of digestive enzyme activities during ontogeny of Labeo rohita larvae fed ascorbic acid enriched zooplankton[J].Comparative Biochemistry Physiology,2008,149A(4):341-350.
[6] 胡世然,安苗,方世贞,等.普安银鲫异精雌核发育子代稻田养殖试验[J].科学养鱼,2012(2):51-53.
[7] 马珊,黄仕洪,姚俊杰,等.普安银鲫胚胎发育过程消化酶活性变化研究[J].广东农业科学,2012,39(3):129-131.
[8] 梁正其,马珊,姚俊杰,等.普安银鲫胚胎发育的初步研究[J].水产科学,2012,31(6):316-320.
[9] 梁正其,姚俊杰,熊铧龙,等.普安银鲫仔稚鱼的发育及生长研究[J].水产科学,2013,32(7):380-384.
[10] 孙双双,张云.盐度对刺参消化酶活力的影响[J].中国饲料,2009(24):28-31.
[11] HUMMEL B C W.A modified spectrophotometric determination of chymotrypsin,trypsin,and thrombin[J].Canadian Journal of Biochemistry Physiology,1959,37:1393-1399.
[12] WORTHINGTON C C,Worthington enzyme manual related biochemical[M].3rd ed.Freehold:Worthington Biochemical Corporation,1991.
[13] FURNÉ M,HIDALGO M C,LÓPEZ A,et al.Digestive enzyme activities in Adriatic sturgeon Acipenser naccarii and rainbow trout Oncorhynchus mykiss.A comparative study[J].Aquaculture,2005,250(1/2):391-398.
[14] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protien-dye binding[J].Analytical Biochemistry,1976,72:248-254.
[15] SELMAN C,MCLAREN J S,HIMANKA M J,et al.Effect of long-term cold exposure on antioxidant enzyme activities in a small mammal[J].Free Radical Biology and Medicine,2000,28(8):1279-1285.
[16] 姚俊杰.罗氏沼虾(Macrochium rosenberg)胚胎营养与形态发生相关性的研究[D].博士学位论文.上海:华东师范大学,2006.
[17] GUNASEKERA R M,DESILVA SS,INGRAM B A.Early ontogeny-related changes of the fatty acid composition in the Percichthyid fishes trout cod,Maccullochella macquariensis and Murray cod,M.peelii peelii[J].Aquatic Living Resources,1999,12(3):219-227.
[18] CEJASA J R,ALMANSAB E,JÉREZ S,et al.Changes in lipid class and fatty acid composition during development in white sea bream(Diplodus sargus)eggs and larvae[J].Comparative Binchemistry and Physiology,Part B:Biochemistry & Molecular Biology,2004,139(2):209-216.
[19] DAS K M,TRIPATHI S D.Studies on the digestive enzymes of grass carp,Ctenopharyngodon idella Val[J].Aquaculture,1991,92(1):21-30.
[20] BROMAGE N,JONES J,RANDALL C,et al.Broodstok management,fecundity,egg quality and timing of egg production in rainbow throut(Oncorynchus mykiss)[J].Aquaculture,1992,100(1/2/3):141-166.
[21] TEROVA G,SAROGLIA M,PAPP Z G,et al.Ascorbate dynamics in embryos and larvae of sea bass and sea bream,originating from broodstocks fed supplements of ascorbic acid[J].Aquaculture International,1998,6(5):357-367.
[22] TEROVA G,SAROGLIA M,PAPP Z G,et al.Dynamics of collagen indicating amino acids,in embryos and larvae sea bass(Dicentrarchus labrax)and gilthead sea bream(Sparus aurata),originated form broodstocks fed with different vitamin C content in the diet[J].Comparative Biochemistry Physiology,1998,121(2):111-118.
