Livin与caspase-3在子宫内膜癌组织中的表达水平及相关性研究
2014-03-27杨留才李仕红徐红涛
孙 炯,杨留才,李仕红,徐红涛
(1.亭湖区人民医院妇产科,江苏 盐城224000; 2.盐城卫生职业技术学院,江苏 盐城 224006)
子宫内膜癌是女性最常见的生殖系统恶性肿瘤之一。研究表明,与增殖、凋亡相关的细胞因子表达异常可导致细胞周期发生紊乱,细胞无限制生长,最终导致恶性肿瘤的发生[1]。生存蛋白(Livin)是凋亡抑制蛋白家族成员,研究表明其在乳腺癌[2]、食管癌等实体肿瘤和肿瘤细胞系中表达水平显著增高[3]。而胱天蛋白酶(caspase)-3是caspase家族的成员之一,其主要的功能为被凋亡通路激活,导致细胞凋亡[4]。本研究通过免疫组织化学染色法检测Livin与caspase-3在子宫内膜癌组织中的表达情况及其相关性,并探讨两者在子宫内膜癌发生、发展中的作用。
1 资料与方法
1.1一般资料 收集2009年6月至2011年6月于亭湖区人民医院妇产科就诊且进行活检或手术治疗的患者268例,年龄36~69(46.3±10.1)其中子宫内膜癌196例作为试验组,取子宫内膜癌患者肌瘤旁正常组织72例作为对照组。试验组患者年龄<45岁者90例、≥45岁者106例;国际妇产科联盟临床分期:Ⅰ期67例、Ⅱ期55例、Ⅲ期42例、Ⅳ期32例;病理诊断:高分化72例、中分化76例、低分化48例;有淋巴结转移82例、无淋巴结转移114例。所有患者在进行手术前未经过放疗和化疗等治疗措施。
1.2方法 石蜡切片脱蜡水化,加羊抗人Livin一抗(1∶100,美国Santa Cruz 公司),羊抗人caspase-3一抗(1∶200,美国Santa Cruz 公司)兔抗羊IgG二抗(1∶100,美国Sigma公司)室温孵育40 min;磷酸盐缓冲液清洗,加Elite-AP(美国Vector公司,)孵育30 min,磷酸盐缓冲液清洗,二氨基联苯胺底物液(中国迈新公司)显色5 min,苏木精复染10 s,脱水,二甲苯透明,中性树胶封片,光镜下观察摄片。
1.3染色结果判断 染色结果显示Livin和caspase-3均定位于胞质中,以胞质内出现棕黄色颗粒为阳性细胞标志。在高倍镜下随机选取10个视野,根据阳性细胞在全部组织细胞中所占比例判定实验结果,阳性细胞数占全部组织细胞数比例<10%判断为(-),阳性细胞数占全部组织细胞数比例为10%~50%判断为(+),阳性细胞数占全部组织细胞数>50%判断为(++),以(+)及(++)作为显色阳性[5]。
1.4统计学方法 应用SPSS 18.0软件进行统计分析,计数资料采用χ2检验,等级资料采用秩和检验,相关性分析采用Spearman检验,P<0.05为差异有统计学意义。
2 结 果
2.1两组Livin和caspase-3表达情况的比较 试验组 Livin表达的阳性率显著高于对照组(77.04% vs 11.11%);试验组caspase-3表达的阳性率显著低于对照组(28.06% vs 73.61%),差异均有统计学意义(P<0.05)(表1)。
对照组:子宫内膜癌患者肌瘤旁正常组织;试验组:子宫内膜癌
2.2子宫内膜癌组织中Livin和caspase-3表达与临床、病理指标的关系 临床分期为Ⅲ~Ⅳ期患者的Livin阳性表达率高于Ⅰ~Ⅱ期,而caspase-3阳性表达率低于Ⅰ~Ⅱ期,差异均有统计学意义(P<0.05);高分化患者Livin阳性表达率低于中、低分化患者,而caspase-3阳性表达率高于中、低分化患者,差异均有统计学意义(P<0.05);有淋巴结转移的患者Livin阳性表达率高于无淋巴结转移患者,而caspase-3阳性表达率低于无淋巴结转移患者,差异均有统计学意义(P<0.05)(表2)。
2.3子宫内膜癌组织中Livin和caspase-3表达的相关性 在子宫内膜癌组织中,Livin检出阳性率高于caspase-3(χ2=57.600,P=0.000)。Spearman等级检验结果显示:Livin和caspase-3表达在子宫内膜癌组织中呈负相关(rs=-0.56,P<0.05)(表3)。

表2 子宫内膜癌组织中Livin和caspase-3表达与临床、病理指标的关系
对照组:子宫内膜癌患者肌瘤旁正常组织 试验组:子宫内膜癌;a与高分化比较,P<0.05
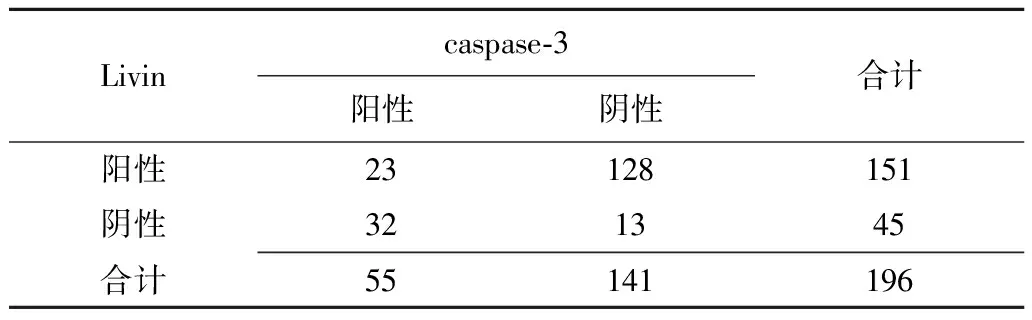
表3 子宫内膜癌组织中Livin和caspase-3表达的相关性 (例)
3 讨 论
现有的研究表明,恶性肿瘤的发生和发展与细胞增殖、凋亡的平衡紊乱存在密切关系。细胞凋亡是由基因控制的自杀程序引起的主动性死亡[6],其中Survivin[7]、p53[8]、Bcl-2[9]和caspases[10]等细胞因子在肿瘤的发生过程中起到了重要作用。
本研究结果显示,Livin在正常组织中阳性表达率低于子宫内膜癌阳性表达率,Livin的蛋白表达水平越高,子宫内膜癌的临床分期越晚,病理分级越低,淋巴结转移的可能性越大,表明Livin在肿瘤组织中的表达水平越高,患者的预后相对越差。Gazzaniga等[11]的研究结果表明,膀胱癌患者中Livin表达阳性的复发时间显著短于Livin阴性表达,说明Livin的表达水平与预后存在密切关系。周莉等[12]的研究结果也发现,Livin不仅在子宫内膜癌中高表达,并且可能与子宫内膜癌的预后相关,这与本研究的结果基本一致。
本研究还发现,caspase-3在子宫内膜癌组织中的阳性率较正常组织低,并且caspase-3在子宫内膜癌组织中表达水平越低,分化越差,临床分期越晚,患者的预后越差。本研究结果与在乳腺癌[13]、卵巢癌[14]等实体肿瘤中的研究结果基本一致。caspase是一组存在于胞质中的半胱氨酸蛋白酶,目前的研究认为caspase-3是整个凋亡过程中最重要的执行者之一,能够水解大量底物蛋白[15]。同时caspase-3也是线粒体和死亡受体两条凋亡信号途径的共同通道,凋亡通路一旦激活则引起caspase-3级联反应并使其活化引起细胞凋亡,体外实验表明,经过地塞米松处理的子宫内膜癌发生凋亡,并且与细胞内caspase-3水平上调有关[16]。而范引侠等[1]的研究结果也发现,子宫内膜癌组织中的caspase-3水平显著下调。上述研究结果与本研究结果基本一致,说明在子宫内膜癌中caspase-3的表达水平显著下调,导致细胞增殖和凋亡间的平衡被打破,细胞凋亡减少,增殖增加。
本研究结果还显示,Livin与caspase-3在子宫内膜癌中的表达呈负相关,说明Livin可能通过影响caspase-3的表达水平来调控细胞的凋亡。目前研究认为其作用机制主要表现为以下两个方面:①Livin能直接下调caspase-3的表达水平,减少凋亡的发生;②Livin通过与caspase-9结合,并且降低caspase-3的表达水平抑制线粒体信号通路发生抑制凋亡[17]。
综上所述,Livin在子宫内膜癌的组织中高表达,caspase-3在子宫内膜癌的组织中低表达,且两者的表达水平均与临床分期、病理分级以及淋巴结转移相关;Livin和caspase-3表达在子宫内膜癌组织中呈负相关,提示Livin可能通过与caspase-3共同作用促进子宫内膜癌的发生、发展。
[1] 范引侠,薛翔,主改侠.凋亡调控因子Survivin和Caspase-3在子宫内膜癌中的表达及意义[J].西安交通大学学报:医学版,2007,28(1):93-96.
[2] Liang CY,Ma P,Liu XL.RNAi-mediated gene silencing of livin synergistic with epirubicin enhance apoptosis of human breast cancer cells[J].Zhonghua Yi Xue Za Zhi,2008,88(24):1703-1706.
[3] Chen L,Ren GS,Li F,etal.Expression of livin and vascular endothelial growth factor in different clinical stages of human esophageal carcinoma[J].World J Gastroenterol,2008,14(37):5749-5754.
[4] Tong J,Xie G,He J,etal.Synergistic antitumor effect of dichloroacetate in combination with 5-fluorouracil in colorectal cancer[J].J Biomed Biotechnol,2011,2011:740564.
[5] Gok M,Rozendaal L,Berkhof J,etal.Cytology history preceding cervical cancer diagnosis:a regional analysis of 286 cases[J].Br J Cancer,2011,104(4):685-692.
[6] O′Neal P,Alamdari N,Smith I,etal.Experimental hyperthyroidism in rats increases the expression of the ubiquitin ligases atrogin-1 and MuRF1 and stimulates multiple proteolytic pathways in skeletal muscle[J].J Cell Biochem,2009,108(4):963-973.
[7] Chan KS,Wong CH,Huang YF,etal.Survivin withdrawal by nuclear export failure as a physiological switch to commit cells to apoptosis[J].Cell Death Dis,2010,1:e57.
[8] Qiu W,Wu B,Wang X,etal.PUMA-mediated intestinal epithelial apoptosis contributes to ulcerative colitis in humans and mice[J].J Clin Invest,2011,121(5):1722-1732.
[9] Onori P,DeMorrow S,Gaudio E,etal.Caffeic acid phenethyl ester decreases cholangiocarcinoma growth by inhibition of NF-kappaB and induction of apoptosis[J].Int J Cancer,2009,125(3):565-576.
[10] Han Y,Gao L,Sun N,etal.Effects of Kang-Jia-Wan,a Chinese medicinal herb officinal,on apoptosis induction in goiter of rats[J].J Ethnopharmacol,2009,122(3):533-540.
[11] Gazzaniga P,Gradilone A,Giuliani L,etal.Expression and prognostic significance of LIVIN,SURVIVIN and other apoptosis-related genes in the progression of superficial bladder cancer[J].Ann Oncol,2003,14(1):85-90.
[12] 周莉,郭兵.Livin在子宫内膜癌中的表达及意义[J].中国妇幼健康研究,2010,21(3):324-326.
[13] Scarlatti F,Maffei R,Beau I,etal.Role of non-canonical Beclin 1-independent autophagy in cell death induced by resveratrol in human breast cancer cells[J].Cell Death Differ,2008,15(8):1318-1329.
[14] Kumar S,Bryant CS,Chamala S,etal.Ritonavir blocks AKT signaling,activates apoptosis and inhibits migration and invasion in ovarian cancer cells[J].Mol Cancer,2009,8:26.
[15] Chougule MB,Patel AR,Jackson T,etal.Antitumor activity of Noscapine in combination with Doxorubicin in triple negative breast cancer[J].PLoS One,2011,6(3):e17733.
[16] 崔琳,朱丹梅.CASPASE-3与子宫内膜癌细胞(HEC-1B)凋亡的研究[J].中国社区医师:医学专业,2011,13(10):274-275.
[17] Yang D,Song X,Zhang J,etal.Suppression of livin gene expression by siRNA leads to growth inhibition and apoptosis induction in human bladder cancer T24 cells[J].Biosci Biotechnol Biochem,2010,74(5):1039-1044.
