肠道病毒71型感染对细胞内钙离子分布的影响
2014-03-26田洪超丛浩龙
田洪超, 丛浩龙, 田 波
(1. 中国科学院 微生物研究所, 北京 100101; 2. 安徽大学 生命科学学院, 合肥 230601)
肠道病毒71型(EV71)属于小RNA病毒科肠道病毒属成员。病毒颗粒为20面体的立体对称结构,无包膜和突起,直径约30 nm。EV71基因组为长约7.4 kb的单股正链RNA,只有一个开放阅读框。EV71能引起手足口病,以及严重的神经系统病变,包括无菌性脑膜炎,脑干炎,脊髓灰质炎样麻痹和神经性咽炎甚至死亡[1-3]。当病毒感染宿主细胞后,会通过一系列的与宿主细胞间的相互作用,来调节宿主细胞内环境,使其更有利于病毒的生存或复制[4]。
钙离子是生物体内最重要的无机离子之一,钙离子能够调节生物体内的多种生理活动,例如,荷尔蒙分泌,细胞增殖与分化,基因表达调控,细胞凋亡等等[6-7]。现已知多种病毒感染会引起细胞内钙离子变化,丙型肝炎病毒(HCV)能够增加内质网压力从而引起内质网钙离子释放,释放出的钙离子在HCV的影响下被线粒体吸收,从而增加线粒体内钙离子的浓度并进一步影响细胞的一系列功能[12]。Chami等人也证明了乙型肝炎病毒(HBV)能影响细胞内钙离子的平衡,并通过这种方式对细胞凋亡产生重要的影响[13]。对柯萨奇病毒的研究中也发现,柯萨奇病毒可以导致细胞内钙离子的重排,而且通过进一步的研究发现钙离子的重排会引起柯萨奇病毒释放的延迟[5]。此外,牛痘病毒,仙台病也能够对细胞内钙离子产生一定的影响[16-17]。本研究发现,EV71感染细胞后同样会引起细胞内钙离子的分布发生变化,这一变化可能为EV71引起细胞凋亡提供重要的线索。
1 材料和方法
1.1 材料
肠道病毒71 (BrCr) 标准株(实验室留存);人神经胶质瘤细胞(U251)和HaLa细胞培养于含有双抗(青霉素和链霉素均为1%)及10%胎牛血清的DMEM (life technology)培养基。无钙DMEM,购自美国life technology公司。钙离子荧光探针Fluo-3购自碧云天,细胞内质网内钙离子浓度荧光检测试剂盒购自上海杰美基因医药科技有限公司,X-rhod-1购自美国life technology公司。
1.2 细胞质内钙离子浓度的检测
1.2.1 流式细胞技术检测细胞质内钙离子浓度变化
将HeLa细胞分至六孔板,贴壁12 h, EV71感染细胞8 h,平均每个细胞2 pfu的EV71,Fluo-3标记胞质钙离子(1∶1000处理30 min)。PBS洗3次,2.5%的胰酶消化细胞,500 r/min离心5 min,PBS洗3遍,4%多聚甲醛室温固定30 min,1000 r/min离心5 min,弃上清,PBS洗3次,细胞重悬于500 μL PBS,流式细胞仪检测(BD FACSCalibur流式细胞分析仪)。
1.2.2 激光共聚焦技术观察细胞质内钙离子浓度及分布的变化
将HeLa分至有盖玻片的48孔板中,细胞贴壁12 h,EV71感染细胞8 h,用Fluo-3和ER traker标记内质网。避光的情况下用PBS洗3次,每次10 min。制片,激光共聚焦显微镜观察(Leica SP2双扫描模式激光共聚焦显微镜)。
1.3 内质网钙离子检测
1.3.1 流式细胞技术检测内质网钙离子变化
DMEM培养基培养细胞,铺平板12 h。感染前换无钙DMEM。EV71感染,标记细胞质钙离子,PBS洗3遍,洗去残留的染料。2.5%的胰酶消化,收集细胞并500 r/min离心5 min,PBS洗3遍,收样,4%多聚甲醛室温固定30 min,PBS洗3遍,细胞用500 μL PBS重悬,立即进行流式细胞仪检测(BD FACSCalibur流式细胞分析仪)。
U251细胞感染病毒,感染后用细胞内质网内钙离子浓度荧光检测试剂盒处理细胞(具体的操作方法根据细胞内质网内钙离子浓度荧光检测试剂盒的说明书进行操作)。避光条件下PBS冲洗3遍,洗去残留的染料。2.5%的胰酶进行消化,PBS冲洗3遍,4%多聚甲醛室温固定30 min,1000 r/min离心5 min,PBS洗3遍,500 μL PBS重悬细胞,立即通过流式细胞仪进行检测(BD FACSCalibur流式细胞分析仪)。
1.3.2 激光共聚焦检测细胞内质网钙离子的荧光强度
将HeLa分到有盖玻片的48孔板中,细胞贴壁12 h,使EV71感染细胞,在细胞内质网中钙离子浓度荧光检测试剂盒处理细胞,用ER traker染内质网,以此作为指示剂。在4%多聚甲醛中室温固定30 min,避光情况下用PBS洗3遍,每次10 min。制片,激光共聚焦显微镜下观察(Leica SP2双扫描模式激光共聚焦显微镜)。
1.4 检测线粒体钙离子浓度变化
将铺平板12 h的Hela细胞感染病毒,用X-rhod-1处理细胞(具体的操作方法根据试剂说明书进行操作)。PBS冲洗3遍,洗去残留的染料。2.5%的胰酶消化,PBS冲洗3遍,500 μL PBS重悬,立即通过流式细胞技术进行检测(BD FACSAria流式细胞分选/分析仪)。
2 结果
2.1 细胞质内钙离子浓度的测定

图1 EV71感染对细胞胞质钙离子的影响
A是感染前后细胞质钙离子浓度变化的流式检测图,黑线紫色区为对照组;绿线为实验组。B和C是利用confocal技术检测对比感染前后细胞质内钙离子的荧光强度变化。其中绿色代表细胞质内钙离子的荧光强度,红色代表内质网 B是实验组;C是对照组。
流式细胞仪检测结果显示,病毒感染8 h后,感染组Flow-3荧光信号较未感染组明显右移(图1A)。表明病毒感染组细胞胞质钙离子浓度显著升高。为进一步验证上述结果,我们将细胞培养于玻片上,并进行Fluo-3染色。激光共聚焦显微镜技术检测结果显示,细胞感染EV71后,代表胞质钙离子的绿色荧光的强度明显高于未感染组(图1B, 1C)。表明EV71感染后细胞质内钙离子浓度显著升高。
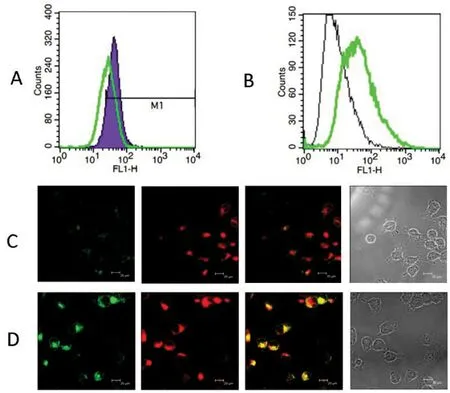
图2 EV71感染对细胞内质网钙离子的影响
A为无钙培养基培养Hela细胞感染与不感染EV71情况下细胞质内钙离子浓度变化图,其中绿线是对照组,黑线紫色区域是实验组。B是通过细胞内质网钙离子浓度检测试剂盒检测U251细胞系感染前后内质网钙离子浓度,其中黑线是实验组,绿线是对照组。C和D是感染和不感染病毒细胞的内质网和内质网钙离子confocal图,其中红色的是内质网,绿色的是内质网钙离子 C是实验组。D是对照组。
2.2 细胞内质网钙离子浓度变化的检测
内质网是细胞内最主要的钙离子贮存细胞器,而小核糖核酸病毒科病毒感染细胞后会导致细胞内膜系统的重排和改变[4]。 因此,我们猜测EV71感染细胞后细胞质内钙离子浓度的变化可能与内质网内钙离子的迅速释放有关。通过利用无钙培养基培养EV71感染Hela细胞,观察胞质钙离子和内质网胞质钙离子变化情况。根据流式细胞仪检测结果显示,感染组Flow-3荧光信号较未感染组明显右移。说明EV71在感染后胞质钙离子的浓度升高 (图2A)。进一步实验结果表明,在感染了EV71的细胞中内质网和内质网钙离子的共定位和未感染的EV71对照组细胞相比明显减少。此外,未感染EV71细胞中内质网的钙离子浓度要远高于EV71感染细胞组(绿色代表内质网钙离子,红色代表内质网),见图2C和D。我们又利用流式细胞技术在U251细胞系检测了细胞在EV71感染后内质网的钙离子变化。结果显示U251细胞在感染了病毒以后细胞内质网钙离子的峰图明显左移,说明EV71感染后细胞内质网的钙离子浓度与未感染对照组相比明显减少(图2B)。
2.3 线粒体钙离子的检测
上述结果表明,EV71感染细胞后引起胞质钙离子升高与内质网中钙离子的释放有关。我们进一步推测胞质中增加的钙离子可能有一部分被细胞线粒体吸收,从而导致细胞凋亡。因此我们又利用X-rhod-1检测了感染病毒后的细胞线粒体内钙离子的浓度变化情况,为进一步研究EV71是否会通过钙离子变化引起细胞凋亡提供一定的基础。结果显示,同未感染的对照细胞相比较,感染EV71的细胞中线粒体内钙离子的浓度明显升高 (图3)。这一结果说明EV71感染细胞中内质网释放的钙离子可能被线粒体所吸收,从而导致线粒体内钙离子浓度的上调。

Fig 3 线粒体钙离子浓度流式检测图
注:右边绿色的峰代表感染以后细胞线粒体钙离子的浓度。
3 讨论
钙离子通路是细胞内重要的通路之一,该通路的变化会引起细胞凋亡,细胞膜的融合,细胞收缩,细胞内酶的激活和细胞周期调控等变化,细胞内钙离子的紊乱能引起机体多种病变例如,细胞的癌变,心血管疾病,骨骼疾病以及其他神经性疾病等等[7]。细胞内钙离子的变化还能够引起柯萨奇B3病毒复制的延迟[5]。线粒体钙离子升高后会破坏原有的线粒体膜电位,导致线粒体通透孔开放,释放线粒体内的某些蛋白,从而引起细胞凋亡[6]。此外,内质网作为细胞内重要的钙库,其钙离子的急剧变化也会引起细胞的凋亡[8-9]。
能够引起细胞内钙离子升高的因素有许多,除了内质网作为细胞内钙库在病理、应激和生理条件的应答下释放钙离子以外,细胞质膜上的钙离子通道也能将细胞外钙离子运输到细胞内,产生一系列的生理生化反应[7,10,14-15]。我们研究发现EV71感染细胞以后,首先引起细胞内质网这一重要钙库内钙离子的释放,导致细胞质内钙离子的升高,由此引起细胞线粒体周围微环境的钙离子浓度升高,导致线粒体吸收细胞质内钙离子,使线粒体内钙离子浓度升高。病毒在感染细胞的过程中,为了有利于自身的复制会产生一些抵抗宿主细胞免疫系统和凋亡系统的途径[11]。现已知内质网钙离子的释放可以保护细胞免受C2-ceramide诱导的细胞凋亡。而EV71的2B蛋白可以抑制宿主细胞的凋亡,因此钙离子在这个过程中是否起作用还需要做进一步的研究和探索[6,8-9]。此外,根据我们的研究还发现,内质网释放钙离子于细胞质后,又被线粒体所吸收,但是线粒体内钙离子的升高会引起细胞凋亡[6,18],EV71引起的线粒体钙离子升高是否与细胞的凋亡有关也需要进一步研究和探讨。
综上所述,本研究发现EV71感染会引起细胞质内钙离子的增加,而这一增加是通过内质网中钙离子释放引起,进而引起线粒体内钙离子浓度的升高。这一发现为后续研究EV71能否通过钙离子引起细胞凋亡,以及病毒粒子的释放提供理论基础。
参考文献:
[1]Cong H L, Du N, Tian H C, et al. Enterovirus 71 VP1 activates calmodulin-dependent protein kinase II and results in the rearrangement of vimentin in human astrocyte[J]. Cells Plos One, 2013, 8(9):1-15.
[2]吴海波,郭潮潭.肠道病毒71型检测方法研究概况[J].国际流行病学杂志.2008, 35(3):188-190.
[3]Chen Y C, Yu C K, Wang Y F, et al. A murine oral enterovirus 71 infection model with central nervous system involvement[J]. Journal of General Virology, 2004, 85: 69-77.
[4]Egger D, Teterina N, Ehrenfeld E, et al. Formation of the poliovirus replication complex requires coupled viral translation, vesicle production, and viral RNA synthesis[J]. Journal of Virology, 2000, 74(14):6570-6580.
[5]van Kuppeveld F J M, Hoenderop J G J, Smeets Rolf L L, et al. Coxsackievirus protein 2B modifies endoplasmic reticulum membrane and plasma membrane permeability and facilitates virus release[J]. The EMBO Journal, 1997, 16(12):3519-3532.
[6]Boehning D, Patterson R L, Sedaghat L L, et al. Cytochromec binds to inositol (1,4,5) trisphosphate receptors, amplifying calcium-dependent apoptosis[J]. Nature Cell Biology, 2003(5):1051-1061.
[7]Poloz Y, O′Day D H. Ca2+signaling regulates ecmB expression, cell differentiation and slug regeneration in dictyostelium[J]. Differentiation, 2012, 84:163-175.
[8]Soboloff J, Berger S A. Sustained ER Ca2+depletion suppresses protein synthesis and induces activation-enhanced cell death in mast cells[J]. The Journal of Cell Biology, 2002, 277(16):13812-13820.
[9]Kuang E, Wan Q, Li X J, et al. ER Ca2+depletion triggers apoptotic signals for endoplasmic reticulum (ER) overload response induced by overexpressed reticulon 3 (RTN3/HAP) [J]. Journal of Cellular Physiology, 2004, 204:549 559.
[10]Clapham D E. Calcium signaling[J]. Cell, 1995, 80:259-268.
[11]van Kuppeveld F J M, de Jong A S, Melchers W J G, et al. Enterovirus protein 2B po(u)res out the calcium: a viral strategy to survive? [J]. Trends in Microbiology, 2005, 13(2):41-44.
[12]Li Y C, Boehning D F, Qian T, et al. Hepatitis C virus core protein increases mitochondrial ROS production by stimulation of Ca2+uniporter activity[J]. The FASEB Journal, 2007, 21(10):2474-2485.
[13]Chami M, Ferrari D, Nicotera P, et al. Caspase-dependent alterations of Ca2+signaling in the induction of apoptosis by hepatitis B virus X protein[J]. The Journal of Biological Chemistry, 2003, 278:31745-31755.
[14]刘恭鑫,杨英珍,顾全保,等. 柯萨奇B3病毒对心肌细胞钙平衡的影响[J]. 中华实验和临床病毒学杂志,2000,14(2):113-116.
[15]Meldolesi J, Pozzan T. The heterogeneity of ER Ca2+stores has a key role in nonmuscle cell signaling and function[J]. The Journal of Cell Biology, 1998, 142:1395-1398.
[16]Sanderson C M, Parkinson J E, Hollinshead M, et al. Overexpression of the vaccinia virus A38L integral membrane protein promotes Ca2+influx into infected cells[J]. Journal of Virology, 1996, 70(2):905-914.
[17]Gomperts B D, Baldwin J M, Micklem K J. Rat mast cells permeabilized with Sendai virus secrete histamine in response to Ca2+buffered in the micromolar range[J]. Biochemical Journal, 1983, 210:737-745.
[18]Rizzuto R, Brini M, Murgia M, et al. Microdomains with high Ca2+close to IP3-sensitive channels that are sensed by neighboring mitochondria[J]. Science, 1993, 262(29):744-746.
