经皮肾镜钬激光碎石术治疗髓质海绵肾肾结石疗效观察
2014-03-26宋超李九智王雪怡文彬罗勇安尼瓦尔玉素甫杨嗣星
宋超 李九智 王雪怡 文彬 罗勇 安尼瓦尔·玉素甫 杨嗣星
1武汉大学人民医院泌尿外科 430060 武汉
2新疆自治区人民医院泌尿外科
髓质海绵肾(medullary songe kidney, MSK)是一种先天性的肾髓质囊性病变。其特征为肾锥体部乳头管及集合管呈梭形或囊状扩张,常伴发尿路感染和尿路结石形成。当伴发的结石突破肾锥体部乳头管及集合管排入肾盏、肾盂、输尿管,往往合并上尿路梗阻,导致或加重慢性肾功能损害。对这类MSK患者应采用手术治疗。体外冲击波碎石(extracorporeal shock wave lithotripsy, ESWL)对其治疗效果不理想,甚至加重肾功能损害;开放手术或经尿道逆行输尿管镜碎石可用于治疗游离结石解除梗阻,但无法同时处理肾乳头钙化和黏膜下结石;经皮肾镜碎石术(percutaneous nephrolithotomy, PCNL)已经成为治疗较大及复杂肾结石的一线治疗手段。有关MSK合并结石采用PCNL 治疗目前国内外未见大宗报道。2005年9月~2013年11月我们共收治MSK病例23例,其中应用经皮肾镜碎石、清石技术分期治疗双侧MSK肾结石19例(36侧) ,取得较好疗效,现报告如下。
1 资料与方法
1.1 临床资料
本组MSK结石患者19例,男10例,女9例,年龄5~79岁,平均37.9 岁。病史3~28年,平均8.7年。双肾结石17例,单侧肾结石2例(左侧),36侧肾脏均多发散在结石,其中2 例儿童为体检筛查发现,其余17例均有不同程度反复腰部症状、血尿、尿路感染症状,反复排出尿石者16例。合并游离结石16例。合并肾积水6例12侧,其中中轻度肾积水7侧,中重度肾积水5侧。合并慢性肾功能不全8例。测量双肾结石其中最大结石长径(1∶1平片上结石最长径线的长度) (21.4 ±5.2)mm。13例( 26侧肾)曾接受过ESWL 治疗。术前尿细菌培养阳性11例,最常见的细菌为大肠埃希菌,共7例。血肌酐57~264 μmol/L,平均101.73 μmol/L,总肾小球滤过率(glomerular filtration rate,GFR) 43.28~123.79 ml/min,平均85.33 ml/min。
1.2 治疗方法
术前影像学检查包括:B超、腹部平片和静脉肾盂造影或CT泌尿系造影(computer tomo gr-aphy urography, CTU)及螺旋CT平扫并结石的三维重建。肾功能评估:采用血清尿素氮及肌酐,双肾ECT(图1)。

A:腹部平片示患者双侧肾乳头钙化明显,多个肾椎体结石呈簇状表现,双侧均有上尿路梗阻,双侧在外院留置双J管;B:肾分泌造影片示患者双侧肾盏内花束样改变,局部肾乳头钙化,左输尿管中段游离结石引起上尿路梗阻;C~E:患者CT平扫,示皮髓质交界部钙化,肾乳头钙化和肾盏内游离结石形成。
手术方法:手术当日经膀胱镜或输尿管镜逆行插管,留置F4~F5输尿管导管并固定于导尿管上。全麻或连续硬脊膜外腔阻滞麻醉。患者俯卧位,腹部肾区部稍垫高,使腰背成一平面或低拱形,使肋间隙增宽。B超定位穿刺选用3.7 MHz凸阵探头,皮肤穿刺点一般选择在第12肋下或第11肋间,腋后线偏后的位置,尽可能通过肾盏穹隆建立通道。小儿一步法建立F16微通道,成人两步法扩张建立F24标准通道,穿刺针进入目标肾盏内后,撤除针芯,将0.025英寸(0.063 cm)金属J型穿刺导丝经穿刺针送入集合系统,妥善放置导丝后退出穿刺针,沿导丝依次F8、F10、F12和F16筋膜扩张器(Urovision,德国)扩张至F16并置入Peel-away鞘,形成一个F16通道。成人此时可用输尿管镜检查通道建立无误后再用套叠式金属扩张器进一步扩张,F15金属扩张器置入Peel-away鞘,继续以F18和F21金属扩张器扩张,最后放置F24金属镜鞘至肾集合系统内。采LithoClast Master超声清石系统(EMS公司,瑞士)粉碎并清除结石,或配合钬激光行内切开便于碎石取石。术中复查B超或X线片,根据情况建立多通道碎石、标准通道联合微通道等,手术结束时,撤除预置的输尿管导管,顺行留置F4.7~F6的双J管作为内引流,通道留置F14的球囊肾造瘘管。术后3~5 d复查KUB平片和B超观察手术效果。 残留结石≥15 mm则需要1周后再次PCNL清除并同时行另一侧肾PCNL。术中用药:术前30 min预防性静脉使用抗生素,术中使用立止血1~2 IU减少术中出血,若穿刺引流尿液混浊者则应用地塞米松10 mg、速尿10 mg预防因毒素吸收引起的中毒症状。
1.3 观察指标
手术时间仅包括通道建立时间和碎石、取石时间。采用术后血红蛋白含量与术前血红蛋白含量之差来估计出血量。超过48 h的持续性或反复高热( ≥38.5 ℃)的患者被定义为手术相关性感染。患者分别于术后1、6、12、20个月返回医院评估临床症状改善情况、肾功能改善情况(利尿肾图及血肌酐)及有无结石再次排出。
1.4 统计学方法
2 结果
19例患者中,慢性肾功能不全8例,均为成人。本组患者结石最大长径(21.4±5.2)mm。17例均分期对双侧肾经皮肾镜碎石,单通道9侧肾,双通道22侧肾,三通道3侧肾,2例单侧海绵肾肾结石患者采用双通道碎石; 经上盏建立通道20个,经中盏36个,经下组肾盏10个。手术时间(68.4±15.1)min,所有病例双侧肾均不同程度残留结石,但术后IVU及CT均证实肾内结石负荷明显减少,游离结石得以清除,尿路梗阻解除。术后血红蛋白含量较术前下降(12.3±5.7)g/L。围手术期无输血,与手术相关的感染发生率为10.5%(2/19),无失肾,无气胸或腹腔脏器损伤。结石成分分析表明,以一水草酸钙结石(8例)、碳酸钙结石(5例)及其混合成分(3例)为主,3例磷酸镁铵结石。19例随访6~20个月,平均11.2个月,术后1个月8例合并肾功能不全者肾功能均不同程度改善,12个月后肾功能不全无进一步进展,其中术后1个月、12个月与术前比较及术后12个月与术后1个月比较,均差异有统计学意义(P<0.05),详见表1。肾功能恢复正常(以血肌酐为标准);7例有经尿道残余结石再次排出史,所有病例腰部症状、血尿及尿路刺激症状明显缓解,其中21.1%(4/19)病例出现上述症状,但较治疗前发生次数明显较少。
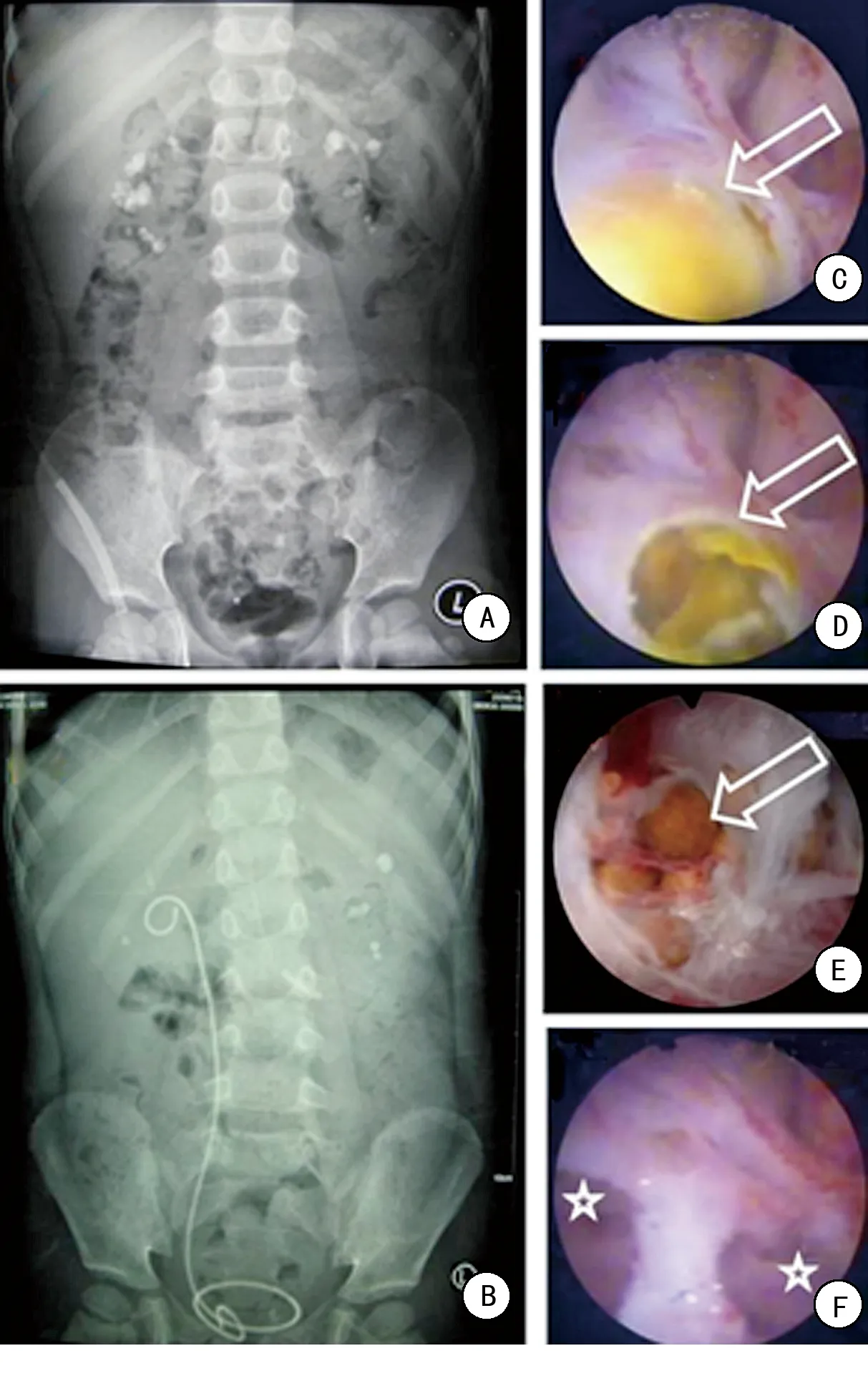
A、B:患者手术前后腹部平片;C:肾镜可见肾盏黏膜下结石形成;D、E:切开肾盏黏膜见其内扩张的肾小管包裹的肾结石;F:切开肾盏黏膜,对扩张的肾小管进行内引流。
3 讨论
MSK也被称为Cacchi-Ricci病,首先由Lenarduzzi于1939描述,并在1948年由Cacchi及Ricci对其影像学和临床表现进行了总结[1]。MSK的病理组织学改变为肾锥体部多孔性使患肾呈海绵样,病变仅局限于髓质锥体部,由于肾乳头先天性发育异常,其进入肾小盏部位类似括约肌的结构肥厚、收缩,导致乳头管和集合管梗阻而出现囊状扩张、迂曲,产生囊性空腔,继发感染、形成结石, 这种改变轻微者仅在可显微镜下可见,病率在1∶5 000至 1∶20 000[3]。由于许多MSK患者终身无症状,真正的发病率并不明确。一般认为,MSK是一种散发性疾病,而非遗传性疾病,但也有偶发的常染色体遗传家族病例的报道[4]。男女比例为1∶2~1∶2.5[5]。

表1 8例术前肾功能不全患者术前、术后1个月及12个月肌酐及总GFR比较
MSK可终身无症状,许多病例是进行静脉肾盂造影过程发现的,也有很多患者是由于排石及伴发感染、引起血尿,疼痛等症状时就诊。大多数早期无临床症状,肾功能正常,血生化及尿检查均正常,进展到晚期出现以下症状:50%~65%合并肾结石:血尿为最常见的症状,约占85%,且反复发作;肾绞痛约占50%~60%,常多次发作;反复发作的尿路感染,占30%~50%,往往波及整个尿路,可蔓延到囊腔周围肾脏组织而影响肾功能,还伴有远端肾小管酸中毒、低钾血症[4]。
MSK的诊断有赖于影像学表现。其典型的肾分泌性造影表现为:在不压迫集合系统或不存在输尿管梗阻的前提下,早期充盈扩张的肾集合管,在锥体内表现为粗条纹影向外放射,或肾锥体、肾小盏周围可见被造影剂充盈的梭形小囊,呈蒲扇状、葡萄串样或花束状改变,肾小盏增宽,杯口扩大。腹部平片特点为双肾实质内可见多发结石或肾实质钙化,肾影正常,但乳头区钙化病变常显示不清[1],如图1及图2A所示。MSK的B超表现多由于结石或肾钙化形成的,为围绕肾髓质呈放射状分布的大小不等无回声区和强回声光点或光团,呈扇形或花瓣样分布,后方伴有声影,部分病例尚有髓质内的囊性改变[6]。CT平扫显示肾锥体内多发小斑点状高密度影,散在或成簇状,呈花瓣样或扇形排列。增强扫描后扩张肾集合管内可见造影剂充盈,肾锥体内可见条纹状或小囊状造影剂聚集,伴有结石时可同时清晰显示[7]。一般认为CT对MSK的诊断特异性不及IVU,但对肾乳头钙化的诊断则较腹部平片更为敏感。MRI显示肾锥体区呈花瓣样分布大小不等的长T1长T2囊状异常信号影,边界清楚,其内或见多发小斑点状长T1短T2异常信号影[8]。本组患者均通过IVU及CT进行术前诊断,术中结合影像学改变确诊,均与上述影像学特征相吻合。
MSK的治疗通常为保守治疗。其措施包括多饮水,采用低钙、低草酸饮食,高钙尿患者应适当长期应用降低尿钙的药物,如噻嗪类利尿剂,并与枸橼酸钾联合应用,以防止或延缓结石形成。当肾乳头钙化、结石形成,引发排石过程,产生肾绞痛、尿路梗阻及肾功能损害则需要进行外科治疗。MSK病程中结石形成的主要诱因是扩张的肾小管中的引流不畅。结石形成后,往往被包裹在扩张的小管中,这一解剖和病理生理特点决定了其不能与普通肾结石那样采用ESWL治疗。误把MSK中肾小管的小结石当作一般的肾结石而进行ESWL治疗,当然达不到预期的治疗效果,尤其单纯依靠X线或超声定位而进行ESWL治疗时,则更容易造成样的错误治疗[9,10]。
肾小管或囊肿中的结石穿透囊壁或经扩大的乳头管进入肾盂,则成为游离结石,这些结石是造成MSK症状的主要原因之一,也是造成感染、梗阻和肾功能损害的主因,这些结石如不能顺利排出集合系统则需要手术干预。PCNL是治疗大体积上尿路结石的首选措施[11]。针对MSK的病理特点,我们选择PCNL作为特定阶段MSK的治疗措施。主要是考虑到PCNL不仅可以治疗已经排入集合系统的游离结石,还可以对肾乳头及肾盏内的结石或钙化灶进行清理,实现最大程度的清石。主动清除乳头管及集合管呈梭形或囊状扩张内的结石,通过激光内切开或使用超声探杆钝性扩张开肾乳头部黏膜,清除扩张的集合管内结石,形成内引流(如图2 C~F所示),可防止感染复发,改善肾功能,同时防止结石进一步形成。这些措施一方面解除了上尿路梗阻,另一方面防止了结石和感染的进展,改善了患者的症状和生活质量,还可有效延缓肾功能恶化。本组8例患者术前存在不同程度的慢性肾功能不全,PCNL治疗后随访最长20个月,肾功能无明显下降,部分患者肾功能恢复正常,也反映了PCNL的治疗效果。
必须强调的是并不是所有病例均适于PCNL治疗。Forster等[12]按肾盏及分侧肾受累计的情况将MSK分为4级。但这一分级并不能反映患者的症状、游离结石大小和集合系统梗阻情况,不能为治疗方式的选择提供依据。因此,我们采用了一种新的分级系统,为手术治疗MSK提供指征。这一系统包括了影像学、症状、结石及梗阻信息,已经作为本组病例进行手术的主要依据。本系统分为5级,1级: 病变在单侧肾脏,单个肾乳头受累;2级:病变在双侧肾脏,每侧有单个或多个肾乳头受累,但患者明显无症状或症状轻微;3级:病变在双侧肾脏,每侧有单个或多个肾乳头受累,伴随有反复发作的肾绞痛;4级:病变在双侧肾脏,每侧有单个或多个肾乳头受累,伴有≥1 cm游离结石,但无明显上尿路梗阻或肾积水,无严重症状;5级:分为5a和5b。5a即病变在双侧肾脏,每侧有单个或多个肾乳头受累,伴有≥1 cm游离结石,伴有明显上尿路梗阻或肾积水;5b即病变在双侧肾脏,每侧有单个或多个肾乳头受累,伴有≥1 cm游离结石,并伴反复发作的上尿路感染或肾绞痛。我们将第5级作为本组PCNL的适应证。第4级作为相对适应证。 MSK病例就诊时已属尿毒症期的患者,其肾实质损害严重,无明显游离结石,这些病例不适于PCNL治疗。本组中19例8例肾功能不全病例PCNL术后肾功能维持或恢复的情况,也进一步说明对于有适应证病例早期治疗的必要性,特别是年龄较小的病例,反复排石导致尿路梗阻和肾功能损害的概率更高,应尽早手术治疗。
本组病例采用超声定位穿刺,有利于MSK多发的结石且肾脏血管分布变化的情况,最大程度上避免了意外的损伤[13]。为实现MSK病肾的最大清石率,应根据结石分布和集合系统的具体情况确定穿刺通道位置和多少。本组19例中单通道9侧肾,双通道22侧肾,三通道3侧肾,2例单侧海绵肾肾结石患者采用双通道碎石;经上盏建立通道20个,经中盏36个,经下组肾盏10个,多通道居多。因为髓质海绵肾肾结石多为散发各盏,肾内结构异常,多数结石位于肾盏黏膜下,主通道常无法清除平行肾盏中的结石或肾乳头钙化灶,因此常经下盏建立第2通道,可有效清除主通道无法探及的下盏的结石。对于小儿患者主、辅通道均采用F16通道,主要考虑到小儿集合系统管径较小,盏颈血管环较小,使用标准通道易发生损伤。本组成人病例则通过标准通道与微通道结合达到最大效率清石,同时使用微通道减少了出血等并发症的发生。另外,由于MSK肾脏组织较为脆弱,碎石器将结石压迫在肾盏或肾盂壁上时要掌握分寸,力量过大时结石会穿透黏膜甚至肾实质造成贯通伤。通过穿刺盏探查其他各盏或输尿管上段时,若角度太大则应尽早另建通道,避免造成盏颈撕裂,引发较重的出血,同时可考虑将硬镜与软镜结合,通过单通道实现最大程度清石。本组较高的结石清除率和较低的手术并发症,也进一步证实了PCNL治疗MSK肾结石的优势。
当然,本研究属于回顾性研究,缺乏长时间随访资料。我们正在进行对于4级MSK患者PCNL与保守治疗的长时间对比研究,以期获得不同阶段病例PCNL治疗的疗效。
总之,经皮肾镜碎石、清石技术治疗MSK肾结石安全,可有效改善患者症状,防止或延缓肾功能减退,可以作为5级MSK肾结石或伴上尿路梗阻海绵肾治疗的首选。
[参考文献]
[1] Friedhelm HJ, Paul Jungers. Nephronophthisis-Medullary Cystic and Medullary Sponge Kidney Disease. In: Schrier, Robert W. Diseases of the Kidney & Urinary Tract.1.8th ed, Lippincott Williams & Wilkins, 2007: 478-501.
[2] Nakada SY, Erturk E, Monaghan J, et al. Role of extracorporeal shock-wave lithotripsy in treatment of urolithiasis in patients with medullary sponge kidney. Urology,1993,41(4):331-333.
[3] Badger CC, Krohn KA, Shulman H, et al. Experimental radioimmunotherapy of murine lymphoma with 131I-labeled anti-T-cell antibodies. Cancer Res, 1986, 46(12 Pt 1):6223-6228.
[4] Kuiper JJ. Medullary sponge kidney. Perspect Nephrol Hypertens, 1976, 4(1):151-171.
[5] Parks, JH, Coe FL, Strauss AL, Calcium nephrolithiasis and medullary sponge kidney in women. N Engl J Med, 1982, 306(18):1088-1091.
[6] Hernanz-Schulman M, Hyperechoic renal medullary pyramids in infants and children. Radiology, 1991, 181(1):9-11.
[7] Ginalski JM, Schnyder P, Portmann L, et al. Medullary sponge kidney on axial computed tomography: comparison with excretory urography. Eur J Radiol, 1991, 12(2):104-107.
[8] Thomsen HS, Levine E, Meilstrup JW, et al. Renal cystic diseases. Eur Radiol, 1997, 7(8):1267-1275.
[9] Deliveliotis C, Sofras F, Karagiotis E, et al. Management of lithiasis in medullary sponge kidneys. Urol Int, 1996, 57(3):185-187.
[10] Vandeursen H, Baert L. Prophylactic role of extracorporeal shock wave lithotripsy in the management of nephrocalcinosis. Br J Urol, 1993, 71(4):392-395.
[11] Türk C, TK. Petrik A. EAU Guidelines on Urolithiasis. European Association of Urology,2011: 68.
[12] Forster JA,Taylor J, Browning AJ, et al. A review of the natural progression of medullary sponge kidney and a novel grading system based on intravenous urography findings. Urol Int, 2007, 78(3):264-269.
[13] Tzeng BC, Wang CJ, Huang SW, et al. Doppler ultrasound-guided percutaneous nephrolithotomy: a prospective randomized study. Urology, 2011, 78(3):535-539.
