陕北地区马铃薯X病毒CP基因的RT-PCR检测及其序列分析
2014-03-26冯光惠杜虎平李夏隆亢福仁
冯光惠,杜虎平,李夏隆,亢福仁
(榆林学院 生命科学学院,陕西 榆林 719000)
马铃薯病毒家族成员包括X病毒(PVX)、Y病毒(PVY)、A病毒(PVA)、S病毒(PVS)、卷叶病毒(PLRV)等,其中PVX是马铃薯病毒家族成员的典型类型。携带X病毒的马铃薯植株通常不表现出症状,但感染X病毒可导致植株叶片失绿、变小和块茎坏死病变等。PVX与PVY和PVA复合感染可导致更严重的症状,由此造成的马铃薯产量损失超过任何单独病毒侵染。X病毒主要靠汁液接触传播,也可以通过昆虫咀嚼式口器机械传播,除马铃薯外,烟草、辣椒、番茄也会成为X病毒的寄主[1]。
由于马铃薯是无性繁殖作物,随着脱毒种薯种植代(年)数的增加,病毒在植株体内不断积累以及在植物间互相传播,导致马铃薯产量和品质逐渐下降,而且还会使马铃薯感染其他种类的病毒和类病毒。因此,及时、准确地检测田间种植马铃薯的带毒情况,采用茎尖剥离脱毒法、超低温疗法[2-3]等脱毒技术控制病毒的蔓延,可为脱毒马铃薯的推广种植奠定基础。
检测马铃薯病毒最常用的方法有双抗体夹心酶联免疫吸附法(DAS-ELISA)、反转录PCR法(RT-PCR)和实时荧光定量PCR法。DAS-ELISA法操作简单、直观、实用性强,准确度较高,但检测病毒含量较低的马铃薯时,灵敏度和准确度不高,会出现假阴性现象。而RT-PCR检测技术即使在马铃薯病毒含量极低时也可以快速检测出来,该方法具有灵敏、快速、准确度高、特异性强等优点,适用于马铃薯及其他植物病毒的检测[4-6]。在RT-PCR检测技术基础上,研究人员应用多重RT-PCR对马铃薯多种病毒同时进行检测,如Nie等[7]检测了马铃薯PVX、PVY、PVA、PVS、PLRV 5种病毒和1种纺锤类病毒(PSTVd);王中康等[8]、董代幸等[9]分别同时检测了马铃薯PVX、PVS、PVY、PLRV以及PVX、PVA、PVY、PLRV 4种病毒。随着实时荧光定量PCR技术的进一步发展,Bright等[10]利用该方法检测了马铃薯PVX、PVY、PVA和PLRV 4种病毒;Sheila 等[11]采用该方法同时检测了PVX、PVS、番茄斑萎病毒(TSWV)和PLRV 4种病毒。多重RT-PCR法和实时荧光定量PCR法极大地提高了马铃薯病毒的检测效率,并逐渐应用到其他植物、动物病毒以及微生物的检测上,但多重RT-PCR法和荧光定量PCR法易出现假阴性现象,Gambino等[12]、牛建新等[13]在利用多重RT-PCR检测葡萄病毒时也有类似报道。国内研究者采用RT-PCR方法检测了不同地区的马铃薯X病毒[14-16],但尚未见用RT-PCR法检测和分析陕北地区马铃薯PVX的报道。因此,本试验以陕北8个县(区)种植2~3代的疑似携带病毒马铃薯为研究对象,采用RT-PCR方法检测该地区的马铃薯PVX,并对PVX的外壳蛋白(Coat protein,CP)基因序列进行分析,明确病毒的变异程度,以期为脱毒马铃薯的推广种植提供依据。
1 材料与方法
1.1 材 料
1.1.1 样品的采集 于2013-07-10在马铃薯生长盛期至成熟期,采集疑似携带病毒马铃薯植株的叶片,于常温下保存于保湿组织培养瓶中,运回实验室后于4 ℃冰箱保存。马铃薯样品信息见表1。
1.1.2 仪器与试剂 主要仪器有PCR仪(朗基,杭州)及电泳仪、凝胶成像系统(Bio-rad,意大利)。Trizol试剂及cDNA合成试剂盒、DNA胶回收试剂盒、pGEM-Teasy载体、TaqDNA聚合酶、dNTP、10×buffer均购自北京全式金生物科技有限公司。
1.1.3 引物设计 根据GenBank数据库中登录的PVX CP基因序列,利用引物设计软件Primer 5设计1对特异引物,上游引物为5′-ACAGGCC-ACAGGGTCAACTAC-3′,下游引物为5′-CATCT-AGGCTGGCAAAGTCGT-3′。预期扩增片段长度为620 bp,引物由南京金斯瑞生物科技有限公司合成,将其用灭菌TE (pH 8.0)稀释至浓度为10 μmol/L。
1.2 方 法
1.2.1 马铃薯X病毒的RT-PCR检测 1)总RNA的提取。采用Trizol法,参照文献[17]方法进行,略做改动。具体步骤是:称取0.1 g马铃薯叶片在研钵中用液氮研磨,取1.5 mL离心管加入1 mL Trizol液,将研磨液与Trizol液混合均匀;4 ℃、12 000 r/min离心15 min;转移上清液至另一离心管中,加入0.2 mL氯仿,涡旋混匀,室温放置5 min,4 ℃、12 000 r/min离心15 min;取上清液(水相)于另一离心管中,按上清液体积分别加入1/2体积的异戊醇、0.8 mol/L柠檬酸钠和1.2 mol/L氯化钠,混合均匀,室温放置5~10 min,4 ℃、12 000 r/min离心8 min,弃上清液,将沉淀用1 mL 体积分数75%乙醇洗涤2次,4 ℃、12 000 r/min离心15 min,小心倒掉乙醇,室温自然干燥后溶于用焦碳酸二乙酯(DEPC)处理过的ddH2O,于-80 ℃条件下保存。
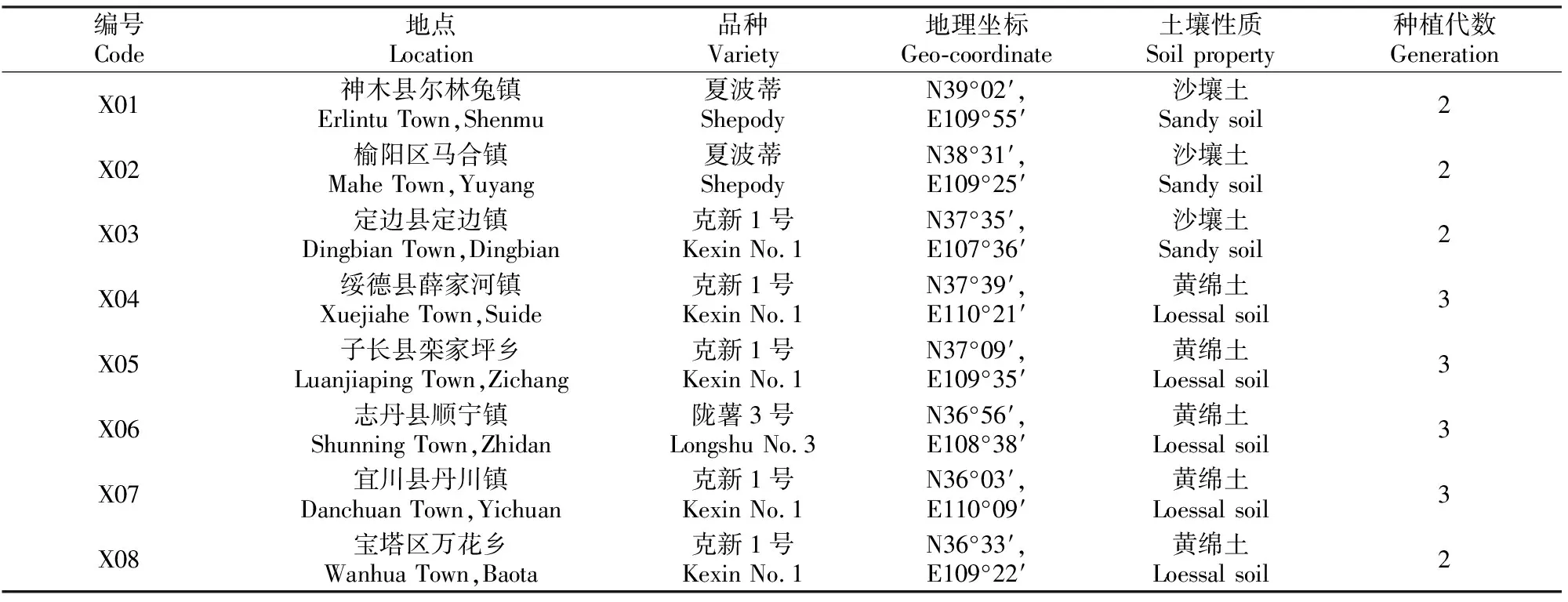
表 1 供试马铃薯样品的信息
2) cDNA的合成。按照cDNA合成试剂盒说明书操作,对提取的马铃薯叶片总RNA进行反转录。具体反应体系如下:马铃薯总RNA 5 μL,Anchored Oligo(dT)18(0.5 μg/μL) 1 μL,2×ES Reaction Mix 10 μL,EasyScriptRTEnzyme Mix 1 μL,加RNase-free Water至20 μL。混匀后,水浴锅中42 ℃孵育30 min,在PCR仪中于85 ℃条件下加热失活5 min。
3) PCR反应及产物检测。PCR反应体系:cDNA 3 μL,上游引物1 μL,下游引物1 μL,10×buffer 5 μL,2.5 mmol/L dNTPs 4 μL,TaqDNA聚合酶1 μL,加ddH2O至50 μL。PCR反应程序:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 10 min。取6 μL PCR扩增产物与1 μL Loading Buffer混匀,用15 g/L琼脂糖凝胶电泳检测PCR产物,于凝胶成像系统中照相。
1.2.2 CP基因的克隆及序列测定 用DNA胶回收试剂盒回收纯化PCR产物,将其与pGEM-Teasy载体连接过夜,转化大肠杆菌Trans1-T1感受态细胞,在加有IPTG和X-gal的LB平板上筛选白色菌落,于LB液体培养基中培养,采用碱裂解法提取质粒,用EcoRⅠ和Hind Ⅲ限制性内切酶对重组质粒进行鉴定。将含目的条带的阳性重组质粒送南京金斯瑞生物科技有限公司测序。
1.2.3 CP基因序列分析 用DNAstar软件分析CP基因的序列相似性,用Clustalx 1.83和Mega 5.0软件进行序列比对,采用邻接法(Neighbor-joining,NJ) 构建系统进化树。在GenBank中搜索国内外12个不同地区(表2)的马铃薯X病毒CP基因序列,构建系统进化树,分析陕北马铃薯X病毒的来源及不同地区陕北马铃薯X病毒CP基因变异程度。

表 2 国内外12个不同地区马铃薯X病毒CP基因序列的信息
2 结果与分析
2.1 马铃薯X病毒CP基因的RT-PCR检测
对采自陕北8个县(区)的马铃薯叶片cDNA的PCR产物用15 g/L琼脂糖凝胶电泳进行检测,结果(图1)发现,均能扩增出长度为620 bp左右的目的条带,表明这些马铃薯植株均感染了X病毒。但不同县(区)样品PCR产物的电泳条带亮度不一,其中,宜川县丹川镇(7泳道)样品的PCR产物条带最亮,神木县尔林兔镇(1泳道)、榆阳区马合镇(2泳道)样品PCR产物条带亮度次之,其他5个县(区)样品PCR产物条带亮度较淡。可能是由于提取的样品总RNA品质不同,导致PCR体系中cDNA品质有差异所致。

图 1 马铃薯X病毒CP基因的RT-PCR检测结果
2.2 马铃薯X病毒CP基因序列的分析
将X01~X08 8个马铃薯X病毒CP基因片段提交GenBank数据库,获得的GenBank登录号分别为KJ620839、KJ620840、KJ620841、KJ620842、KJ620843、KJ620844、KJ620845、KJ620846。用DNAstar软件比对后发现,8个CP基因序列之间均有不同程度的差异,其(G+C)含量在50.0%~51.29%,故从GenBank数据库中搜索(G+C)含量在49.58%~51.96%的其他12个地区马铃薯X病毒CP基因,进行序列一致性分析,结果表明,本研究中的8个CP基因序列一致性较高,其中X02(榆阳区)与X03(定边县)样品CP基因一致性最低,为95.2%;X01(神木县)与X02(榆阳区)样品CP基因一致性最高,为99.4%;来自陕北8个县(区)样品与从GenBank中搜索的国内外其他12个地区马铃薯X病毒CP基因的一致性为92.9%~98.5%。
系统进化树(图2)显示,陕北8个县(区)马铃薯X病毒CP基因的系统进化来源相似,虽聚为一个大类,但又分为2个区,其中,子长县、宝塔区、定边县和志丹县X病毒的CP基因序列分在Ⅰ区,与阿根廷、加拿大及我国黑龙江CP基因分在同一个区;神木县、榆阳区、绥德县和宜川县X病毒的CP基因序列分在Ⅱ区,同时北京CP基因分在该区。就地理位置而言,Ⅰ区的陕北4个采样地主要分布在东北方向,靠近内蒙古和山西;而Ⅱ区的陕北4个采样地分布在西南方向,与甘肃和宁夏毗邻。我国新疆、宁夏与印度、美国的CP基因序列来源相似,同分在Ⅲ区;我国福建与澳大利亚的CP基因序列相似,我国贵州与英国的CP基因序列相似,以上4个CP基因同分在Ⅳ区。
3 讨 论
本研究调查发现,陕北8个县(区)最近几年都在推广种植脱毒马铃薯,但一级脱毒种薯种植2~3年后,马铃薯叶片开始出现花叶、皱缩等症状,薯块性状发生变化,产量也呈下降趋势,说明X病毒或其他病毒可能在马铃薯体内存在。究其原因,一是地方检疫部门对马铃薯脱毒苗及各级种薯的检验检疫监督不严,造成将带毒种薯发放给农民种植;二是大部分农户分散种植马铃薯,且马铃薯与其他作物倒茬轮作种植,在倒茬种植时,原有茄科植物如西红柿、辣椒等感染的各种病毒,会由机械或汁液传播感染马铃薯。

图 2 陕北及国内外不同地区马铃薯X病毒CP基因序列的系统进化树
RT-PCR分子检测技术可快速、准确地检测马铃薯的携带病毒情况,是近年来国内外应用较为普遍的病毒检测技术,该技术的应用对脱毒马铃薯种薯的推广及马铃薯产业的发展具有重要意义。笔者认为,采用RT-PCR法检测病毒时,只要提取的马铃薯总RNA品质高,设计不同的特异引物,就能扩增出预期的目的条带,不会发生假阴性现象,检测效果好。另外,在用RT-PCR法检测常见的PVX、PVY、PVS、PVA、PVM和PLRV 6种病毒以及类病毒PSTVd时,可通过改变PCR反应体系中的温度,从而在PCR仪中实现多种病毒的同步检测。
马铃薯X病毒CP基因序列的系统进化树表明,本研究中的陕北8个县(区)马铃薯X病毒CP基因的序列一致性为95.2%~99.4%,与国内外12个不同地区马铃薯X病毒CP基因序列的一致性在92.9%~98.5%。曲静等[18]发现,山东马铃薯X病毒分离物与GenBank中15个有代表性的X病毒株系或分离物的CP基因序列的一致性在80.1%~99.7%;张威等[19]发现,黑龙江马铃薯X病毒分离物与GenBank中17个X病毒分离物的CP基因序列一致性在75.5%~99.2%;姚东校等[20]发现,贵州马铃薯X病毒分离物与19个不同地区X病毒分离物的CP基因序列一致性在78.6%~97.5%。本研究中,陕北马铃薯X病毒CP基因与其他12个地区CP基因序列一致性较高,可能是因为陕北地区近几年引入马铃薯品种较多,引种时间较短所致。这与Kawakami等[21]、Robertson等[22]对马铃薯X病毒CP基因序列的系统进化分析结果一致。总之,陕北地区马铃薯X病毒CP基因存在一定程度的变异,但其系统进化来源相似,聚为一个大类。主要是引种速度较快、引入品种较多所致。由于采集地和土壤性质不同,有关引进品种、机械操作方式和种植年代不同引起的马铃薯X病毒CP基因序列变异,还有待进一步研究。
[参考文献]
[1] Mary E B,Thomas A Z.Virus problems of potatoes [EB/OL].(2005-04-11)[2014-04-03].http://vegetable mdoline.ppath.comell.edu/News Articlees/ Potato_Virus.htm.
[2] 李凤云.马铃薯茎尖脱毒效果影响因素的研究 [J].中国马铃薯,2008,22(4):201-204.
Li F Y.Factors influencing potato meristem culture for elimination of viruses [J].China Potato,2008,22(4):201-204.(in Chinese)
[3] 白建明,陈晓玲,卢新雄,等.超低温保存法去除马铃薯X病毒和马铃薯纺锤类病毒 [J].分子植物育种,2010,8(3):605-611.
Bai J M,Chen X L,Lu X X,et al.Elimination of potato virus X and potato spindle tuber viroid by cryopreservation [J].Molecular Plant Breeding,2010,8(3):605-611.(in Chinese)
[4] 吴兴泉,时 妍,杨庆东,等.马铃薯病毒的RT-PCR检测技术评述 [J].中国马铃薯,2011,25(4):251-254.
Wu X Q,Shi Y,Yang Q D,et al.RT-PCR detection technology for potato viruses [J].China Potato,2011,25(4):251-254.(in Chinese)
[5] 吴志明,时 星,谢晓亮,等.河北省马铃薯Y病毒株系分子鉴定及其RT-PCR检测 [J].河北农业大学学报,2005,28(3):54-59.
Wu Z M,Shi X,Xie X L,et al.Molecular identification of Hebei potato virus Y isolate and its detection by RT-PCR [J].Journal of Agriculture University of Hebei,2005,28(3):54-59.(in Chinese)
[6] 王建辉,刘建军,陈克玲,等.三种葡萄病毒的RT-PCR检测和系统进化分析 [J].果树学报,2013,30(2):197-201.
Wang J H,Liu J J,Chen K L,et al.RT-PCR detection and phylogenetic studies on three viruses from grapevine [J].Journal of Fruit Science,2013,30(2):197-201.(in Chinese)
[7] Nie X,Singh R P.A novel usage of random primers for multiplex RT-PCR detection of virus and viroid in aphids,leaves,and tubers [J].Journal of Virological Methods,2001,91(1):37-49.
[8] 王中康,夏玉先,袁 青,等.马铃薯种苗复合感染病毒多重RT-PCR同步快速检测 [J].植物病理学报,2005,35(2):109-115.
Wang Z K,Xia Y X,Yuan Q,et al.Detection of mix-infected potato viruses with multiplex RT-PCR [J].Acta Phytopathologica Sinica,2005,35(2):109-115.(in Chinese)
[9] 董代幸,张祥林,罗 明,等.马铃薯病毒一步法多重RT-PCR检测技术的构建 [J].微生物学通报,2011,38(1):131-137.
Dong D X,Zhang X L,Luo M,et al.Development of one-step multiplex RT-PCR for simultaneous detection of four potato viruses [J].Microbiology China,2011,38(1):131-137.(in Chinese)
[10] Bright O A,Patrick J S,Philip H B.Simultaneous dection of potato viruses,PLRV,PVA,PVX and PVY from dormant potato tubers by TanMan real-time RT-PCR [J].Journal of Virological Methods,2007,142(1/2):1-9.
[11] Sheila M M,Michael G K,Roger A C.A single tube,quantitative real-time RT-PCR assay that detects four potato viruses simultaneously [J].Journal of Virological Methods,2009,161(2):289-296.
[12] Gambino G,Gnbaudo I.Simultaneous detection of nine grapevine viruses by multiplex RT-PCR with coamplification of a plant RNA as internal control [J].Virology,2006,96(11):1223-1229.
[13] 牛建新,马兵钢,何 梅,等.库尔勒香梨主要病毒多重RT-PCR检测技术研究 [J].植物病理学报,2006,36(1):12-21.
Niu J X,Ma B G,He M,et al.Multiple RT-PCR detection of viruses in pear [J].Acta Phytopathologica Sinica,2006,36(1):12-21.(in Chinese)
[14] 白建明,杨琼芬,李先平,等.利用RT-PCR快速检测马铃薯X病毒(PVX) [J].西南农业学报,2009,22(6):1596-1598.
Bai J M,Yang Q F,Li X P,et al.Rapid detection of potato virus X by RT-PCR [J].Southwest China Journal of Agricultural Sciences,2009,22(6):1596-1598.(in Chinese)
[15] 张艳萍,厚毅清,裴怀弟,等.马铃薯X病毒的分子生物学方法检测探究 [J].种子,2011,30(12):75-77.
Zhang Y P,Hou Y Q,Pei H D,et al.Probation the detecting method of potato X virus by molecular biology [J].Seed,2011,30(12):75-77. (in Chinese)
[16] 朱云芬,程 群,沈艳芬,等.马铃薯X病毒的RT-PCR和IC-RT-PCR检测 [J].中国马铃薯,2012,26(6):370-373.
Zhu Y F,Cheng Q,Shen Y F,et al.Detection of potato virus X by RT-PCR and IC-RT-PCR [J].China Potato,2012,26(6):370-373.(in Chinese)
[17] Courtney E J,Amy O C,David K W.Evaluation of isolation methods and RNA integrity for bacterial RNA quantitation [J].Journal of Microbiological Methods,2008,75(2):318-324.
[18] 曲 静,朱常香,温孚江,等.一个马铃薯X病毒分离物的外壳蛋白基因序列分析与株系鉴定 [J].植物保护学报,2003,30(4):358-364.
Qu J,Zhu C X,Wen F J,et al.Coat protein genes analysis and identification of an isolate of potato virus X [J].Acta Phytophylacica Sinica,2003,30(4):358-364.(in Chinese)
[19] 张 威,白艳菊,申 宇,等.马铃薯X病毒黑龙江分离物外壳蛋白基因克隆与序列分析 [J].黑龙江农业科学,2010(8):1-5.
Zhang W,Bai Y J,Shen Y,et al.Cloning and sequences analysis of CP gene of potato virus X Heilongjiang isolate [J].Heilongjiang Agriculture Sciences,2010(8):1-5.
[20] 姚东校,洪 鲲,杨立昌,等.马铃薯X病毒贵州分离物的分子鉴定 [J].广东农业科学,2013(13):139-142.
Yao D X,Hong K,Yang L C,et al.Molecular identification of a potato virus X isolated from potatoes in Guizhou [J].Journal of Agricultural Sciences of Guangdong,2013(13):139-142.(in Chinese)
[21] Kawakami K,Fuji S,Miyoshi K.Complete nucleotide sequence of a new potexvirus,“Phaiusvirus X”,isolated fromPhaiusflavusLindl [J].Archives of Virology,2008,153(3):527-531.
[22] Robertson N L,Smeenk J,Anderson J M.Molecular characterization of potato leafroll virus,potato virus A,and potato virus X isolates from potatoes in Alaskan cities and villages [EB/OL].(2011-02-09)[2014-04-03].http://www.plantmanagementnetwork.org/pub/php/brief/2011/potato/.
