Co2+-H2O体系羟基配离子配位平衡
2014-03-26田庆华辛云涛郭学益王恒利袁廷刚
田庆华,辛云涛,郭学益,王恒利,袁廷刚
(中南大学 冶金与环境学院,长沙 410083)
钴作为重要的战略金属,广泛应用于航天、航空、电池、电器、机械制造和陶瓷等领域[1-2]。同时,钴离子也是常见的具有一定毒性的重金属[3],经常接触钴或暴露于过量的钴环境中,可引起钴中毒。在矿物的选-采-冶炼过程、材料及合金的生产过程中会产生大量的含钴废水,此外,大量的电子废弃物,废旧合金材料等的堆放,也会污染大量土地与水源。随着现代工业的发展,产生越来越多的含钴废弃物与废水[4],会危害人类身体健康并造成极大的环境污染。因此,有必要对含钴废水进行有效的净化处理和回收[5]。对于含钴废水的处理技术,一般有化学沉淀法[6-7]、生物膜过滤法[8]、离子交换法和生物处理法[9]等。其中钴的水解沉淀法是主要的回收溶液中钴的方法。有研究者对溶液中钴离子的水解过程进行过热力学分析,但是只局限于单一体系,并没有系统地考虑到溶液中的钴羟基配离子[10],对其水解沉淀工艺过程有一定的影响[11]。
本文作者引入无机化学里面的配位化学理论[12]和水化学理论[13],全面考虑到含钴溶液中的各种钴离子的羟基配合离子,对于Co2+-H2O体系中羟合配离子的热力学平衡进行详细全面的分析研究,计算在不同酸碱条件下金属氢氧化物的热力学行为,绘制本体系的配合离子浓度 pc-pH图、钴羟基合配离子百分率αn-pH和lgαn-pH图以及Co(OH)2条件溶度积pPs-pH图。旨在揭示钴金属离子在水溶液中的存在形态及其氢氧化物的溶解度随 pH变化规律,从热力学角度确定氢氧化物在水溶液中的最小溶解度及其从电解液和废水中脱除的最佳pH范围。这些热力学图能为中和水解法净化含钴废水及湿法冶金过程除杂提供更加严格的理论依据。
1 pH值对Co2+离子羟基配位平衡的影响
含钴(Co2+)溶液中除了 Co2+离子外,钴离子的羟基配离子主要以 Co(OH)+、Co(OH)2、Co(OH)3-、Co(O、Co2(OH)3+和Co4(O的形式存在。


对于反应式(7)~(13)的两边同时取对数,lgKw=lg[OH-]+lg[H+],即 lg[OH-]=lgKw+pH,同时pc(Me)= -lgc(Me)(c为摩尔浓度),可以得到:

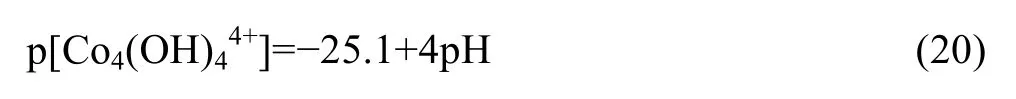
将反应式(14)~(20)在pc[Me]-pH坐标系中作图,见图1。

图1 Co2+-H2O体系中pc-pH图Fig. 1 pc-pH diagram of Cd2+-H2O system
由图1可看出,图中每条直线表示与Co(OH)2固相平衡时对应的配位离子浓度与pH值的关系,阴影部分是Co(OH)2沉淀区域,即Co(OH)2沉淀区域小于固相的稳定区。其他区域为钴离子非饱和区。组成此稳定区的边界线近似地表示 Co2+-H2O系中 Co2+的总溶解度与pH值的关系。由图l可看出,当pH值为10~13时,钴的溶解度最小;当pH<10及pH>13时,钴的溶解度都会增加。
同时观察到 Co(OH)2和 Co2(OH)3+的溶解平衡曲线与Co(OH)2(s)的沉淀区域没有交点,说明它们不会直接生成 Co(OH)2(s)沉淀,需要转化为其他羟基配离子后才能进行。
2 pH值对Co2+离子形成羟合配离子形态的影响
在水溶液中,重金属 Co2+离子形成的配离子Co(OH)+、Co(OH)2、Co(O、Co(O、Co2(OH)3+和 Co4(O,其有关配位反应及逐级累积常数分别为


因此水溶液体系中,钴离子的总量可以表示为
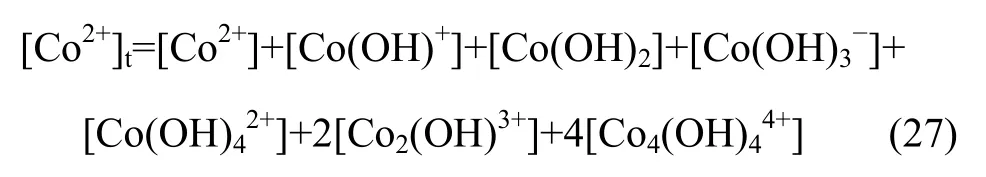
定义 α0、α1、α2、α3、α4、α5和 α6分别为 Co2+、Co(OH)+、Co(OH)2、Co(O、Co(O、Co2(OH)3+和Co4(O在溶液中的离子比率,则


从上述关系式可以看出,各种离子的浓度百分率与 OH-有很大的关系。根据[OH-][H+]=10-14,或者lg[OH-]=lgKw+pH,即可得[OH-]离子与 pH值之间的对应关系。
将不同的pH值代入式(28)可以得到相应pH值时的 α0。再应用式(29)~ (34)可以求出 α1、α2、α3、α4、α5和 α6。以不同离子浓度为纵坐标,pH值为横坐标作图,见图2(a)。以lgαn为纵坐标,pH值为横坐标作图,见图 2(b)。其中 αn-pH图可以直观地展示出不同 pH值条件下,溶液中主要存在的钴羟基配离子的种类;而lgαn-pH图则直观地展示不同pH值条件下,溶液中存在的不同钴羟基配离子之间的数量级关系。
从图2中可以看出,在不同pH值条件下,钴离子以不同羟基配离子形式存在,当pH值小于7.5时,主要以Co2+、Co4(O和少量Co2(OH)3+形式存在;当pH值为7.5~11时,主要以Co2+、Co(OH)+和少量Co(OH)2、Co(O的形式存在;当pH值为11~15时,主要以 Co(O、Co(O和少量 Co(OH)+、Co(OH)2的形式存在;当pH值大于15时,主要以Co(O形式存在。
从图2中可以看出,Co(OH)2和Co2(OH)3+的数量极少,结合pc-pH图,表明溶液中主要存在Co(OH)+、Co(O、Co(O、和 Co4(O这 4种羟基配离子。
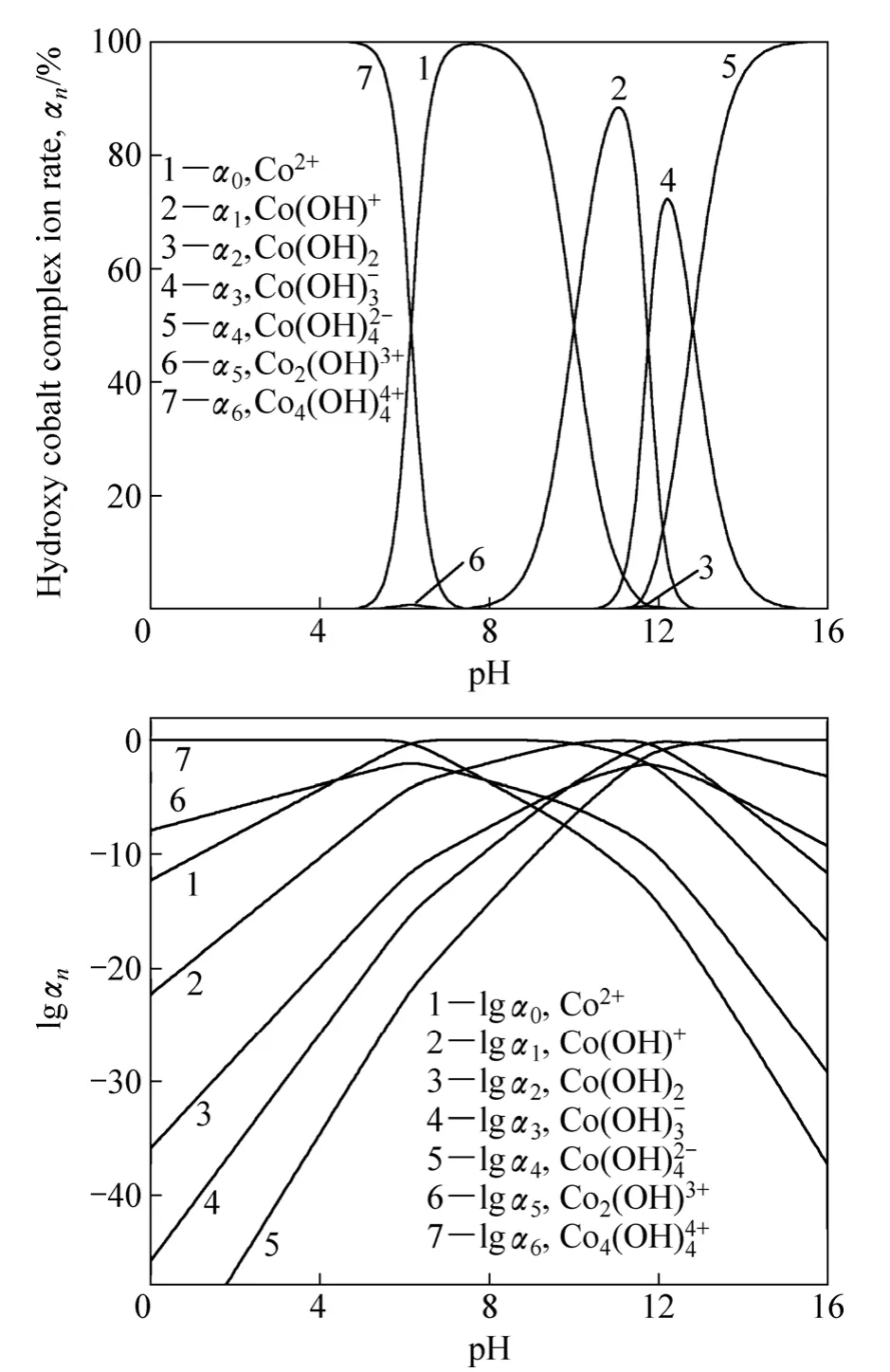
图2 Co2+-H2O体系lgαn-pH图Fig. 2 lgαn-pH diagram of Co2+-H2O system
3 pH值对Co(OH)2溶解度的影响
在Co2+-H2O体系中,由于生成多种羟合配离子,将使Co(OH)2的溶解度增加,现采用条件溶度积[15]的概念表达pH对Co(OH)2溶解度的影响。
Co(OH)2(s)条件溶度积Ps定义为

式中:[Co2+]t为Co(OH)2(s)饱和溶液中所有含Co物质中Co总浓度,即式(27)中所示。[Co2+]为游离态钴离子的浓度,[OH-]t为Co(OH)2(s)饱和溶液中所有含OH-物质总浓度,可以由式(7)计算,[Co2+]=Ks0/[OH-]2。
[Co(OH)+]、[Co(OH)2]、[Co(O]、[Co(O]、[Co2(OH)3+]和[Co4(O]为钴的羟基配离子,其浓度可由式(8)~(13)计算所得。

式中:[OH-]为溶液中游离态羟基的浓度,[Co(OH)+]、[Co(OH)2]、[Co(O]、[Co(O]、[Co2(OH)3+]和[Co4(O],其浓度同样可由式(8)~(13)计算所得。
将式(27)和(36)代入式(35)中,即可得到在不同pH值条件下的条件溶度积Ps的值,将计算结果对pH值作图,并将pKs0绘于图中,得到图3。
图3曲线表达Co(OH)2(s)溶解平衡时Co(OH)2条件溶度积与 pH值的关系。曲线上面所包围的面积是Co(OH)2(s)溶解的过饱和区,会产生 Co(OH)2沉淀,其他区域为非饱和区。曲线表明:当pH值为9~11时,Co(OH)2的溶解度最小;当pH>11或者pH<9时,Co(OH)2的溶度积较大,表明Co(OH)2溶解度随pH值的变化而变化。同时看到,pKs0直线处在非饱和区,表明中和水解法不能将钴脱除到Co(OH)2(s)溶度积所确定的最低钴浓度,条件溶度积为水解除钴提供更加精确的理论依据。

图3 Co(OH)2(s)的条件溶度积与pH值之间的关系Fig. 3 Relationship between conditional solubility product of Co(OH)2 and pH value
4 结论
1) pc-pH图描述了Co(OH)2(s)溶解平衡时,钴的总离子平衡浓度与pH值的关系,同时展示不同钴羟基配离子的溶解平衡曲线。当 pH 值为 10~13时,Co(OH)2(s)的溶解度最小。
2) αn-pH图指出了各种羟基配离子分率与pH值的关系,在不同的 pH值条件下,钴离子会形成不同种类的羟基配离子;lgαn-pH图直观地展示不同pH值条件下,溶液中存在的不同钴羟基配离子之间的数量关系。
3) pPs-pH图表明:Co(OH)2(s)的条件溶度积与对应pH值之间的关系,当pH值为9~11时,Co(OH)2(s)的条件溶度积最小。
[1] 赵声贵, 陈元初. 世界及中国钴资源供需情况[J]. 矿冶工程,2012, 32: 153-156.ZHAO Sheng-gui, CHEN Yuan-chu. The situation of supple and demand of cobalt resource in the word & China[J]. Mining and Metallurgical Engineering, 2012, 32: 153-156.
[2] 乐颂光. 钴冶金[M]. 北京: 冶金工业出版社, 1987: 2-5.LE Song-guang. Metallurgy of cobalt[M]. Beijing: Metallurgical Industrial Press, 1987: 2-5.
[3] 胡亦群, 宁慧青. 人体必需微量元素过量对健康的影响[J].太原科技, 2008, 172(5): 35-36.HU Yi-qun, NING Hui-qing. Influence of overintaking microelement required to human health[J]. Taiyuan Science &Technology, 2008, 172(5): 35-36.
[4] 谢福标. 含钴废料回收工艺述评[J]. 矿冶, 2003, 12(1): 63-66.XIE Fu-biao. View on recovery technology of cobaltiferous waste materials[J]. Mining & Metallurgy, 2003, 12(1): 63-66.
[5] 童 雄, 张艮林, 闫 森. 综合回收有色金属物料中伴生钴的研究概况[J]. 云南冶金, 2001, 30(6): 12-17.TONG Xiong, ZHANG Gen-lin, YAN Sen. General situation of research work on complex recovery of associated cobalt from nonferrous materials[J]. Yunnan Metallurgy, 2001, 30(6): 12-17.
[6] TIAN Qing-hua, XIN Yun-tao, JIAO Cui-yan, GUO Xue-yi.Recovery of cobalt from cobalt chloride solution under the action of ozone[J]. Advanced Materials Research, 2012(460):317-320.
[7] 田庆华, 辛云涛, 姚 标, 郭学益. 锌湿法冶金过程中臭氧氧化沉淀除去微量钴[J]. 中国有色金属学报, 2013, 23(4):1140-1144.TIAN Qing-hua, XIN Yun-tao, YAO Biao, GUO Xue-yi.Efficient purification of trace cobalt in zinc hydrometallurgical process by ozone oxidation[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(4): 1140-1144.
[8] MONIER M, ABDEL-LATIF D A. Modification and characterization of PET fibers for fast removal of Hg(Ⅱ), Cu(Ⅱ)and Co(Ⅱ) metal ions from aqueous solutions[J]. Journal of Hazardous Materials, 2013, 250: 122-130.
[9] SADIN O, ERSIN K, ANNARITA P. Biosorption of heavy metals (Cd2+, Cu2+, Co2+, and Mn2+) bythermophilicbacteria,geobacillus thermantarcticusandanoxybacillus amylolyticus:equilibrium and kinetic studies[J]. Bioremediation Journal, 2013,17(2): 86-96.
[10] 钟竹前, 梅光贵, 贺青蒲, 张训鹏. 废水中和水解净化的理论分析[J]. 有色冶炼, 1981(3): 34-42.ZHONG Zhu-qian, MEI Guang-gui, HE Qing-pu, ZHANG Xun-peng. Theoretical analysis of purification of wastewater by hydrolysis[J].Nonferrous Metallurgy, 1981(3): 34-42.
[11] 柴立元, 常 皓, 王云燕, 舒余德, 李 敬, 袁 林, 王 璞,方 艳, 赵 堃. Cd2+-H2O系羟合配离子配位平衡[J]. 中国有色金属学报, 2007, 17(3): 487-491.CHAI Li-yuan, CHANG Hao, WANG Yun-yan, SHU Yun-de, LI Jing, YUAN Lin, WANG Pu, FANG Yan, ZHAO Kun.Equilibrium of hydroxyl complex ions in Cd2+-H2O system[J].The Chinese Journal of Nonferrous Metals, 2007, 17(3):487-491.
[12] 张祥麟, 康 衡. 配位化学[M]. 长沙: 中南工业大学出版社,1986.ZHANG Xiang-lin, KANG Heng. Coordination chemistry[M].Changsha: Central South University of Technology Press,1986.
[13] STUMM W, MORGAN J J. 水化学天然水体化学平衡导论[M].汤鸿霄, 译. 北京: 科学出版社, 1987.STUMM W, MORGAN J J. Aquatic chemistry-an introduction emphasizing chemical equilibria in natural waters[M]. TANG Hong-xiao, tranls. Beijing: Science Press, 1987.
[14] MARTELL A E, SMITH R M. Critical stability constants[M].New York and London: Plenum Press, 1975: 393.
[15] 陈绍炎. 水化学[M]. 北京: 水利电力出版社, 1989.CHEN Shao-yan. Aquatic chemistry[M]. Beijing: Irrigation and Electrics Press, 1989.
