荧光原位杂交技术在基础实验教学中的应用
2014-03-25王宏刚陈成彬王春国宋文芹白艳玲张金红
王宏刚,陈成彬,王春国,陈 力,宋文芹,白艳玲,张金红, 刘 方
(南开大学 生物实验教学中心,天津 300071)
荧光原位杂交技术(fluorescence in situ hybridization, FISH)是20世纪80年代末在放射性原位杂交技术的基础上发展起来的一种非放射性分子细胞遗传技术[1-2]。他的基本原理是先把DNA(或RNA)探针用特殊的荧光染料标记,然后将探针直接杂交到染色体上,通过荧光染料发出的荧光来检测DNA序列在染色体上的定位、定性、相对定量分析。FISH具有安全、快速、灵敏度高、探针能长期保存、能同时显示多种颜色等优点,不但能显示中期分裂相,还能显示于间期核。目前,这项技术已应用于生命科学、医学等多个领域的科学研究[3-7]。
荧光原位杂交技术已成为生命科学类专业的学生在进行科研所必需的一项基本实验技术。因此,需要在本科生的基础实验中设计相关的实验项目,让每一位生命科学类专业的本科生都能够熟练掌握这项技术。我们将荧光原位杂交技术的基本原理和细胞生物学理论课中关于染色体端粒的相关知识结合在一起,设计了“端粒序列的荧光原位杂交定位”实验。通过这个实验,学生不但可以掌握荧光原位杂交技术的原理和实验方法,还可以对中期染色体的形态及端粒的位置有更深的认识,巩固了理论课学习的内容。
1 实验材料和试剂
(1) 实验材料:动物细胞为小鼠淋巴瘤EL4细胞系、仓鼠卵巢CHO细胞系和鼠杂交瘤细胞系;植物材料为水稻、玉米和黑麦。
(2) 实验试剂:无水乙醇、甲醇、冰醋酸、2.5%果胶酶、2.5%纤维素酶、0.01%秋水仙碱、饱和对二氯代苯水溶液、Giemsa染色液、1640培养基、小牛血清、0.25%的胰蛋白酶、0.075mol的KCl低渗液、70%的去离子甲酰胺、Tween 20、20×SSC、含DAPI的防荧光淬灭剂。
(3) 端粒探针:植物端粒探针FAM-5’TTTAGGGTTTAGGGTTTAGGG 3’ ;动物端粒探针TAMRA-5’TTAGGGTTAGGGTTAGGG 3’
2 实验方法
2.1 染色体标本的制备
2.1.1 植物染色体标本的制备
植物材料按常规培养方法进行培养,待种子萌发根尖长至0.5~1 cm后切下生长旺盛的种子根尖,用饱和对二氯代苯溶液室温预处理3~5 h;吸去预处理液,用蒸馏水或0.075 mol/L的KCl低渗30 min;然后用卡诺固定液固定20 min,用蒸馏水洗3次,每次5 min;用2.5%的果胶酶和纤维素酶37 ℃解离根尖1 h;用蒸馏水洗去酶液,再次低渗15 min;倒掉蒸馏水,用3∶1卡诺固定液再次固定20 min;取根尖并置于预先在蒸馏水中预冷(4 ℃)的洁净载玻片上,滴一滴固定液,用镊子将根尖充分捣碎,再加1滴固定液,将细胞吹散,空气干燥后用1∶30稀释的Giemsa染色液染色10 min,自来水冲洗晾干;镜检并选择分散良好的染色体用玻璃笔在反面标记位置,-20 ℃冰箱中保存待用。
2.1.2 动物细胞染色体标本的制备
将长成单层的贴壁细胞按1∶2进行传代培养(如果是悬浮培养的细胞可以直接分瓶进行传代);36 h后,用质量浓度为0.04 mg/L的秋水仙素处理3 h或者低浓度秋水仙素处理过夜;用0.25%的胰蛋白酶处理单层细胞,待细胞收缩变圆时,弃去消化液并加入少许低渗液将细胞从瓶壁上洗脱下来(悬浮细胞可省去这一步);将细胞移入离心管,1 000 r/min离心10 min,弃上清;加入预热的37 ℃的0.075 mol/L的KCl溶液低渗处理15 min;1 000 r/min离心10 min,弃上清;加入新鲜配制的卡诺固定液5 mL,边加边将细胞轻轻悬起,固定30 min;离心弃上清,再加5 mL新鲜配制的固定液,固定20 min;离心弃上清,根据沉淀细胞的多少,加固定液0.5~1 mL制成细胞悬液;吸1滴细胞悬液,距载玻片约20 cm的高度滴于预冷的干净载玻片上,迅速对准细胞吹气,促进染色体分散;自然干燥后,用1∶20稀释的Giemsa染色 5 min;镜检,选择分散良好的染色体用玻璃笔在反面标记位置,-20 ℃冰箱中保存待用。
2.2 原位杂交
将载玻片在45%的醋酸中浸泡5 min褪色,空气干燥;在标记处加30 μL、70%的去离子甲酰胺/2×SSC,盖上盖玻片,于干式恒温器中70 ℃变性2~4 min;去掉盖片,-20℃的冷乙醇系列(体积分数分别为70%,85%,100%)脱水,每级3 min,空气干燥;每张标本加10 μL用2×SSC稀释探针至5 mg/L探针,盖上盖玻片;于湿盒中37 ℃杂交0.5~1.5 h;在4×SSC、0.2%Tween 20中室温下避光洗涤10 min;蒸馏水冲洗片刻,空气干燥(避光);滴加5 μL含有DAPI的防荧光淬灭剂,盖上盖玻片;荧光显微镜观察,并用冷CCD拍照。
3 实验结果
在荧光显微镜下,可以清楚地观察到经DAPI染色后,紫外光激发染色体发出的蓝色荧光。植物细胞中,蓝光激发同端粒序列结合的探针上的荧光基团发出绿色荧光(见图1—图3)。动物细胞中,绿光激发同端粒序列结合的探针上的荧光基团发出红色荧光(见图4—图6)。
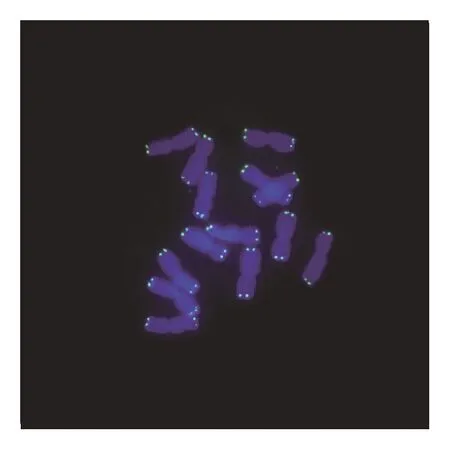
图1 玉米端粒荧光原位杂交(100×)
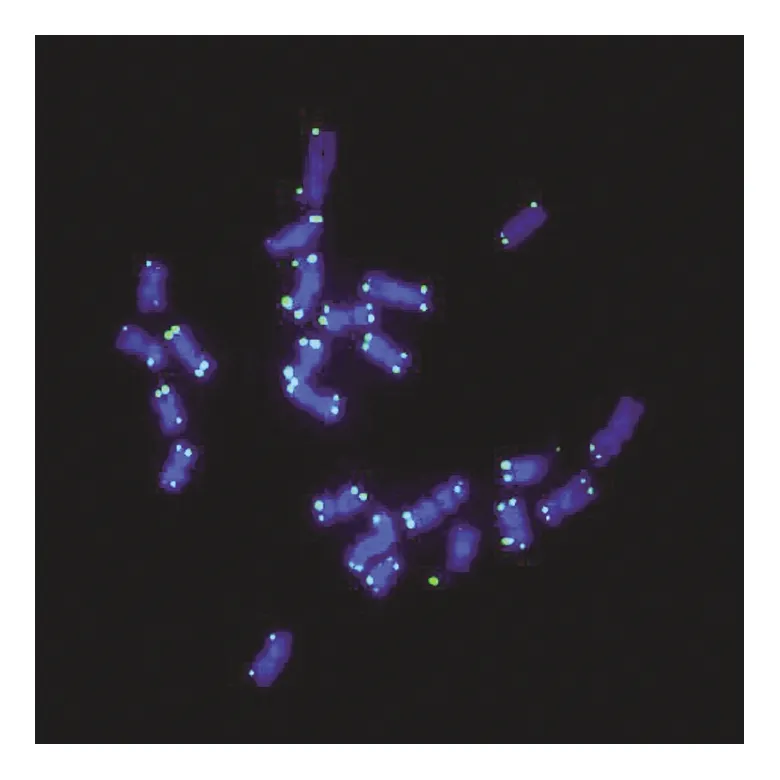
图2 水稻端粒荧光原位杂交(100×)
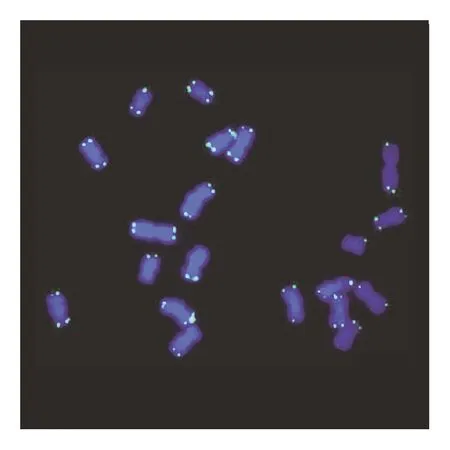
图3 黑麦端粒荧光原位杂交(100×)
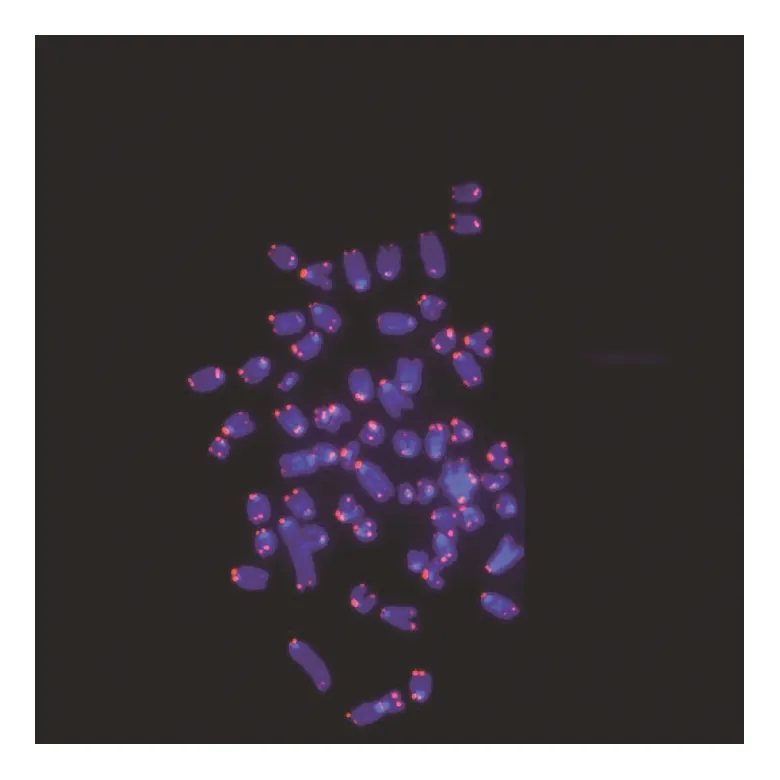
图4 鼠杂交瘤细胞端粒荧光原位杂交(100×)
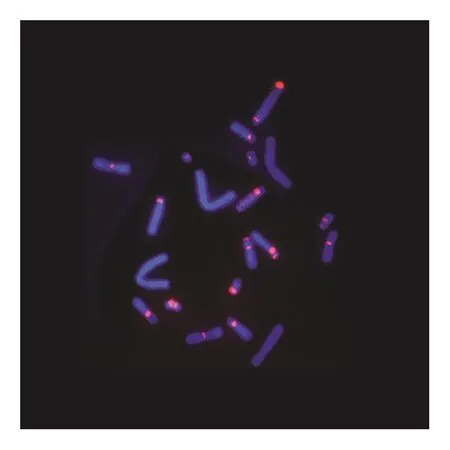
图5 仓鼠卵巢CHO细胞端粒荧光原位杂交
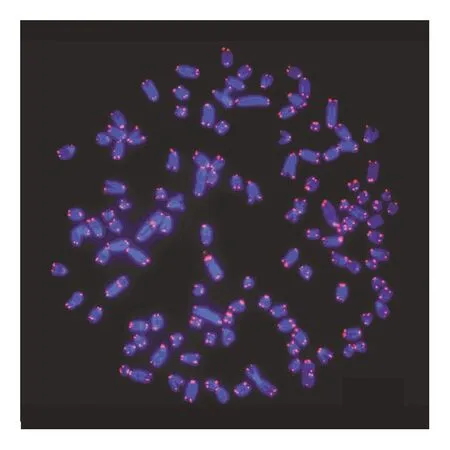
图6 小鼠淋巴瘤EL4细胞端粒荧光原位杂交(100×)
4 注意事项
(1) 染色体标本制备注意事项[8-11]:
① 秋水仙素的浓度和处理时间的长短需把握好。处理不足,则染色体过于细长;处理过度,则染色体则会呈短粗状,均不利于观察。
② 低渗处理是染色体制备过程中的关键步骤,直接影响染色体形态好坏。低渗处理时细胞体积膨胀,容易破碎。因此,在低渗细胞混匀时,吹打动作要轻柔。
③ 固定是得到良好分散的染色体分裂相的重要步骤,考虑到基础实验课时间较短,故采用分步多次固定的办法。
④ 滴片时使用的载玻片一定要非常干净,此外,滴片的距离、滴加量多少也会影染色体分散的效果。
(2) 原位杂交注意事项:
① 变性的时间和温度是杂交是否成功的关键,为了保证变性期间温度的稳定,变性时可以使用PCR仪或干式恒温器;
② 变性结束,要立即甩掉盖玻片并放入70%的冰乙醇中脱水,以免DNA复性,探针结合效率降低;
③ 杂交过程应保持染色体标本的湿润,可以在饭盒内铺一层湿润的滤纸做成湿盒,然后在湿盒中避光进行杂交;
④ 在使用荧光显微镜进行观察时,应尽快找到合适的分裂相并进行图像采集,防止在长时间强光照射下荧光的萃灭。
5 讨论
5.1 课时安排
基础实验课最突出的特点是每次上课的时间有限,一般情况下,每次实验课的时间为4~5课时。因此,该实验需要分两次课完成。第1次课完成染色体标本的制备,第2次课完成原位杂交。如果课时紧张,可由教师制作染色体标本,学生只完成原位杂交的实验内容。
在实验材料的选择上也可以根据具体情况灵活决定,如果考虑到植物染色体标本制备的难度较大,可以只选择动物细胞作为实验材料。在细胞类型的选择上,可以选择生长较快、中期染色体形态典型的细胞系,一方面可以缩短细胞培养的时间,另一方面有利于学生观察学习。
5.2 教学组织
同综合性、开放性实验相比,基础实验课有诸多自己的特点。如基础性实验学生人数较多、强调单人操作、注重对学生基本实验技能的训练等。因此,需要在教学的组织上大胆创新。例如,本实验中,荧光显微镜使用的训练是主要目的之一,但荧光显微镜价格昂贵,不可能大批量配备,在授课课程中,可以将学生分为若干小组,每个小组在0.5~1.5 h的范围内采用不同的杂交孵育时间,就可以将学生使用荧光显微镜的时间分散开,避免因仪器数量不足给教学带来影响。
6 结束语
将科研过程中常用的实验技术转化为适合本科生基础实验课教学的实验内容是实验课教学改革的一个重要方向。荧光原位杂交技术已经广泛应用于生命科学领域研究的各个方面,将其转化为合适本科生基础实验教学的内容,对扩展学生的创新思维、提高学生的科研能力都有重要的意义[12-13]。
[1] 陈成忠,于洪芹.荧光原位杂交技术及其应用[J].生物学教学,2007,32(1):2-4.
[2] 王玲,宁顺斌,宋运淳,等.荧光原位杂交技术的发展与应用[J].植物学报,2000,42(11):1101-1107.
[3] 杨国华,英加,李滨,等.荧光原位杂交技术在植物细胞遗传学和绘制基因图谱中的应用现状与展望[J].西北植物学报,2002,22(2):421-429.
[4] 佘朝文,宋运淳.植物荧光原位杂交技术的发展及其在植物基因组分析中的应用[J].武汉植物学研究,2006,24(4):365-376.
[5] 陈琦,贾宇臣,王利,等.荧光原位杂交技术及其在医学诊断上的应用[J].现代生物医学进展, 2012,12(5):988-991.
[6] 徐月娟,沈蕾,赵鹏军.多色-FISH 技术的进展及其在分子生物医学上的应用[J].细胞生物学杂志, 2007,29(6):853-858.
[7] 杨艳丽,杨长俊.DNA 荧光原位杂交(FISH) 技术在血液肿瘤诊断中的运用[J].中国医学工程,2013,21(2):54,57.
[8] 宋文芹,李秀兰,许文胜,等.黑麦染色体的显微分离与PCR 扩增[J].植物学报,1998,40(2):158-162.
[9] 陈瑞阳,宋文芹,李秀兰.植物染色体标本制备的去壁、低渗法及其在细胞遗传学中的意义[J].遗传学报,1982,9(2):151-159.
[10] 林颖,姜芬.动物细胞染色体制备实验的改进[J].福建医科大学学报,2002,36(2):228-229.
[11] 秦璐璐,耿建萍.杂交瘤细胞染色体制备及生物学意义初探[J].医学理论与实践,2008,21(4):375-376.
[12] 解丽芳,林宏辉.利用基础实验教学平台普及教研结合[J].实验技术与管理,2012,29(11):250-252.
[13] 王尚英,肖潇.关于生物基础实验教学的探索[J].实验技术与管理,2008,25(7):236-237.
