山西霍山五角枫不同海拔种群遗传多样性研究
2014-03-25张翠琴林丽丽王祎玲
张翠琴, 林丽丽, 王祎玲
(山西师范大学 生命科学学院, 临汾 041004)
五角枫(AcermonoMaxim),隶属于槭树科(Aceraceae)槭属(Acer),为落叶乔木,生长旺盛,分布于东北、华北和长江流域各省[1]。在秋天因树龄不同叶片呈现不同颜色,观赏价值很高,而且净化空气的作用效果也好,已成为中国许多地区重要的街道种植植物和风景林树种[2];同时树体含水量大,枯枝落叶分解快,也是极好的防火树种[3];五角枫单宁具有镇静、催眠、镇痛作用,抗凝血作用明显,是治疗抗脑血栓的新药;五角枫油对肿瘤细胞有一定抑制作用,可促进新组织生长[4],有广阔应用前景。而五角枫种群现处于下降的趋势,分布也较以前零散 ,在《中国物种红色名录》被列为“近危种”,因此,研究五角枫遗传多样性和遗传结构十分迫切。
相关序列扩增多态性(Sequence—related amplified polymorphism,SRAP) 是由美国加州大学作物系Li 和Quiros博士于2001年开发出来的一种新型分子标记技术[5]。它克服了SSR(Simple amplified polymorphic DNA)位点较少、AFLP(Amplified fragment length polymorphism)成本高的缺点[6],是简单经济、有效可靠的分子标记系统,已成功应用于光核桃[6]、白花树[7]、麦冬[8]、鸭茅[9]等植物的遗传多样性研究。
据姬志峰等[10]的山西霍山五角枫天然种群表型性状研究发现:五角枫表型性状多样性较高,且各个性状之间存在一定的遗传变异。在不同种群中,高海拔种群的表型变异较丰富,其表型多样性就相对较高,而低海拔变异较低,表型多样性就贫乏。本文采用相关序列扩增多态性(SRAP)技术探讨山西霍山不同海拔五角枫种群的遗传多样性及其遗传结构,揭示五角枫种群的遗传变异,了解种群内和种群间的变异大小,分析影响五角枫遗传结构的因素及其与生境因子的相互关系,为合理开发利用及保护五角枫资源提供科学依据。
1 材料与方法
1.1 试材及取样
供试材料于2011年5月初采自山西霍山兴唐寺,野外研究调查发现,五角枫在兴唐寺分布于海拔1400 m至2200 m之间, 由于海拔1400 m位于五角枫分布的边缘地段,个体稀疏且分布不集中,受人为干扰严重,根据五角枫所处的地理环境,从1550 m开始采集,每个采集样地的海拔相隔约150 m,每个采集样地作为一个种群处理,共采集到5个种群,分别标记为种群1(1550 m)、2(1700 m)、3(1850 m)、4(2000 m)、5(2150 m)。为避免由于营养繁殖所致的同一株系基因型的重复采样,植株间距不小于30 m,每个种群随机选取20~30个个体,同时采集每个样地的土壤样品和地理信息(表1)。所采集的叶片用变色硅胶迅速干燥,带回实验室,于-80℃超低温冰箱中保存备用。
1.2试验方法
1.2.1DNA的提取与纯度检测
本文采用改良的2×CTAB法[11]提取五角枫基因组总DNA。
用1%的琼脂糖凝胶电泳检测样品DNA的完整性,并用紫外分光光度计测定OD260和OD280的值,计算其纯度及浓度。
1.2.2PCR扩增与引物筛选
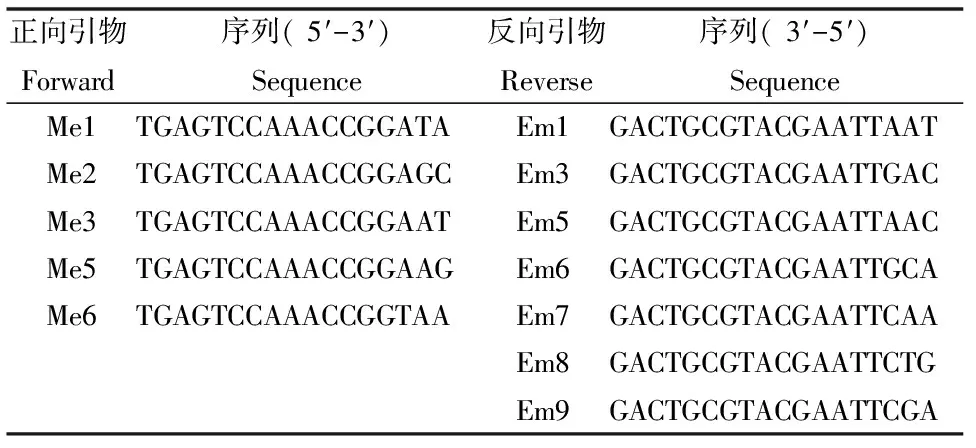
表2 本文中所用SRAP引物序列
选用Li和Quriros[5]所报道的引物,从88对引物组合中筛选出扩增条带清晰、重复性好的11对引物组合(表2),用于所有个体的DNA样本的扩增。PCR扩增采用10 μL的反应体系,并对不同退火温度、PCR扩增循环数以及反应体系进行优化。最终确定PCR的反应体系为10 μL:0.4 μL引物(0.2 μL Me+0.2 μL Em),1 μL DNA模板,5 μL Mix,3.6 μL ddH2O,正反向引物均为0.2 μL(0.75 μmol/L),每管加10 μL矿物油覆盖。基因扩增仪为PTC-100型,反应程序为94℃预变性5 min,94℃变性1 min,35℃退火1 min,72℃延伸90 s,共5个循环;94℃变性1 min,60℃退火1 min,72℃延伸1 min,共30个循环;72℃延伸10 min,4℃保存。扩增结束后,取10 μL扩增产物于12%的非变性的聚丙烯酰胺凝胶上电泳。电泳结束后用硝酸银染色并照相。
1.3数据统计与分析
对PCR扩增产物的电泳图谱进行位点统计,在相近迁移位置上以有条带的记为1,无条带的记为0,形成原始数据。应用POPGENE(version 1.31)[12]软件统计分析表征遗传多样性和种群遗传结构的参数:平均每个位点的观察等位基因数(Na,Observed number of alleles)、平均每个位点的有效等位基因有效数目(Ne,Effective number of alleles)、多态位点百分率(PPB,Percentage of polymorphic bands)、Shannon多样性指数(I)、Nei基因多样性指数(h) 及基因流(Nm)。并运用MEAG4软件进[13]行UPGMA聚类分析种群间的遗传关系;使用WINAMOVA(version 1.55)[14]进行分子方差分析,计算遗传变异在居群间和居群内的分布及显著水平及种群间的遗传分化和种群间的遗传距离;应用SPSS17.0软件对五角枫遗传多样性指数与地理梯度进行相关性分析。
2 结果与分析
2.1SRAP标记多态性及五角枫种群遗传多样性
11对引物共扩增产生扩增条带88条,其中多态性条带86.8条,多态性条带比率为98.6% 。从SRAP扩增条带的数量来看, 每对引物组合扩增出的总带数在3~13之间,平均7.8条。各引物组合获得的总带数见表3,由表可以看出引物组合Me2/Em7扩增的条带数最多,上游引物Me2最多,下游引物Em8最多(图1和表3)。

图1 引物Me2/Em7的SRAP-PCR部分扩增电泳图
应用POPGENE(version 1.31)[12]软件统计分析表征遗传多样性和种群遗传结构的参数,各项多样性指数(表4)表明:观察等位基因总数(Na)变动范围为1.5568~1.8636,有效等位基因数(Ne)介于1.3387~1.5448之间;Nei基因多样性指数(h)在0.1996~0.3163之间,平均为0.2373;Shannon多样性指数(I)范围为0.2995~0.4693,平均为0.3535五角枫种群多态位点百分率(PPB)在55.68%~86.36%之间波动,在物种水平上为98.86%,表明霍山五角枫种群具有较高的遗传多样性。
在遗传多样性的各项指标中,均以种群4为最高(Na=1.8636、Ne=1.5448、h=0.3163、I=0.4693、PPB=86.36%),种群5为最低(Na=1.5568、Ne=1.3387、h=0.2008、I=0.3000、PPB=55.65%),五角枫种群的遗传多样性从低到高依次为:5<2<1<3<4。
通过与土壤因子的相关性分析发现(表5),五角枫的各个遗传多样性指数与土壤因子之间及海拔因子均无显著或极显著相关,说明五角枫的遗传多样性及其遗传结够主要受自身遗传因素或是其它环境因子的影响。
2.2 遗传结构
ANOVA分析表明(表6):种群间的遗传变异占总遗传的21%,种群内的占总遗传变异的79%,说明五角枫的遗传变异主要来源是种群内。
各种群间的遗传距离从0.0588到0.5027;遗传一致度从0.6049到0.9429(表7)。种群3和5之间的亲缘关系最近,遗传一致度最高;种群1和5之间的亲缘关系最远,遗传一致度最低。根据种群间的遗传距离进行UPGMA聚类分析(图2),5个种群形成明显的2支:种群1、2和4聚为一支,种群3和5聚为一支。
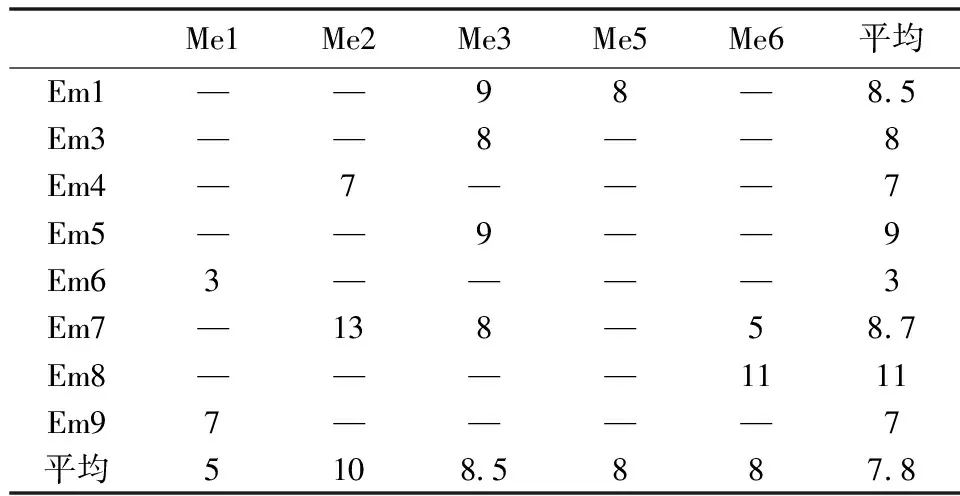
表3 SRAP引物组合及其扩增的多态性条带数
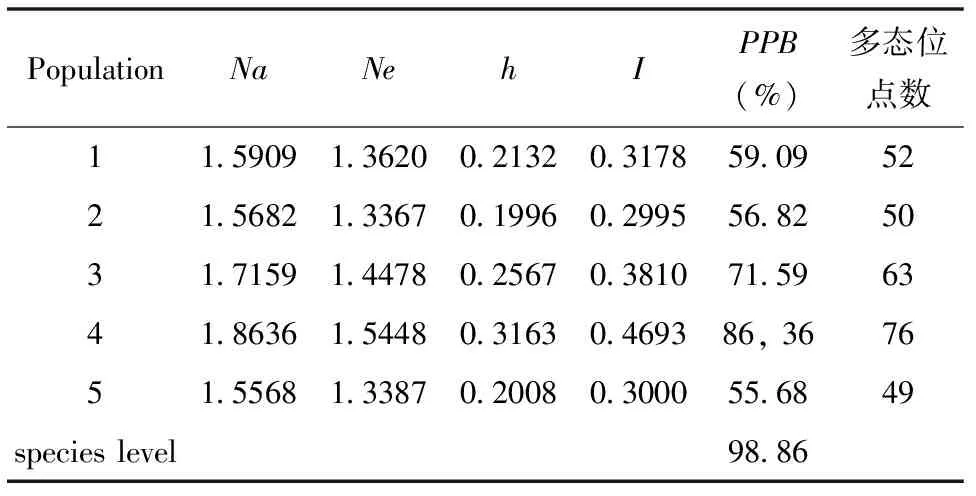
表4 五角枫种群的遗传多样性指数
Na—等位基因总数;Ne—有效等位基因数;h—Nei基因多样性指数;I—Shannon多样性指数;PPB—多态位点百分率。
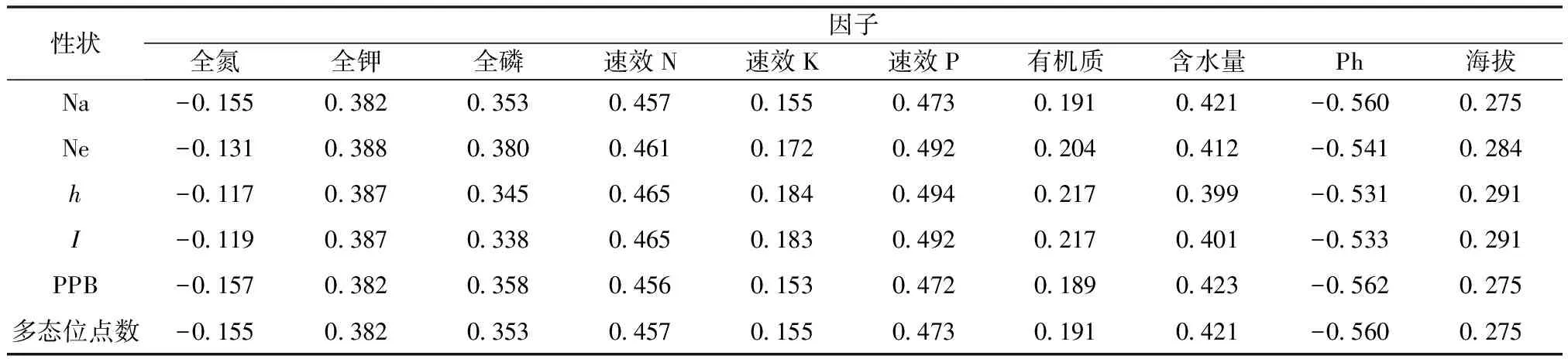
表5 各遗传多样性指数与地理因子间的相关系数
“*”表示在0.05水平上相关达到显著;“**”表示在0.01水平上相关达到显著。
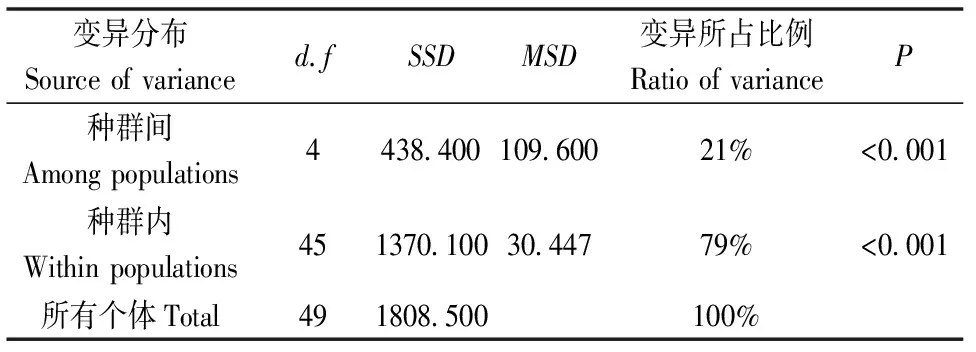
表6 五角枫种群的遗传结构(ANOVA分析)
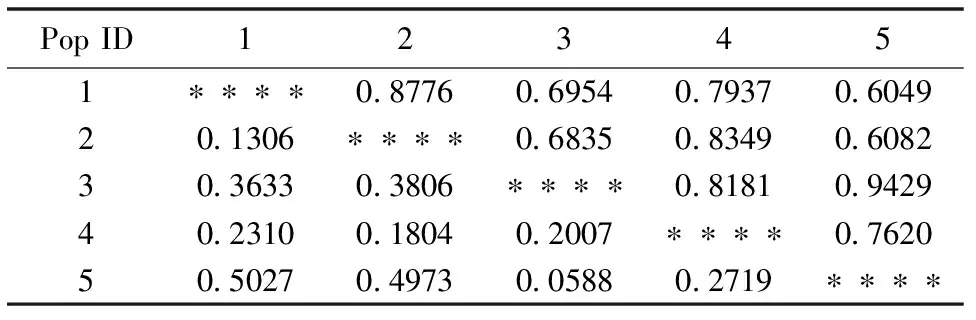
表7 五角枫种群基于Nei 指数的遗传距离(对角线下方)和遗传一致度(对角线上方)
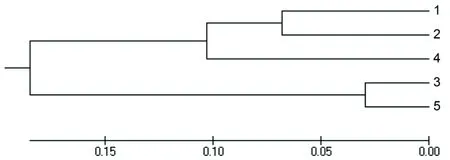
图2五角枫种群间的遗传距离聚类图
Fig 2 Dendrogram ofAcermonomaxim
populations based on genetic distance
3 讨论
3.1 五角枫种群的遗传多样性
五角枫种群存在着较高的遗传多样性,其多态位点百分率为98.86%,低于用ISSR茶条槭种群的多态位点百分率(100%)[15],但高于用RAPD标记检测该属其他植物(庙台槭:53.13%;金钱槭:92.97%)[16-17]的多态位点百分率。
物种的遗传多样性不仅是长期进化的结果,也是各种生境因子综合作用的结果。植物类群的分类地位、分布范围、生活史特征、繁育系统、种子扩散机制、分布地区和演替阶段对种群遗传分化都有明显影响,而其中的繁育系统、分布范围和生活史特征对种群遗传多样性的影响最大[18]。五角枫为广泛分布、异交且种子随风传播或鸟兽取食的木本植物,其种群内的遗传多样性比种群间的更丰富[19]。
在以往的研究中发现,不同植物的遗传多样性与海拔之间均有一定的相关性[20]。本文中,虽然遗传多样性指数与海拔没有显著或极显著相关,但其遗传多样性指数与海拔呈现出一定的正相关,随着海拔的升高,五角枫的遗传多样性随之加大,但海拔升高到一定程度(2000 m),其遗传多样性开始下降。这是因为,随着海拔的升高,生存环境恶劣、基因流动困难,而且海拔升高后,温度也随之下降,影响到植物的生活史,从而影响植物的花期、传粉等可引起遗传多样性变化的因素[21]。因而,五角枫的遗传多样性在海拔2000 m以下时不断随海拔的升高而增加,而到海拔2200 m时又开始下降。同时,野外调查发现,由于低海拔地区受人为因素影响,植被被砍伐等致使其种群变小,随之其遗传多样性降低。
3.2 五角枫种群的遗传结构
AMOVA分子变异分析表明,在五角枫种群总的遗传变异中,有21%来自于种群间,大于濒危植物翅果油树的种群间分化(16.79%)[21],小于同属植物茶条槭的种间分化(36%)[15],小于三叶悬钩子的种间分化(33.03%)[22]。
植物种群的遗传结构不仅决定于自身遗传基础、繁育系统及其起源进化进程,而且还受到自然选择、遗传漂变和基因流等因素的影响[18]。虽然五角枫种群群的遗传变异主要存在于种群内,但种群群间仍然产生了一定的遗传分化(21%)(表6,图2)。五角枫表现这样的遗传结构主要原因是:随着海拔的升高,气候和植被等也呈现明显的垂直变化,不同海拔居群所处生境的温度、光照等生态因子存在显著差异,致使不同海拔种群微生境存在差异,最终导致种群间发生遗传分化[20]。
另一个影响种群遗传结构的主要因素是基因流。 五角枫的基因流(Nm)为0.8094,这个数值低于一般广泛分布植物的基因流(Nm=1.881)[23], 揭示出五角枫不同海拔之间有限的基因流。高水平的、稳定的基因流可以防止种群间的遗传分化[22],不同种群微生境的差异阻碍了花粉和种子的有效传播,从而导致五角枫种群间的基因交流受限,产生分化。
参考文献:
[1]郑万钧. 中国树木志(第4卷)[M]. 北京:中国林业出版社,2004,4258-4260.
[2]李广祥. 色木槭、拧劲槭生长分析及生长阶段划分初探 [J]. 吉林林业科技,2009,38 (5) : 26-28.
[3]顾地周,丛小力,姜云天,等. 色木槭天然次生林种群结构竞争关系研究 [J]. 植物研究,2012 ,32 (1) : 105-109.
[4]殷东升,葛文志,张凤海,等. 色木槭次生林种群结构动态分析 [J]. 林业科技,2011,36 (6) : 19-22.
[5]Li G,Quiros C F. Sequence-related amplified polymorphism (SRAP),a new marker system based on a simple PCR reaction: its application to mapping and gene tagging in Brassica [J]. Theoretical and Applied Genetics, 2001,103 : 455-461.
[6]谭江平,曾秀丽,廖明安. 西藏光核桃自然居群遗传多样性的SRAP分析 [J].草业学报,2012,21 (6) : 213-220.
[7]李楠,柳新红,李因刚, 等. 白花树天然群体的遗传多样性 [J]. 林业科学,2012,48 (11) : 49-56.
[8]马秀杰,王冠明,韩烈保. 不同产地麦冬遗传多样性的SRAP分析 [J].草业科学,2012,29 (11) : 1686-1691.
[9]谢文刚,张宝艺,张新全,等. 鸭茅杂交种SRAP分子标记鉴定及遗传分析 [J]. 中国农业科学,2010,43 (16) : 3288-3295.
[10]姬志峰,高亚卉,李乐,等. 山西霍山五角枫不同海拔种群的表型多样性分析 [J]. 园艺学报,2012, 39 (11) : 2217-2228 .
[11]Doyle J J,Doyle J L. A rapid DNA isolation procedure for small qualities of fresh leaf material [J]. Phytochem Bull, 1987,19 (1) : 11-15.
[12]Yeh F C,Yang R C,Boyle T. POPGENG,the user friendly shareware for population genetic analysis[M]. Molecular Biology and Biotechnology Center. University of Alberta,Edmonton,Canada. 1997.
[13]Tamura K,Dudley J,Nei M,et al. MEAG4: molecular evolutionary genetics analysis (MEGA) software version 4.0 [J]. Mol Biol Ivol, 2007,(24) : 1596-1599.
[14]Excoffier L,Smouse P E,Quattro J M. Analysis of molecular variance inferred from metric distance among DNA haplotype applications to human mitochondrial DNA restriction data [J]. Genetics,1992,131: 479-491.
[15]闫女,王丹,王祎玲,等. 七里峪不同海拔茶条槭种群的遗传多样性 [J]. 林业科学,2010,46 (10) : 50-56.
[16]李珊. 用RAPD标记检测庙台槭自然居群的遗传结构和遗传分化 [D]. 西安: 西北大学, 2001.
[17]李珊. 金钱槭属植物保护遗传学与分子亲缘地理学研究 [D]. 西安: 西北大学, 2004.
[18]Bradley J,Peterson,Eric Bricker,et al. Genetic diversity and gene flow in Zostera marina populations surrounding Long Island, New York, USA: No evidence of inbreeding, Genetic degradation or population isolation [J]. Aquatic Botany, 2013, 110 (10) : 61-66.
[19]Hamrick J L,Godt M J W ,Sherman-Broyes S L. Factors influencing levels of genetic diversity in woody plant species [J]. New forests,1992, 6 (14) : 95-124.
[20]Ohsawa T,Ide Y. Global patterns of genetic variation in plant species along vertical and horizontal gradients on mountains [J]. Global Ecology and Biogeography, 2008, 17 : 152-163.
[21]秦泳燕,王祎玲,张钦弟,等. 濒危植物翅果油树种群的遗传多样性和遗传分化研究 [J]. 武汉植物学研究,2010,28 (4) : 466-472.
[22]和志娇,和加卫,程在全,等. 三叶悬钩子自然居群遗传多样性的ISSR分析 [J]. 园艺学报,2012,39 (11) : 2142-2150.
[23]Star B,Spencer H G. Effects of genetic drift and gene flow on the selective maintenance of genetic variation [J]. Genetics, 2013, 194 (1) : 235-244.
