宁波市城区内河肠道病原细菌定量PCR分析
2014-03-25杨雪玲张秋芳周阳靖程军蕊郑琦宏徐继荣
杨雪玲, 张秋芳, 陈 瑶, 周阳靖, 程军蕊, 郑琦宏, 徐继荣
(宁波大学 建筑工程与环境学院, 浙江 宁波 315211)
城市内河是城市生态系统的重要组成部分,随着宁波市工业化和城市化进程的加速,城市人口不断增加,大量工业、生活污水排入,加之内河河网位于水系末端, 入江闸门经常关闭, 河道内水流基本凝滞, 极易造成水质恶化, 主要城区内河河网水质较差,大多数为Ⅳ~劣Ⅴ类[1-4]。许多疾病如:伤寒、霍乱和腹泻等疾病皆可由水域中的致病细菌传播引起,威胁着人类的健康[5-6]。处于严重富营养化状态的宁波市城区内河,极易造成痢疾杆菌、霍乱弧菌、沙门氏菌和大肠杆菌等各种病原菌的滋生和传播。
由于采用埃希氏大肠杆菌作为粪便污染的指示生物传统方法,虽然简单、直观和廉价但并未完全包括了与其它与水域传染疾病关系密切的志贺氏痢疾杆菌、霍乱弧菌和沙门氏菌等病原菌,应用传统的培养基检测方法已无法为水体安全性评价提供可靠依据。最近,美国环境保护部(USEPA)已将实时荧光定量PCR(qPCR)方法做为一种可供选择的快速检测方法用于娱乐用水区域的水体质量管理。[7]。定量PCR方法已应用于城市河流病原菌检测[6]。因此,具快速、高特异性及灵敏等特点的qPCR方法,已经成为检测环境中病原菌含量的一种有效方法[5, 8]。刘永军等[9-11]设计的病原菌特异引物已成功地应用于检测水体中的病原菌,为定量分析水环境中病原菌含量提供了重要方法。
本研究拟采集宁波市内河不同点位水体,应用定量PCR方法结合常规水质分析,分析城区内河水体病原菌含量现状及其与水质指标之间的相关性,以期为城市内河水体病原菌的评价和监控提供一种快速而准确的方法。
1 材料与方法
1.1 样品采集和处理

1.2 主要水质指标分析
碘量法测定溶解氧(DO)含量(GB7489-89);高锰酸盐法分析(CODMn)(GB11892-89);碱性过硫酸钾消解紫外分光光度法测定总氮(TN)含量(GB11894-89);纳氏试剂比色法分析氨氮(NH4+-N)含量(GB7479-87);钼酸铵分光光度法分析总磷(TP)含量(GB11893-89);叶绿素a方法参照《水和废水监测分析方法》。
1.3 定量PCR检测方法
1.3.1 样品总DNA提取
参照Winter等[12]方法,取300 mL新鲜水体,经0.22 μm亲水滤膜(GVWP04700, Millipore, USA)进行抽真空过滤,将滤纸用酒精灯消毒后的剪刀剪碎后,应用FastDNA Spin Kit for Soil (Qbiogene, Carlsbad, CA, USA)试剂盒,具体提取方法按照说明书并略加修改,核酸提取仪(Qbiogene公司, 美国)均质条件为18 s,4.5 m s-1,将获得的总DNA用70 μL DES溶液收集,并用NanoDrop-1000 超微量紫外分光光度计(Thermo Scientific,USA)进行含量和纯度测定后,储存于-20°C下备用。
1.3.2 定量PCR分析
1)标准曲线制备
采用刘永军等[9]等设计的引物,即根据细菌16S rRNA基因的高度保守性,针对志贺氏痢疾杆菌(Shigelladysenteriae),霍乱弧菌(Vibriocholerae),沙门氏菌(Salmonellatyphrmurium)和埃希氏大肠杆菌(Escherichiacoli) 4种病原菌设计的强特异性通用引物。病原菌引物正向序列为:5′-AAGGCGACGATCCCTAGCTGGTCTGAGAGGATGAC-3′(240-280 bp,E.coli16S rRNA)和反向序列:5′-GCTTGCCAGTATCAGATGCAGTTCCCAGGTTGAGC-3′(521-556 bp,E.coli16S rRNA)[9]。在50 μL PCR扩增反应体系里包含:1×PCR缓冲液(Fermentas, Canada), MgCl2为3.0 mM, 每种dNTP为400 μM (Fermentas, Canada), 2.5 U Taq DNA 聚合酶 (Fermentas, Canada), 0.2 mg mL-1牛血清蛋白 (BSA),加入每个引物浓度至0.2 mM, 最后加入1μL水体总基因组DNA溶液作为模板。PCR反应程序,参照刘永军等方法[9]并略加修改:94°C 5 min, 接着30个循环为:变性94°C 30 s,退火55°C 30 s,延伸72°C 30 s,最后72°C 5 min,并用灭菌双蒸水代替DNA模板设为阴性对照。用1.2%(W/V)琼脂糖凝胶加核酸染料染色检查PCR扩增产物,用凝胶成像系统(Bio-Rad,USA)成像,拍照,片段大小为380 bp左右。
PCR产物经1.2%琼脂糖凝胶电泳分析PCR产物回收纯化后,再用PMD19-T (TaKaRa, 大连宝生)载体进行链接后,转化到感受态细胞EscherichiacoliDH5α,涂布到含有氨苄青霉素/IPTG/X-Gal的LB培养基平板上,37℃下培养16 h,并设置对照。随机选取一定数量的白色阳性克隆子,经液体培养后送至公司进行序列测定(上海英骏公司)。将测定的目的基因片段序列,在Genebank中与已知序列比对(http://www.ncbi.nlm.nih.gov/BLAST/)。
取上述一已知序列病原菌基因的质粒作为定量PCR的标准DNA模板,质粒提取使用MiniBEST Plasmid Purification Kit(TaKaRa, Japan)试剂盒依照生产商说明的方法提取,将提取到的质粒用超微量核酸蛋白质分析仪(Nanodrop)检测其含量和纯度,用10倍梯度稀释已知拷贝数基因片段作为模板,共设7个浓度,从1.47 × 103到1.47 × 109拷贝数μL-1。
2)定量 PCR反应体系及程序
应用1.3.2中引物[9]对病原菌进行定量分析。定量PCR反应在ABI 7500实时荧光定量PCR分析仪(Applied Biosystems, USA)中进行。反应体系为25 μL,其中包含1 μL模板DNA,12.5 μL FastStart Universal SYBR Green Master (Rox) (Roche, Switzerland),引物各200 mM,0.2 mg/mL BSA反应在200 μL平顶定量PCR管中进行。反应条件:50°C 2 min, 95°C 10 min, 接着40个循环为:95°C 15 s,55°C 10 min,于82°C进行荧光信号收集。为检测定量PCR产物的特异性,用1.2%琼脂凝胶电泳检测,观察到基因片段约为320 bp,无明显二聚体。试验过程中皆设不加DNA模板的阴性对照。DNA提取物的抑制物对定量PCR影响的分析测定结果表明,提取物中可能存在的杂质对定量PCR反应没有抑制作用。
1.4 统计分析
应用SPSS 软件(16.0 版),采用Duncan法进行不同点位间水质指标单因素差异分析(ANOVA),采用皮尔逊相关(Pearson Correlation)分析病原菌基因含量与水质指标之间的相关性。
2 结果与分析
2.1 水质指标
主要水质指标分析结果如表1所示。可知,宁波市城区不同内河水质有所差异。根据《地表水环境质量标准》[3],所采集水样的水质指标中,祖关山河和南北河的DO含量显著地高于苏家河、后西河、史魏家河和直落河,且苏家河、后西河、史魏家河和直落河的DO皆属于劣Ⅴ类;所有供试内河的总氮、氨氮和总磷也都属于劣Ⅴ类。后西河、史魏家河和直落河的总氮、氨氮、总磷和电导率皆明显地高于祖关山河、南北河和苏家河。苏家河的电导率、总氮、氨氮、浊度、总磷和CODMn的值皆低于其它河流。另外,后西河的透明度最高,而直落河的最低;后西河和直落河的温度最高;pH值都在6~9之间;后西河叶绿素a含量最高,其次是史魏家河,而祖关山河和南北河的较低。
由此可见,宁波市区主要内河皆处于严重富营养化状态,这可能由于宁波市内河河网位于水系末端, 入江闸门经常关闭, 河道内水流基本凝滞,极易造成水质恶化而导致城区河网水质基本属于Ⅳ~劣Ⅴ类[4, 14]。从表1中还可以看出,由于生活污水长期直接排入,使得属于典型城中村区域的史魏家河等水体质量特别差,DO含量最低,总氮、氨氮和浊度等含量也高,这些因素都可能为河道病原菌的滋生提供良好的环境,应属于需要重点监控的区域。
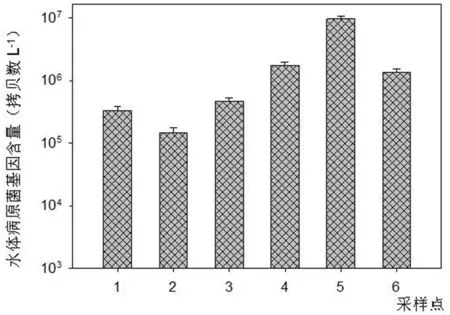
图1 宁波市内河病原菌基因含量
其中:1、2、3、4、5和6分别表示祖关山河、苏家河、南北河、后西河、史魏家河和直落河采样点。

表1 宁波城区主要内河主要水体指标
a—平均值(n=3); 同一列字母相同差异不显著;P<0.05时差异达显著水平,用小写字母表示。
2.2 水体肠道菌基因定量PCR分析
用于制作定量PCR分析的标准曲线各参数为:扩增效率在96.3%,相关性指数R2为0.998,斜率为-3.41,这些标准曲线各参数指标皆满足定量PCR分析的要求[15-16]。
从图1可知,各采样点每升水体的病原菌基因的拷贝数分别为:祖关山河3.34 × 105,苏家河1.47 × 105,南北河4.68 × 105,后西河1.75 × 106,史魏家河9.65 × 10和直落河1.33 × 106。史魏家河含量显著高于其它供试河流,其次是后西河和直落河,而祖关山河、南北河和苏家河较低,且三者之间无显著差异。
根据刘永军等[10-11]应用滤膜过滤法(MF)和定量PCR法对黑河水体的肠杆菌数量分析比较表明,通用引物定量PCR方法检测水体肠杆菌基因的含量所获得的检测值是传统MF法所得的大肠杆菌菌落数量的5倍,且两者呈显著正相关关系。因此,根据本试验应用定量PCR方法所获得的宁波城区各供试内河肠杆菌基因的拷贝数,可将其换算为大肠杆菌菌落数分别为:祖关山河67000个/L,苏家河29400个/L,南北河93000个/L,后西河350000个/L,史魏家河1930000个/L和直落河266000个/L。根据地表水环境质量标准中规定,除苏家河的大肠杆菌含量为29400个/L小于Ⅴ类地表水粪大肠菌群标准限值小于40000个/L外,其它的河流地表水粪大肠菌群皆大于40000个/L,属于劣Ⅴ类水质范围。而从表2水质指标分析可知,本次供试验内河水体多属于劣Ⅴ类,因此,本研究应用定量PCR方法所获得的病原菌基因的含量经换算成大肠杆菌的量后用于评价水质与主要水体理化指标所得的结论相接近。
但是,研究中提取的水体总DNA包括了死细胞在内的所有细胞,因此,应用定量PCR方法所测得的病原菌含量可能与水体中具生命力的病原菌数量有所偏差。同时,微生物多样性具有地域性特点,且不同水质环境中4种病原菌的比例及具体种类可能也不相同[17]。因此,在进行水体病原菌定量PCR检测时,还必须同时与传统滤膜培养法相结合,进行综合考虑,分析和计算出水体中病原菌的数量与种类及其与生长环境因子相关的模型[18],并建立地区病原菌相应的基因库,才能对水环境中的病原菌进行实时监测和预测提供更可靠依据[7, 16],这也是有待于今后进一步研究的内容。
2.3 水体肠道菌含量与水质指标相关性分析
内河水体中肠道病原菌含量与水质指标相关性分析可得:肠道病原菌含量分别与内河水体溶氧量呈显著负相关(r=-0.611,n=18,p=0.007< 0.01);与内河水体总氮(r=0.626,n=18,p=0.005< 0.01)、氨氮(r=0.706,n=18,p=0.001< 0.01)、浊度(r=0.662,n=18,p=0.003< 0.01)、总磷(r=0.559,n=18,p=0.016< 0.05)、CODMn(r=0.577,n=18,p=0.012< 0.05)、叶绿素a(r=0.494,n=18,p=0.037< 0.05)含量和电导率(r=0.632,n=18,p=0.005< 0.01)呈显著正相关;与水体透明度(r=-0.065,n=18,p=0.799>0.05)、温度(r=0.245,n=18,p=0.327>0.05)和酸碱度(r=-0.396,n=18,p=0.104>0.05)无明显相关。由于水体为微生物的生长和繁殖提供了重要的物质基础和基本环境条件,因此水体中环境因子是影响病原菌存在的重要因素[18]。研究表明了内河中的肠道菌含量与水体中的溶解氧、总氮、氨氮、浊度、总磷、高锰酸盐指数、叶绿素和电导率等因子密切相关,但并未受水体透明度、温度和酸碱度的影响。
3 结论
本研究说明qPCR方法是水体病原菌的检测的一种有效的方法,由于传统的滤膜过滤法(MF)无法检测到与水域传染疾病关系密切的志贺氏痢疾杆菌、霍乱弧菌、沙门氏菌等病原菌,因此,qPCR方法是传统滤膜过滤培养方法的一个重要补充,两种方法相结合可望为宁波市城区内河水体病原菌安全性评价提供了一个快速而全面的检测技术体系,为确保城市内河生态安全提供了一个重要依据。
参考文献:
[1]史建静. 宁波市城市内河配水研究[J]. 浙江水利科技, 2006, (4): 54-55.
[2]李立山, 洪 文. 宁波市内河水环境治理与保护措施研究[J].波工程学院学报, 2005, 17(2): 57-58, 86.
[3]郑琦宏, 沈浩, 李立山, 等. 宁波市城区内河水质与沉积物污染特征研究[J]. 宁波大学学报:理工版, 2012, 25(3): 109-113.
[4]Harwood V J, Staley C, Badgley B D, et al. Microbial source tracking markers for detection of fecal contamination in environmental waters: relationships between pathogens and human health outcomes [J]. FEMS Microbiology Reviews, 2014, 38(1): 1-40.
[5]de Man H, van den Berg H H J L, Leenen E J T M, et al. Quantitative assessment of infection risk from exposure to waterborne pathogens in urban floodwater [J]. Water Research, 2014, 48: 90-99.
[6]Gonzalez R A, Noble R T. Comparisons of statistical models to predict fecal indicator bacteria concentrations enumerated by qPCR-and culture-based methods [J]. Water Research, 2014, 48: 296-305.
[7]Agarwal M, Tomar R S, Jyoti A. Detection of water-borne pathogenic bacteria: where molecular methods rule [J]. International Journal of Multidisciplinary and Current Research, 2014, (2): 351-358.
[8]刘永军, 张崇淼, 王晓昌, 等.通用引物 PCR 方法在地表水病原菌检测中的应用[J]. 环境科学研究, 2007, 20(2): 89-93.
[9]刘永军,张崇淼,王晓昌, 等. 环境水体中肠道病原细菌的定量PCR检测[J]. 环境科学, 2008, 29(5): 1175-1180.
[10]国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法 [M]. (4版).北京:中国环境科学出版社, 2002.
[11]刘永军, 张崇淼, 王晓昌, 等.环境水体中肠道病原细菌定量PCR检测与膜过滤分析方法的比较 [J]. 环境科学学报, 2008, 28(7):1482-1488.
[12]Winter C, Hein T, Kavka G, et al. Longitudinal changes in the bacterial community composition of the Danube River: a whole-river approach [J]. Appl Environ Microbiol, 2007, 73(2): 421-431.
[13]GB 3838-2002. 地表水环境质量标准 [S]. 中华人民共和国国家标准, 2002.
[14]宁波市水利局. 2011年宁波市水资源公报[R].2012年3月.
[15]Brinkman N E,Haugland R A,Wymer L J,et al. Evaluation of a rapid, quantitative real-time PCR method for cellular enumeration ofpathogenicCandidaspecies in water [J]. Appl Environ Microbiol, 2003, 69(3): 1775-1782.
[16]Haugland R A, Siefring S C, Wymer L J, et al. Comparison ofEnterococcusmeasurements in freshwater at two recreational beaches by quantitative polymerase chain reaction and membrane filter culture analysis [J]. Water Research, 2005, 39(4): 559-568.
[17]张崇淼, 王晓昌, 周进宏, 等. 城市地表水中肠道病原微生物与粪便污染指示菌的关系研究[J]. 环境科学学报, 2012, 32(11): 2789-2794.
[18]Staley C, Reckhow K H, Lukasik J, et al. Assessment of sources of human pathogens and fecal contamination in a Florida freshwater lake [J]. Water Research, 2012, 46(17): 5799-5812.
