PPVS-1A株保存期研究及免疫原性测定
2014-03-25张婉华朱永军张春玲何锡忠彭丽英
张婉华,朱永军,张春玲,何锡忠,彭丽英
(上海市农业科学院畜牧兽医研究所,上海佳牧生物制品有限公司,上海 201106)
根据《兽药注册办法》和农业部442号、683公告精神[1~3],兽用生物制品制造所用种毒应经过系统的鉴定,具有良好的免疫原性的繁殖特性,并具有明确的生物学特性和鉴别特性等。疫苗生产所用种毒,不仅直接影响到疫苗的质量,而且关系到人畜的健康与安全,只有经过检验合格的种毒,才可用于生产兽用生物制品。
猪细小病毒(Porcine parvovirus,PPV)是引起母猪繁殖障碍的主要病因之一,可引起母猪尤其是初产母猪的繁殖障碍,表现为母猪受胎率降低,产活仔数减少和(或)出现死胎、木乃伊胎等[4]。目前预防该病的主要措施是疫苗预防接种。猪细小病毒病活疫苗具有良好的安全性和免疫效果,为了确保疫苗的质量,生产用种毒的稳定性至关重要,本试验对PPVS-1A株湿毒和冻干毒在-20℃和-70℃经不同时间保存后,对其进行了病毒含量、血凝价、安全性和免疫原性的检测。
1 材料与方法
1.1 ST细胞
由上海市农业科学院畜牧兽医研究所提供。
1.2 血清与培养基
新生牛血清和MEM粉,均由美国GIBCO公司生产。
1.3 试验动物
2~4日龄健康乳鼠(每窝不少于5只,带母鼠饲养)、300~500 g健康青年豚鼠(HI抗体效价≤1∶8),均购自中国科学院上海实验动物中心。
1.4 病毒含量测定
用细胞营养液将病毒液作10倍系列稀释,取10-4、10-5、10-6、10-7、 10-8、10-9等6个稀释度,分别接种长势良好的ST细胞(96孔细胞培养板),每个稀释度接种4孔,每孔0.1 mL,同时设细胞阴性对照孔。接种后,置37℃、含5%CO2培养箱培养7 d,观察细胞病变(CPE),出现CPE者判为感染,计算TCID50。样品TCID50应基本保持稳定,无明显变化。
1.5 HA和HI试验
参照文献[5]。样品的HA、HI应基本保持稳定,无明显变化。
1.6 种毒的安全检验
每一样品接种乳鼠一窝,皮下注射0.1 mL,观察7 d,记录乳鼠健活情况。乳鼠接种后应不出现种毒注射导致的不良反应。
1.7 种毒的免疫原性试验
每一样品接种豚鼠5只,每只肌肉注射0.1 mL,同时设对照组,接种后21 d,全部采血,检测猪细小病毒HI抗体效价。接种豚鼠后至少4只HI抗体不低于1∶32,对照组HI抗体应全部不高于1∶8。
1.8 病毒
猪细小病毒PPVS-1A F10湿毒和冻干毒,由上海市农业科学院畜牧兽医研究所提供。PPVS-1A F10湿毒和冻干毒分别放置在-20℃和-70℃保存,每12个月取样一次,每一样品测定TCID50、HA,并将每一样品接种乳鼠和豚鼠,观察种毒的安全性和免疫原性。
2 结果与分析
2.1 PPVS-1A株湿毒的保存期及免疫原性试验
由表1可见,在-20℃保存24个月和-70℃保存48个月,每一样品其病毒含量在107.25~107.75,HA血凝价在1∶1024;乳鼠安全检验均健活,未见不良反应;豚鼠抗体检测时,HI均不低于1∶32。而-20℃保存36个月和-70℃保存60个月,HA血凝价或豚鼠抗体效价检测有所下降。
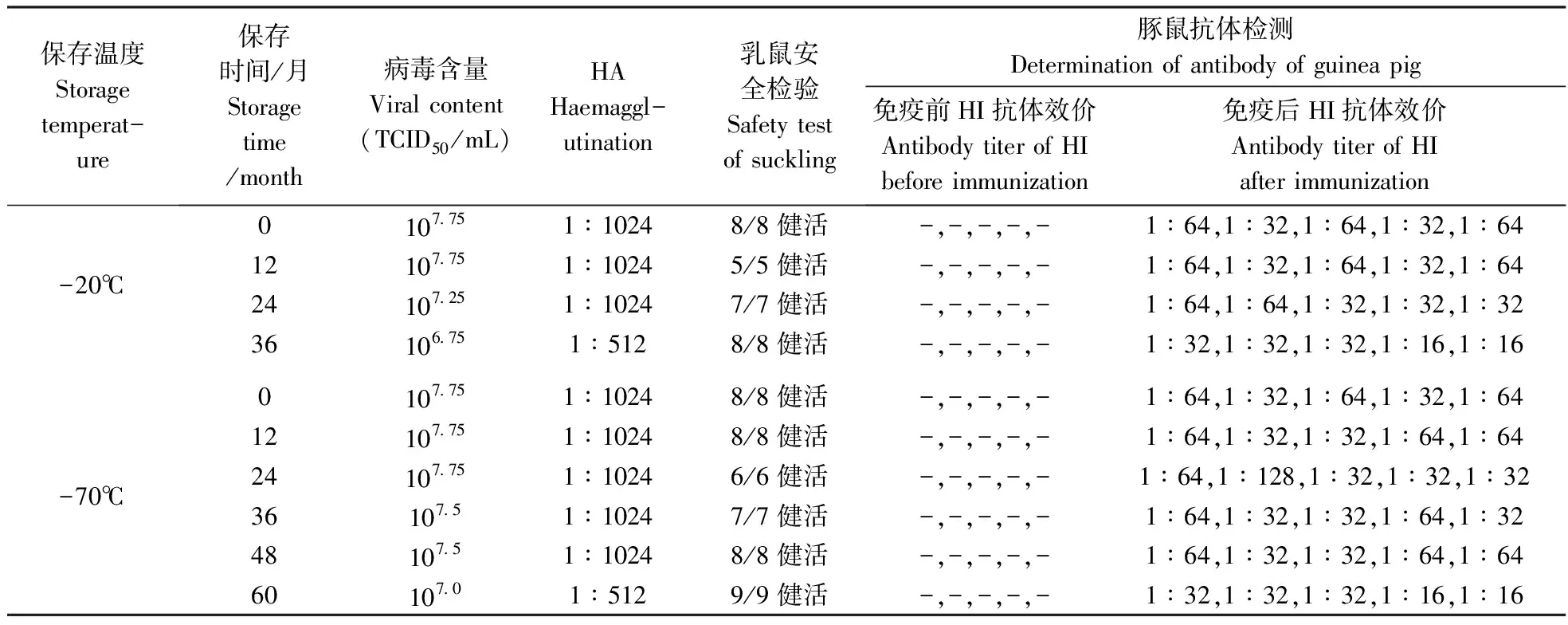
表1 PPVS-1A 株湿毒在不同温度下保存的测定结果
注:“-”表示HI抗体效价≤1∶8,表2同。
Note:“-” indicates antibody titer of HI ≤1∶8.The same as table 2.
2.2 PPVS-1A株冻干毒的保存期及免疫原性试验
由表2可见,在-20℃保存36个月和-70℃保存60个月,每一样品其病毒含量和红细胞凝集价均无明显变化,病毒含量在107.25~107.75,HA血凝价1∶1024;乳鼠安全检验均健活,未见不良反应;豚鼠抗体检测时,HI均不低于1∶32。而-20℃保存48个月和-70℃保存72个月,HA血凝价或豚鼠抗体效价检测有所下降。
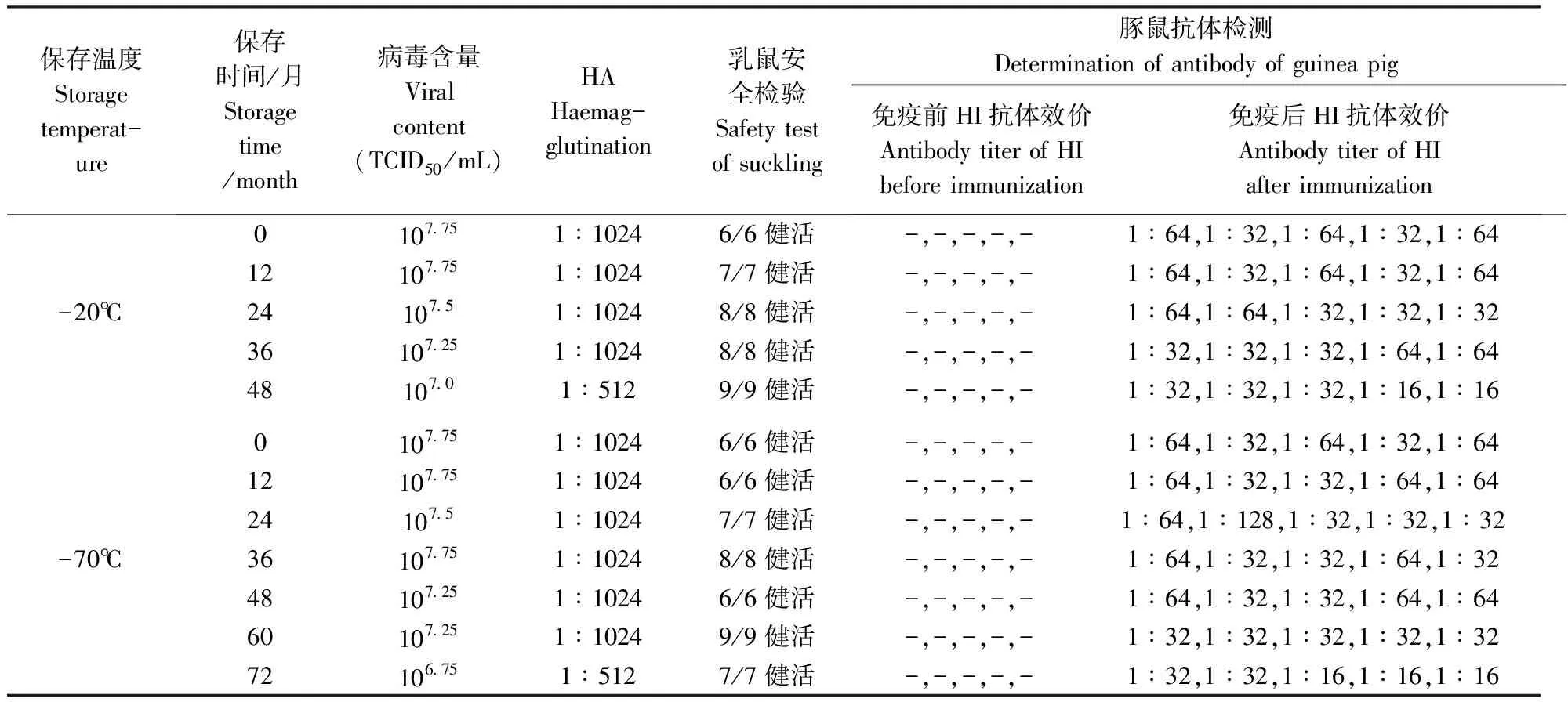
表2 PPVS-1A 株冻干毒在不同温度下保存的测定结果
3 结论与讨论
为了防治动物疾病,促进养殖业的健康发展,维护人体健康,农业部加强了兽用生物制品的管理,于2004年11月农业部发布了第44号令《兽药注册办法》[3],2004年12月农业部发布了第442号公告《兽用生物制品注册分类及注册资料要求》,2006年6月发布了683号公告《兽用生物制品试验研究技术指导原则》,对兽用生物制品所用的菌种有明确的要求,根据公告要求,本试验进行了种毒保存期试验,从源头上保障猪细小病毒病疫苗的产品质量。
猪细小病毒病活疫苗生产用种毒PPVS-1A株湿毒在-20℃保存24个月、冻干毒保存36个月,湿毒在-70℃保存48个月、冻干毒保存60个月,病毒含量均大于107.25,HA血凝价在1∶1024;乳鼠接种未见不良反应;豚鼠抗体检测HI均不低于1∶32。PPVS-1A株的病毒含量、血凝价、毒力及免疫原性均比较稳定,为疫苗的生产质量奠定了良好的基础。
猪细小病毒用本动物——猪做效力试验,价格昂贵,并需要一定的隔离饲养条件,费时费力,用实验动物豚鼠替代猪,作为本试验的效力检验,取得了理想的效果,且豚鼠作为猪细小病毒效力检验的实验动物已得到证实[6,7]。作为生物制品研究与生产的重要原材料,种毒无论在新兽药证书申报材料中还是对已有产品的GMP车间验收中都作为一项重要指标[8]。本研究证明猪细小病毒病活疫苗生产用种毒PPVS-1A株,具有良好的安全性和免疫原性,可用于疫苗制备。
参 考 文 献
[1]中华人民共和国农业部.兽用生物制品试验研究技术指导原则[S].中华人民共和国农业部公告第683号,2006.
[2]中华人民共和国农业部.兽用生物制品注册分类及注册资料要求[S].中华人民共和国农业部公告第442号,2004.
[3]中华人民共和国农业部.兽药注册办法[S].中华人民共和国农业部令第44号,2004.
[4]殷震,刘景华.动物病毒学(第2版)[M].北京:科学出版社,1997:1150-1158.
[5]张婉华,邹勇,朱永军,等.猪细小病毒HA、HI微量法试验的优化[J].中国兽药杂志,2013,47(2):21-23.
[6]张婉华,叶向阳,徐平,等.用豚鼠效检猪细小病毒病油乳剂灭活疫苗判断标准的初步研究[J].上海农业学报,2004,20(1):120-122.
[7]盘宝进,白安斌,姚瑞英,等.豚鼠对猪细小病毒弱毒苗抗体反应的研究[J].中国预防兽医学报,2002,24(6):467-470.
[8]中华人民共和国农业部畜牧兽医局.兽药生产质量管理规范培训指南[M].北京:中国农业出版社,2002:413.
