牛呼吸道疾病综合征相关病毒BVDV、BPIV3、IBRV和BRSV多重PCR检测方法的建立
2014-03-24郭利王炜张淑琴孙娜王凤雪武华
郭利,王炜,张淑琴,孙娜,王凤雪,武华
(中国农业科学院特产研究所省部共建特种动物分子生物学重点实验室,长春130112)
随着我国进出口贸易和养牛业的快速发展,牛系统性疾病时有发生且危害严重。研究表明,牛呼吸道疾病综合征(Bovine respiratorydisease complex,BRDC)是由于牛生产运输和早期断奶造成的主要系统性疾病之一,由多个致病因子或病原包括应激、病毒和细菌的共同作用引起[1,2],其中病毒的潜在感染是造成该病的重要原因之一,也是导致牛呼吸道疾病的启动器。在牛呼吸道疾病中分离出的病毒主要包括牛传染性鼻气管炎病毒(IBRV)、牛呼吸道合胞体病毒(BRSV)、牛病毒性腹泻病毒(BVDV)和牛副流感3型病毒(BPIV3)。这些病毒常常形成持续性感染,严重影响架子牛生长及奶牛的产奶量和牛奶的质量。BRDC相关病毒中曾在水貂、雪貂分离到IBRV。雪貂、家兔、新生臭鼬可被人工感染,雪貂与兔可产生与牛相似的症状。BVDV还可感染鹿等特种经济动物。本研究着重对BRDC相关病毒进行了多重PCR方法的建立及采集的临床样本检测研究。目前,对BRDC相关病毒的检测采用国家标准规定的血清中和试验方法以及多联PCR方法[3]。由于BRDC存在潜伏感染和长期排毒,血清中和试验方法操作复杂且费时费力,进口试剂价格昂贵,检测成本较高,并且局限在实验室操作,很难实现推广和应用;多联PCR方法对BRDC相关病毒的检测灵敏、经济简便,更适合推广应用。目前多联PCR方法在检测时主要是针对BRSV、BVDV和BPIV3建立的PCR检测方法[4~6],由于IBRV基因组的GC含量高达72%,对PCR反应的试剂及条件要求苛刻,同时,GC的高含量给同一体系同时检测牛呼吸道疾病综合征的4种病原带来极大困难,而临床往往会发生同时感染的情况。本研究旨在建立一种能同时检测牛呼吸道疾病综合征的4种病原的多重PCR检测技术。
1 材料
1.1 病毒和细胞
IBRV LN01/08强毒株、BVDV毒株、BPIV3毒株、MDBK细胞(中国农业科学院特产研究所人兽共患病研究室保存);BRSV病毒(华威特北京生物技术有限公司惠赠)。
1.2 主要试剂和仪器
MEM和DMEM培养基(GIBCO公司);马血清和胎牛血清(Hyclone公司);TPCK处理胰酶(Sigma公司);DNA提取试剂盒、胶回收试剂盒(AXYGEN公司);DNA聚合酶(宝生物科技有限公司);反转录试剂盒(invotrizen生物技术公司)。引物由上海英潍捷基贸易有限公司合成。分析软件DNAStar。PCR反应仪(Bio-BAD公司)。
1.3 样品来源
采自安徽、吉林、辽宁和内蒙古4个省、自治区临床样品33份,其中,鼻拭子17份、血清5份、血液11份。
2 方法
2.1 引物的设计与合成
根据GenBank上登录的IBRV gB基因全序列(登录号:AJ004801)、BRSV N基因、BVDV 5′-UTR和BPIV3 N基因序列,利用Oligo 6.0软件设计了4对特异性引物。引物序列如表1。
表1引物序列
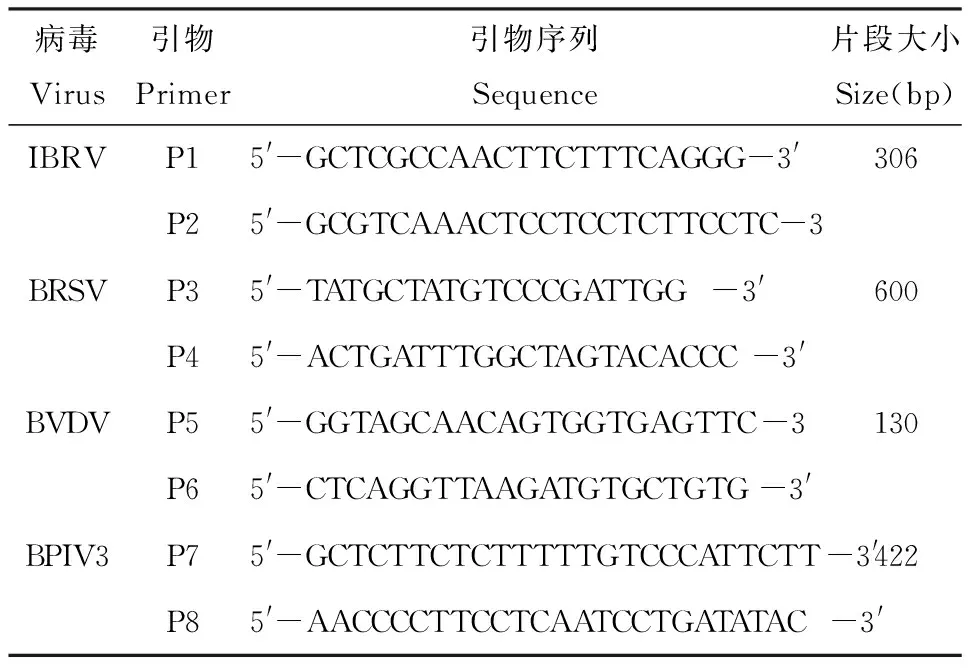
Table 1 Primer
2.2 细胞培养和病毒增殖
MDBK细胞用含8%胎牛血清的DMEM培养液培养和传代,待细胞长成单层后,用于病毒接种。取-70℃保存的BPIV3、BVDV及IBRV,接种单层MDBK细胞进行培养,待90%细胞产生明显细胞病变(CPE)时收获。反复冻融3次,收获病毒。
2.3 病毒总RNA的提取
分别吸取反复冻融的BRSV、BPIV3和BVDV病毒液500μL,Trizol法提取病毒总RNA,反转录后-20℃保存备用。
2.4 病毒DNA提取
取反复冻融的IBRV病毒液500μL,煮沸10min,8 000r/min离心5min,取上清液留存备用。
2.5 PCR引物的特异性及反应条件优化
2.5.1IBRV、BVDV、BRSV及BPIV3(RT)PCR反应条件的建立分别用IBRV、BVDV、BRSV及BPIV3模板和对应引物对进行PCR反应,总体系为:25μL,即DNA聚合酶0.5μL,2×Buffer 12.5μL,上、下游引物各0.5μL,模板2μL,补充灭菌双蒸水至25μL。PCR条件:98℃ 2min;98℃ 10s,57℃~60℃ 15s,68℃ 1min,30个循环,68℃总延伸10min。
2.5.2引物的特异性反应总系为25μL,即DNA聚合酶0.5μL,2×Buffer 12.5μL,引物对1μL,DNA模板2μL,补充灭菌双蒸水至25μL。PCR条件:98℃ 2min;98℃ 10s,57℃ 15s,68℃ 1min,30个循环,68℃延伸10min。扩增产物1%琼脂糖凝胶电泳,凝胶成像系统检测。反应体系中模板和引物见表2。
表2引物及模板
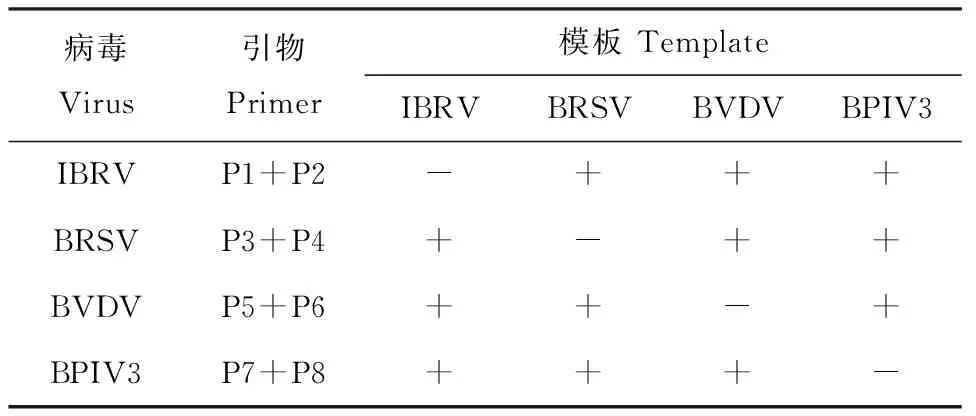
Table 2 Primer and template
注:+.体系中含有的模板;-.体系中不含的模板
Note:+.shows template positive;-.shows template negative
2.6 PCR敏感性鉴定
分别以不同浓度的IBRV、BRSV、BVDV和BPIV3阳性对照重组质粒为模板,进行多重PCR检测试剂盒的敏感性实验,其中,IBRV、BRSV、BVDV和BPIV3阳性对照重组质粒的检测浓度分别为10ng/μL~1.0pg/μL、10ng/μL~100pg/μL、10ng/μL~10pg/μL、10ng/μL~10pg/μL。
2.7 多重PCR检测方法的建立
建立IBRV PCR检测方法后,在反应体系中加入BIPV3模板和引物后,优化反应条件,建立BIPV3+IBRV 2重PCR方法;在此基础上同理建立BIPV3+IBRV+BRSV 3重PCR方法及BIPV3+IBRV+BRSV+BVDV多重PCR检测方法。多重PCR反应体系为25μL。即DNA聚合酶0.5μL,2×Buffer 12.5μL,引物P1~P8各0.5μL,反转录模板1.5μL,病毒DNA模板0.5μL,补充灭菌双蒸水至25μL。PCR条件:98℃ 2min;98℃ 10s,57℃ 15s,68℃ 1min,30个循环,68℃延伸10min。扩增产物1%琼脂糖凝胶电泳,凝胶成像系统检测。
2.8 PCR产物的测序分析
将PCR产物连接到pMD18-T载体上,再转化到DH5α大肠杆菌感受态细胞中,得到重组菌,提取质粒进行PCR鉴定后阳性菌液测序。
2.9 多重PCR方法临床样品检测
来自临床的33份样品,提取总RNA后反转录和提取DNA共同作为模板进行多重PCR检测。
3 结果
3.1 PCR引物的特异性鉴定
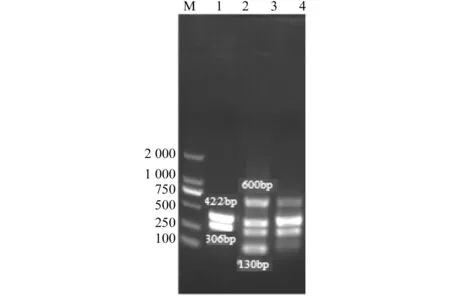
分别以IBRV、BRSV、BVDV和BPIV3阳性对照重组质粒、组织提取物以及阴性对照(蒸馏水)为模板,进行多重PCR检测引物的特异性。结果出现对应的306bp、600bp、130bp和422bp条带,所有的阴性对照均未扩增出任何条带;3种混合后的样品加非特异引物则出现特异性引物相对应的条带,阴性对照(蒸馏水)则未扩增出任何条带。见图1和图2。
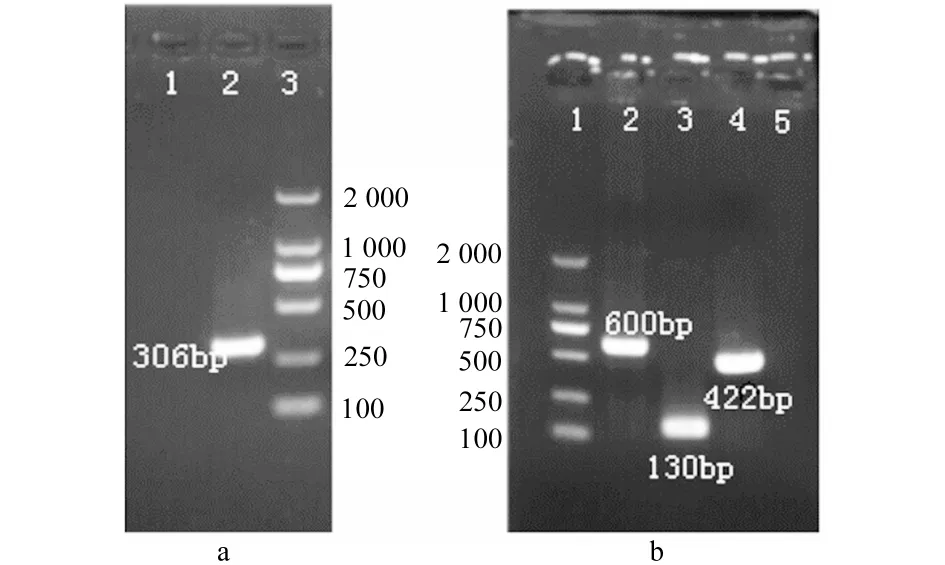
1-a.IBRV PCR扩增结果;1-b.BRSV、BVDV、BPIV3 RT-PCR结果;M.DL2 000Marker
1-a.IBRV;1-b.BRSV,BVDV,BPIV3;M.DL2 000Marke
图1IBRV、BVDV、BPIV3和BRSVPCR结果
Fig.1PCRresultsofIBRV,BVDV,BPIV3andBRSV
3.2 PCR引物检测的敏感性实验
分别以不同浓度的IBRV、BRSV、BVDV和BPIV3阳性对照重组质粒为模板,进行多重PCR检测的敏感性实验。实验结果显示,IBRV、BRSV、BVDV和BPIV3阳性对照重组质粒最低检测浓度分别为1.0pg/μL、100pg/μL、10pg/μL、10pg/μL,见图3。
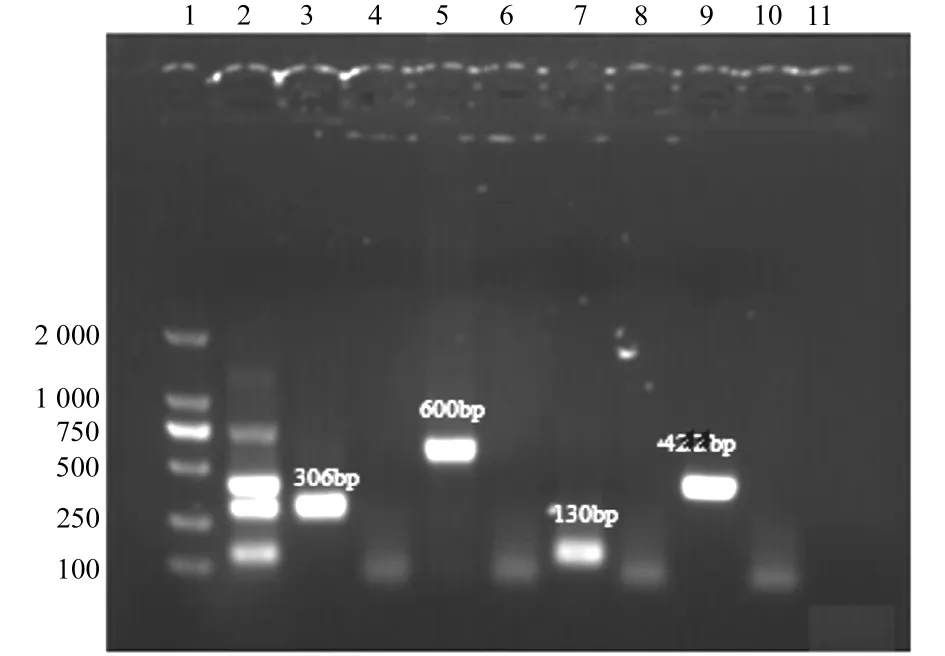
1.DNA MARker2 000;2.IBRV、BRSV、BVDV和BPIV3混合模板及对应引物多重PCR检测结果;3.IBRV阳性对照;4.IBRV引物及BRSV、BVDV和BPIV3混合模板PCR检测结果;5.BRSV阳性对照;6.BRSV引物及IBRV、BVDV和BPIV3混合模板PCR检测结果;7.BVDV阳性对照;8.BVDV引物及IBRV、BRSV和BPIV3混合模板PCR检测结果;9.BPIV3阳性对照;10.BPIV3引物及IBRV、BVDV和BRSV混合模板PCR检测结果;11.蒸馏水对照
1.DNA MARker2 000;2.multiplex PCR result of IBRV、BRSV、BVDV and BPIV3;3.IBRV positive control;4.BRSV、BVDV and BPIV3 templates with IBRV primer;5.BRSV positive control;6.IBRV,BVDV and BPIV3 templates with BRSV primer;7.BVDV positive control;8.BRSV,IBRV and BPIV3 templates with BVDV primer;9.BPIV3 positive control;10.BRSV,IBRV and BVDV templates with BPIV3 primer;11.negative control
图2引物特异性检测结果
Fig.2Specificitytestresult
3.3 多重PCR检测方法的建立
同一体系中同时加入IBRV、BRSV、BVDV及BPIV3 4种模板及对应引物,经反应条件优化,建立了2重、3重及多重PCR检测方法。结果见图4。
3.4 多重PCR方法临床样品检测结果
利用本研究建立的多重PCR检测方法检测33例临床样品结果表明,合并感染2种病毒较为多见,分别为BVDV和BRSV共感染、BPIV3和BRSV共感染、BPIV3和IBRV共感染。3种以上病毒混合感染未见(图5)。
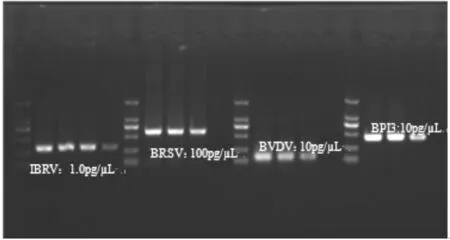
图3 多重PCR引物检测的敏感性实验结果
M.MarkerDL2 000;1.IBRV和BPIV3 2重PCR检测结果;2.IBRV、BRSV、BVDV和BPIV3多重PCR检测结果;3.IBRV、BRSV和BPIV3 3重PCR检测结果
M.MarkerDL2 000;1.Duplex PCR result of IBRV and BPIV3;2.multiplex PCR result of IBRV,BRSV,BVDV and BPIV3;3.triplex PCR result of IBRV,BRSV and BPIV3
图4多重PCR检测结果
Fig.4MultiplexPCRresult
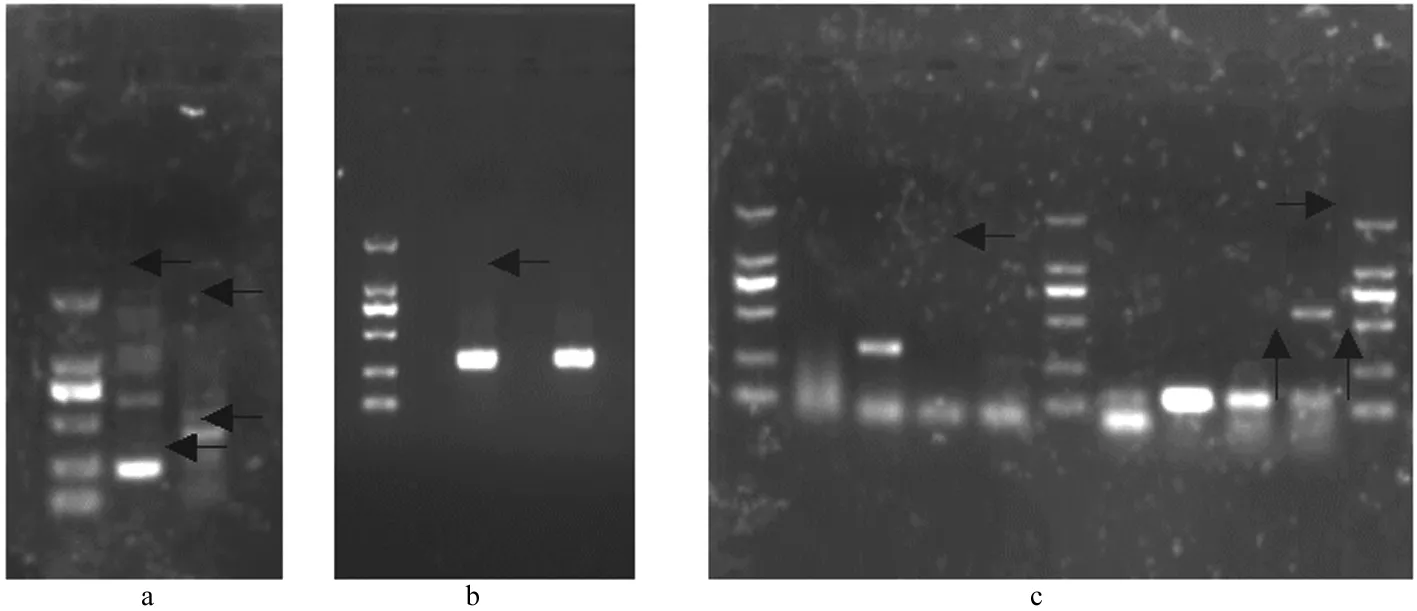
a.BVDV和BRSV混合感染、BPIV3和IBRV混合感染;b.IBRV单纯感染;c.IBRV单纯感染,BVDV单纯感染,BRSV与BVDV混合感染a.BVDV and BRSV mixed infection,BPIV3 and IBRV mixed infection;b.IBRV infection;c.IBRV infection,BVDV infection,BRSV and BVDV mixed infection
4 讨论
牛呼吸道疾病综合征是与牛呼吸道疾病相关的最严重的疾病。通过检测可知,临床上BVDV、BPIV3、BRSV和IBRV共感染现象最常见。所以快速、特异性检测对确定疾病的病原体和控制疾病的发生十分关键。目前有很多分子检测方法用于检测病毒,然而,大多数的方法是检测单一病原的PCR或实时定量PCR,而且对研究设备的要求更高[7,8];多重PCR比常规PCR具有明显的优越性,如更高的敏感性、特异性和高通量的检测,更重要的是,其检测快速且对设备要求较低,可应用于普通实验室。本试验设计4对引物用于4种病毒序列的扩增,对反应的特异性和敏感性要求更高。虽然RNA病毒是高度可变的,但病毒基因组的保守区域均可以在BRSV、BPIV3和BVDV病毒基因组中发现;IBRV病毒属DNA病毒,基因组相对稳定,变异性小。实验对每个引物的特异性进行了验证,它可以检测4种病毒中的每个病原体,与其他病毒均无交叉反应,确保了多重PCR方法的准确性。
国内、外学者建立了BPIV3和BVDV 2重,BVDV、BRSV和BPIV3 3重PCR检测方法[9]。BRSV、BPIV3和BVDV 3种病毒均为RNA病毒,并且基因组中GC含量在均一水平,给同一体系内同时鉴定提供了便利条件。由于IBRV是DNA病毒,其基因组GC含量高达72%,远高于其它3种病毒,给PCR鉴定带来一定的困难。在本研究中,通过条件的优化和反应试剂的筛选,成功建立了同一反应体系同时检测IBRV、BVDV、BPIV3和BRSV 4种病毒的多重PCR检测方法,克服了基因组本身对反应条件的影响,突破了IBRV不能同时与BVDV、BPIV3和BRSV 3种病毒在同一体系内反应的技术瓶颈,该方法在爆发牛呼吸道疾病时临床快速检测与BRDC流行病学研究具有实际意义。
[1]Shirvani E,Lotfi M,Kamalzadeh M,et al.Seroepidemiological study of bovine respiratory viruses(BRSV,BoHV-1,PI-3V,BVDV,and BAV-3) in dairy cattle in central region of Iran(Esfahan province)[J].Trop Anim Health Prod,2012,44(1):191-195.
[2]Griffin D.,Chengappa MM,Kuszak J,et al.Bacterial pathogens of the bovine respiratory disease complex[J].Vet Clin North Am Food Anim Pract,2010,26(2):381-394.
[3]Chen HT,Zhang J,Sun DH,et al.Rapid discrimination of H5 and H9 subtypes of avian influenza viruses and Newcastle disease virus by multiplex RT-PCR[J].Vet Res Commun,2008,32(6):491-498.
[4]Bao HF,Li D,Guo JH,et al.A highly sensitive and specific multiplex RT-PCR to detect foot-and-mouth disease virus in tissue and food samples[J].Arch Virol,2008,153(1):205-209.
[5]Lai YL,Chung YK,Tan HC,et al.Cost-effective real-time reverse transcriptase PCR(RT-PCR) to screen for Dengue virus followed by rapid single-tube multiplex RT-PCR for serotyping of the virus[J].J Clin Microbiol,2007,45(3):935-941.
[6]Balamurugan V,Sen A,Saravanan P,et al.,One-step multiplex RT-PCR assay for the detection of peste des petits ruminants virus in clinical samples[J].Vet Res Commun,2006,30(6):655-666.
[7]Willoughby K.,Thomson K,Maley M,et al.,Development of a real time reverse transcriptase polymerase chain reaction for the detection of bovine respiratory syncytial virus in clinical samples and its comparison with immunohistochemistry and immunofluorescence antibody testing[J].Vet Microbiol,2008,126(1-3):264-270.
[8]Horwood,PF,TJ.Mahony.Multiplex real-time RT-PCR detection of three viruses associated with the bovine respiratory disease complex[J].J Virol Methods,2011,171(2):360-363.
[9]刘晓乐,张明敏,郭爱珍,等.BPIV3和BVDV双重RT-PCR快速检测方法的建立[J].动物医学进展,2011,32(11):1-5.
