急性淋巴细胞白血病病儿微小残留病动态监测及意义
2014-03-22,,,,,
,,,,,
(青岛大学医学院附属医院小儿血液科,山东 青岛 266003)
微小残留病(MRD) 的动态监测已经作为个体化治疗的依据被纳入急性淋巴细胞白血病(ALL)的治疗方案[1]。MRD的动态监测亦成为评价ALL病儿预后的重要方法之一。大量临床研究已证实,化疗过程中MRD水平均与病儿的复发风险和生存期密不可分[2]。2006年8月—2010年5月,在本院按2004方案[3]诊治ALL病儿75例,本研究总结其MRD结果并进行分析,探讨其对预后评估的价值。
1 对象和方法
1.1 研究对象
取我科诊治资料齐全的ALL病儿75例,男44例,女31例;年龄1~14岁,其中1~9岁63例,≥10岁12例。免疫分型示B细胞型66例(含有My+-B细胞型12例),T细胞型8例(含有My+-T细胞型1例),未确定者1例。骨髓细胞形态学示L1型35例,L2型39例,未确定细胞形态学分型1例。融合基因阳性17例,阴性53例,未检测者5例。临床分型低危组33例,中危组18例,高危组24例。
1.2 研究方法
1.2.1MRD的监测 MRD的标记是依据病儿初次就诊时白血病免疫分型进行个体化选择,采用流式细胞仪进行检测。T细胞型ALL的MRD检测采用的免疫标记组合主要是CD45、CD2、CD3和CD7或CD34;B细胞型ALL采用的免疫标记组合主要是CD45CD19CD10、CD45CD34CD20、CD45-CD19CD20、CD45CD34CD10等。本研究选取化疗过程中7个时间点监测MRD,即诱导缓解第19天、33天及3个月、6个月、12个月、2年、3年。
1.2.2疗效评价 无事件生存(EFS)期定义为自确诊到第1次事件发生(白血病复发或死亡)或随访截止日所经历的时间。删失数据定义为随访研究中,在规定观察期内,对某些观察对象由于某种原因未能观察到死亡结果,不知道确切的生存时间。
1.3 统计学处理
采用SPSS 17.0软件进行统计学处理。5年生存率、生存曲线采用Kaplan-Meier方法进行分析;各组间生存率的整体比较采用Log-Rank检验,以P<0.05为差异有显著性;多种影响因素采用COX比例风险回归模型进行分析。
2 结 果
2.1 诱导缓解治疗第19天、33天MRD对ALL病儿EFS率的影响
本文75例ALL病儿诱导缓解治疗第19天,有50例监测MRD水平,A组(MRD≤10-4)16例,B组(MRD介于A组与C组间)17例,C组(MRD≥10-2)17例,3组5年EFS率分别为(93.8±6.1)%、(30.3±22.4)%、(17.6±9.2)%;经Log-Rank检验,诱导缓解第19天A组病儿EFS率明显高于其他两组(χ2=6.435、19.795,P<0.05)。见图1。第33天64例监测MRD,A组15例,B组30例,C组19例,5年EFS率分别为(84.8±10.0)%、(68.4±8.9)%、(33.7±11.8)%;经Log-Rank检验,诱导缓解第33天C组病儿的EFS率显著低于A、B组,差异均有显著性(χ2=5.057、8.346,P<0.05)。见图2。

图1 诱导缓解第19天不同MRD对ALL病儿EFS率的影响
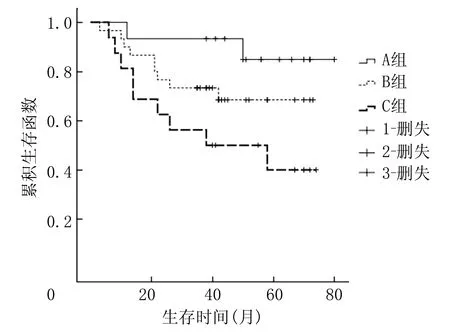
图2 诱导缓解第33天不同MRD对ALL病儿EFS率的影响
2.2 维持治疗期MRD对ALL病儿生存率影响
维持治疗期第3、6个月C组病儿生存率显著低于A组(χ2=7.029、7.229,P<0.05);化疗12个月、2年C组病儿生存率均显著低于A组和B组(χ2=4.320~11.458,P<0.05);化疗3年时MRD的水平对生存率无影响(P>0.05)。见表1。
2.3 维持治疗期不同时间点MRD≥10-2的ALL病儿EFS率的变化
根据维持治疗过程中按MRD≥10-2出现在不同时间点分为3组:半年内出现组25例(Ⅰ组)、半年到1年出现组11例(Ⅱ组)、1年后出现组14例(Ⅲ组),经Log-Rank检验,Ⅰ组与Ⅱ组的5年EFS率比较差异无显著性(P>0.05),Ⅲ组5年EFS率高于Ⅰ、Ⅱ组(χ2=6.226、7.018,P<0.05)。见表2。
2.4 治疗1年内出现MRD≥10-2的ALL病儿不同临床分型、免疫分型及融合基因生存率的比较
维持治疗期1年内出现MRD≥10-2的ALL病儿,临床分型为高危组、免疫分型为T细胞型、融合基因阳性的5年生存率显著降低,差异均有显著意义(χ2=5.661~10.682,P<0.05)。见表2。
2.5 预后独立因素分析
诱导缓解治疗第19天MRD水平是影响病儿预后的独立危险因素(95%CI=0.968 1~8.995,P<0.05,RR=4.01)。治疗1年内出现MRD≥10-2病儿,高危组死亡风险是非高危组的4.73倍(95%CI=1.316~14.624,P<0.05);T细胞型的死亡风险是B细胞系的1.78倍(95%CI=0.101~6.014,P<0.05);基因阳性的死亡风险是基因阴性的0.08倍(95%CI=0.008~0.801,P<0.05)。见表3。
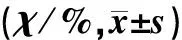
表1 维持治疗期不同时间MRD水平对ALL病儿生存率的影响

表2 维持治疗中MRD≥10-2病儿5年EFS率及Log-Rank检验结果
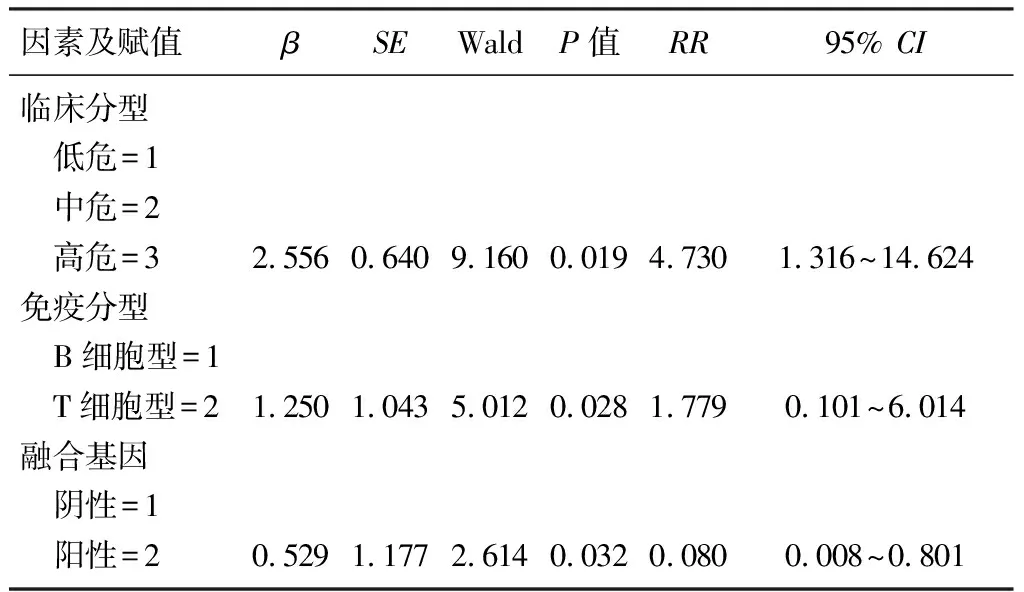
表3 MRD≥10-2出现在治疗1年内病儿COX回归分析结果
3 讨 论
近年来, 联合化疗方案的进展与实施使ALL的5年EFS率达到80% 以上,但仍不能避免20%的病儿最终复发[4]。复发已成为儿童血液肿瘤疾病研究中的一个严峻挑战,复发的根源是化疗缓解后体内残存的微量白血病细胞即MRD[5]。目前临床上,监测MRD水平已广泛应用于ALL的分层治疗。已有大量临床研究显示,动态监测MRD在儿童ALL疗效判断和调整化疗强度方面具有重要价值[6]。国际著名儿童白血病研究中心资料已证实,在ALL病儿治疗的过程中MRD高水平与预后高度相关,MRD是重要的、独立的预后指标[7]。
本研究结果显示,在治疗过程中不同时间点、不同MRD水平,病儿的生存率不同,MRD水平越高,生存期越短。此结果与国内外多中心研究结果一致。MRD高水平出现在不同时间点对病儿的预后影响不同[8],但国内对此研究报道不多。本研究就MRD≥10-2出现在不同时间点进行研究,结果显示,病儿在维持治疗1年内出现MRD≥10-2的生存率显著低于出现在1年后。因此,我们认为ALL病儿在治疗1年内MRD水平对生存期的影响比较大,且MRD的监测并不一定局限于某一个时间点,尤其在治疗1年内应进行动态监测,以便于及时调整化疗方案,提高病儿生存期。
本文的研究结果显示,治疗1年时MRD≥10-2的病儿5年EFS率最低,此结果与近几年国外研究结果有一定的差异。我们认为可能存在以下原因。①MRD监测方法的差异:目前适用于监测MRD的方法有聚合酶链反应和流式细胞术,这两种检测方法都有优点和局限性。我院采用流式细胞仪术检测MRD,通过选取初诊时检测的免疫标记的抗原表达来测定残存的白血病细胞数,其不足之处是用于MRD检测的抗原表达在病儿治疗过程中可能会发生变化,从而造成检测结果的假阴性[9]。MRD检测方法不同和技术上的差异可能对研究结果造成一定影响。②化疗方案的差异:不同的化疗方案在具体用药上有所差异,需要更进一步规范化疗方案。③MRD在不同阶段治疗的标准水平不同:CAMPANA[10]研究表明,在治疗过程中任何一个时间点MRD≥10-2的病儿具有较高的复发风险。④治疗依从性差:病儿家庭经济困难,拖延化疗时间,病儿治疗达不到预期效果。总之,我们认为每个单位检测MRD的精确度不同,故将其应用于临床并指导治疗时应谨慎处理,标准化MRD监测体系的建立将会对儿童白血病复发的预防起重要作用。
王安丽等[11]研究认为,动态监测骨髓原始+幼稚淋巴细胞比例变化对病儿的个体化治疗有临床指导意义。本研究结果示,诱导治疗第19天时MRD水平是影响病儿预后的独立危险因素;1年内出现MRD≥10-2且为高危组、T细胞型及融合基因阳性这些危险因素对病儿生存期的影响更大。在上述情况下,提示体内残留白血病细胞数量较高,且这些残留肿瘤细胞往往具有耐药性[12]。我们认为此时需要结合临床情况及时、准确地调整化疗方案,实施个体化治疗,降低病儿复发风险,进一步提高病儿生存期。对于调整化疗方案后MRD水平变化与长期生存期的关系尚有待于下一步的研究。
综上所述,我们认为在ALL病儿整个治疗过程中动态监测MRD可以为临床更加准确地评估早期治疗反应、预测复发、及时调整治疗方案提供依据,从而可以进一步提高临床治疗水平,延长病儿的生存期,降低复发风险。标准化MRD监测体系的建立将成为未来一项重要的任务。
[参考文献]
[1] IRWIN M R. Human psychoneuroimmunology: 20 years of discovery[J]. Brain Behavior Immunity, 2008,22(2):129-139.
[2] CONTER V, BARTRAM C R, VALSECCHI M G, et al. Molecular response to treatment redefines all prognostic factors in children and adolescents with B-cell precursor acute lymphoblastic leukemia[J]. Blood, 2010,115(16):3206-3214.
[3] 顾龙君,卢新天,吴敏媛,等. 小儿急性淋巴细胞白血病诊疗建议(第三次修订草案)[J]. 中华儿科杂志, 2006,44(5):392-395.
[4] STANULLA M, SCHRAPPE M. Treatment of childhood acute lymphoblastic leukemia[J]. Semin Hematol, 2009,46(1):52-63.
[5] CAMPANA D. Molecular determinants of treatment response in acute lymphoblastic leukemia[J]. American Society of Hematology Education Program, 2008,10(2):366-373.
[6] 徐晓军,汤永民,宋华,等. 儿童急性淋巴细胞白血病微小残留病监测的预后意义[J]. 中华儿科杂志, 2010,48(3):180-185.
[7] KERST G, ROTH C, DIETZ K, et al. Concurrent detection of minimal residual disease in childhood acute lymphoblastic leukemia by flow cytometry and real-time PCR[J]. Br J Haematol, 2005,128(6):774-782.
[8] SEOKLEE M D,CAMPANA D. Role of minimal residual di-sease in adult and pediatric acute lymphoblastic leukemia[J]. Hematol Oncol Clin North Am, 2009,239(5):1083-1098.
[9] COUSTAN-SMITH E, CAMPANA D. Immunologic minimal residual disease detection in acute lymphoblastic leukemia: a comparative approach to molecular testing[J]. Best Pract Res Clin Haematol, 2010,23(3):347-358.
[10] CAMPANA D. Should minimal residual disease monitoring in acute lymphoblastic leukemia be standard of care?[J]. Curr Hematol Malig Rep, 2012,7(2):170-177.
[11] 王安丽,卢愿,孙秀芳,等. 儿童ALL治疗中骨髓细胞形态学动态监测及意义[J]. 齐鲁医学杂志, 2013,28(3):219-222.
[12] CHENG C, YANG W. Genome-wide interrogation of germline genetic variation associated with treatment response in childhood acute lymphoblastic leukemia[J]. The Journal of The American Medical Association, 2009,301(4):393-403.
