原生质体紫外诱变选育达托霉素高产菌株
2014-03-21段向东贾啸静陈丽华仲伟潭段宝玲
段向东,贾啸静,陈丽华,仲伟潭,段宝玲
(华北制药集团新药研究开发有限责任公司 微生物药物国家工程研究中心河北省微生物代谢工程技术研究中心,河北石家庄050015)
达托霉素(daptomycin)是玫瑰孢链霉菌(Streptomyces roseosporus)发酵产物脂肽类化合物A21978C的N-癸酰基衍生物,是环酯肽类新抗生素家族的第1个产品。1987年Lilly公司首先发现达托霉素具有良好的抗菌活性,1997年Cubist公司获得该药的开发权,2003年美国食品与药物管理局(FDA)批准注射用达托霉素上市。
达托霉素具有独特的化学结构,含有13个氨基酸,其中10个氨基酸形成环十脂肽,另外3个氨基酸肽链N-末端的色氨酸与1个癸酸侧链相连[1]。达托霉素的作用机制不同于其它抗生素,既可以扰乱细胞膜转运氨基酸,使细菌无法合成细胞壁的主要成分肽聚糖[2],也可以破坏细胞膜从而杀死细菌[3]。达托霉素能杀死绝大多数的革兰氏阳性菌,特别是对耐药菌如耐甲氧西林金黄色葡萄球菌、耐万古霉素肠球菌等有很强的活性[4],被认为是“病原菌最后一道防线——万古霉素”的最佳替代品。
原生质体由于去除了外壁障碍,因而对各种诱变剂敏感性较强,往往正突变率高[5],近年来原生质体诱变育种技术被广泛应用。王晓蕾等[6]通过紫外诱变筑波链霉菌原生质体,筛选得到1株高产菌株,与出发菌株相比,该菌株的他克莫司平均发酵单位提高51.4%。朱林东等[7]通过紫外诱变始旋链霉菌11-2原生质体,获得高产突变株ZP-07,普那霉素产量比出发菌株提高101.3%。而目前原生质体诱变选育达托霉素高产菌株尚未见报道。作者研究了达托霉素产生菌玫瑰孢链霉菌D-30原生质体制备及再生的最适条件,并采用紫外诱变方法处理制备的原生质体,以期筛选得到达托霉素的高产菌株。
1 实验
1.1 菌种
玫瑰孢链霉菌(Streptomyces roseosporus)D-30,华北制药集团研发中心保存。
1.2 培养基
分离培养基(g·L-1):葡萄糖20,酵母粉20,MgSO4·7H2O 1.5,K2HPO41,NaCl 0.5,琼脂15,pH值7.5。
种子培养基(g·L-1):葡萄糖5,糊精15,蛋白胨10,酵母粉10,MgSO4·7H2O 0.3,K2HPO40.2,甘氨酸适量,pH值7.5。
发酵培养基(g·L-1):葡萄糖7,可溶性淀粉15,酵母粉5,蛋白胨15,K2SO48,L-天冬氨酸0.5,pH值7.0。
微量元素、TES缓冲溶液、P液、再生培养基的配制参照《工业微生物实验技术手册》[8]。
1.3 原生质体的制备
在含有甘氨酸的种子培养基中接种新鲜玫瑰孢链霉菌D-30的斜面孢子,摇瓶培养温度28℃、摇床转速220r·min-1,培养一段时间后以3 000r·min-1离心收集菌丝体,用含有玻璃珠的三角瓶打碎、用P液以3 000r·min-1离心洗涤3次,加入一定浓度的溶菌酶溶液,涡旋混匀,在水浴温度32℃下进行酶解,每隔5min摇晃1次,当原生质体形成数量较多时停止,先以600r·min-1低速离心10min,取上清,去除混合液中的细胞壁和菌丝片断,再用P液以3 000r· min-1离心洗涤3次,将得到的原生质体转移到P液中备用。
1.4 原生质体的再生
将分离培养基和再生培养基灭菌后倒入无菌平皿中,待培养基凝固后打开平皿盖,在超净台上风干表面的水分。用酶解前的菌丝体涂布含有分离培养基的平板;用P液将原生质体稀释到一定浓度后涂布含有再生培养基的平板、用无菌水将原生质体稀释到一定浓度后涂布含有再生培养基的平板,将3种平板28℃恒温培养9d。
1.5 原生质体的制备率、再生率计算
原生质体的制备率、再生率按下列公式计算:
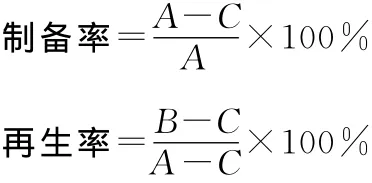
式中:A为用酶解前的菌丝体涂布分离培养基平板长出的菌落数;B为用P液将原生质体稀释到一定浓度后涂布再生培养基平板存活的菌落数;C为用无菌水将原生质体稀释到一定浓度后涂布再生培养基平板存活的菌落数。
1.6 原生质体紫外诱变
用P液将原生质体稀释到适当浓度后用吸管将其转到无菌平皿中,每皿100μL,轻轻晃动待其混匀后放置在30W紫外灯下32cm处,进行不同照射时间诱变处理:0s、10s、20s、30s、40s、50s、60s、70s;照射后于暗处静置30min,收集诱变后的原生质体,将其稀释到一定浓度后涂布在含有再生培养基的平板上。
1.7 发酵培养
挑选再生培养基平板上培养成熟的单菌落接种至空白斜面,于28℃恒温培养9d,待培养好后接种于种子培养基,摇瓶温度28℃、摇床转速220r·min-1,培养30h。吸取0.5mL培养好的种子液接种于发酵培养基,摇瓶温度28℃、摇床转速220r·min-1,培养120~144h后取发酵液测效价。
1.8 分析方法
采用HPLC法测定发酵液中达托霉素的产量。液相色谱条件:反向C18色谱柱;流动相为含0.1%三氟乙酸的乙腈-水(46∶54,体积比);流速1mL· min-1;检测波长220nm;柱温32℃;进样量15μL。
2 结果与讨论
2.1 种龄对原生质体形成的影响
不同种龄的菌丝经过处理后都可以制成原生质体,但原生质体制备率差异较大。一般对数生长期的菌丝利于原生质体的制备,原生质体的再生效果也比较好。分别采用种龄为24h、30h、36h、42h的菌丝制备原生质体,考察种龄对原生质体形成的影响,结果见表1。

表1 种龄对原生质体形成的影响Tab.1 Effect of seed age on protoplast formation
由表1可知,种龄为30h的菌丝原生质体释放量最大,此时菌丝处于对数生长期,菌体活力旺盛,利于原生质体的形成,制备的原生质体活性更强。因此,种龄为30h的菌丝宜于达托霉素产生菌原生质体的制备。
2.2 甘氨酸添加量对菌丝浓度及原生质体制备率的影响
考察甘氨酸添加量对菌丝浓度及原生质体制备率的影响,结果如图1所示。
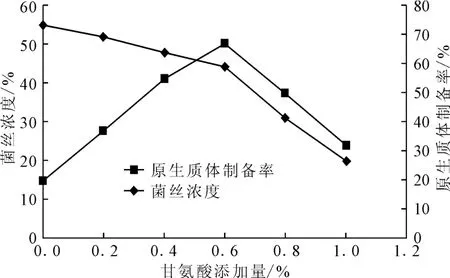
图1 甘氨酸添加量对菌丝浓度及原生质体制备率的影响Fig.1 Effects of glycine addition amount on cell concentration and protoplast preparation rate
链霉菌细胞壁的主要成分肽聚糖主要通过丙氨酸交联形成网状结构。如果在培养链霉菌种子时加入甘氨酸,它的分子结构与丙氨酸类似,可以干扰细胞壁网状结构的合成,利于瓦解细胞壁释放原生质体,但是加入过量的甘氨酸会影响菌体正常生长,不利于原生质体制备。由图1可知,随着甘氨酸添加量的增加,菌丝浓度不断降低;当甘氨酸添加量低于0.6%时,原生质体制备率逐渐上升,高于0.6%时原生质体制备率反而下降。综合考虑,制备原生质体时在种子培养基中加入0.6%的甘氨酸为宜。
2.3 溶菌酶浓度对原生质体制备及再生的影响
溶菌酶能将链霉菌细胞壁的主要成分肽聚糖水解形成原生质体,是链霉菌原生质体制备的一个重要影响因素。将菌丝体培养30h后,分别以不同浓度(1 mg·mL-1、2mg·mL-1、3mg·mL-1、4mg· mL-1)的溶菌酶于32℃酶解60min,测定原生质体的浓度和再生率,结果如图2所示。

图2 溶菌酶浓度对原生质体浓度和再生率的影响Fig.2 Effects of lysozyme concentration on density and regeneration rate of protoplast
由图2可知,随着溶菌酶浓度的上升,原生质体的浓度也相应升高,再生率却逐渐降低。这可能是因为:酶浓度过低时细胞壁不能充分酶解,原生质体浓度较低;而酶浓度过高则降低了原生质体的活性,从而降低了原生质体的再生率。综合考虑,溶菌酶的浓度以2mg·mL-1为宜。
2.4 酶解时间对原生质体制备及再生的影响
将菌丝体培养30h后,在32℃下以2mg·mL-1的溶菌酶酶解不同时间,测定原生质体的浓度和再生率,结果如图3所示。
由图3可知,随着酶解时间的延长,原生质体的浓度相应升高,但再生率却逐渐降低。这可能是因为:酶解时间过长时细胞壁去除程度过深,导致合成细胞壁的引物丢失,进而影响了原生质体的再生。综合考虑,酶解时间以75min为宜。

图3 酶解时间对原生质体浓度和再生率的影响Fig.3 Effects of enzymolysis time on density and regeneration rate of protoplast
2.5 酶解温度对原生质体制备及再生的影响
将菌丝体培养30h后,分别以2mg·mL-1的溶菌酶在不同酶解温度(28℃、30℃、32℃、34℃、36℃)下酶解75min,测定原生质体的浓度和再生率,结果如图4所示。
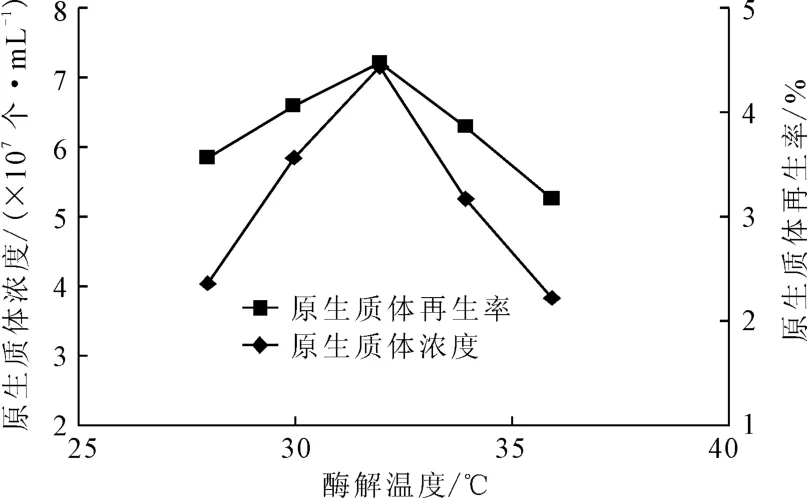
图4 酶解温度对原生质体浓度和再生率的影响Fig.4 Effects of enzymolysis temperature on density and regeneration rate of protoplast
由图4可知,随着酶解温度的上升,原生质体的浓度和再生率先升高后降低,均在酶解温度为32℃时达到最高值。这可能是因为:酶解温度低于32℃时,溶菌酶活性随着温度的升高而不断增强,原生质体的浓度和再生率不断上升;当酶解温度高于32℃时,溶菌酶活性受到抑制,原生质体的活性也开始降低,导致原生质体的浓度和再生率下降。因此,酶解温度以32℃为宜。
2.6 原生质体紫外诱变剂量的确定
去除了细胞壁的原生质体对外界的刺激非常敏感,考察玫瑰孢链霉菌D-30的原生质体在紫外照射不同时间时的致死情况,结果如图5所示。
通常紫外诱变的致死率多控制在70%~80%。由图5可知,采用40s的紫外照射时间诱变玫瑰孢链霉菌D-30的原生质体比较适宜。因此,确定在紫外灯功率为30W、照射距离为32cm、照射时间为40s的条件下进行玫瑰孢链霉菌D-30原生质体的紫外诱变。

图5 紫外照射不同时间时达托霉素产生菌D-30原生质体的致死率Fig.5 The death rate of protoplast of strain D-30 at different UV irradiation times
2.7 达托霉素高产菌株的选育
将菌种D-30按确定的最适条件进行原生质体的制备、诱变及再生,将再生得到的单菌落按1.7方法发酵培养,最终筛选得到达托霉素高产菌株D-35。将该菌株连续传代5次,用HPLC检测每代摇瓶发酵单位,达托霉素的产量波动均在3%以内,表明其遗传特性较稳定。在10L发酵罐中进行放大验证,菌株D-35的平均发酵单位与出发菌株相比提高了87.9%。
3 结论
(1)确定达托霉素产生菌玫瑰孢链霉菌D-30原生质体制备及再生的最适条件为:在种子培养基中添加0.6%的甘氨酸,当种子培养30h后,用浓度为2mg ·mL-1的溶菌酶破壁,酶解温度为32℃,酶解时间为75min。
(2)紫外诱变处理最适条件下制得的D-30原生质体,筛选得到高产菌株D-35,该菌株与出发菌株相比平均发酵单位提高了87.9%。表明通过紫外诱变达托霉素产生菌原生质体来筛选达托霉素高产菌株是一种简便高效的方法。
[1] PENN J,LI X,WHITING A,et al.Heterologous production of daptomycin in Streptomyces lividans[J].Microbiol Biotechnol,2006,33(2):121-128.
[2] CANEPARI P,BOARETTI M,LLEM M,et al.Lipoteichoic acid as a new target for activity of antibiotics:Mode of action of daptomycin(LY146032)[J].Antimicrobial Agents and Chemotherapy,1990,34(6):1220-1226.
[3] 周剑,刘颖,方东升,等.氮离子注入玫瑰孢链霉菌选育达托霉素高产菌株的研究[J].辐射研究与辐射工艺学报,2008,26(5):317-320.
[4] HOJATI Z,MILNE C,HARVEY B,et al.Structure,biosynthetic origin,and engineered biosynthesis of calcium-dependent antibiotics fromStreptomyces coelicolor[J].Chemistry and Biology,2002,9(11):1175-1187.
[5] 贺筱蓉,李永泉,赵小立,等.原生质体诱变选育去甲基金霉素高产菌[J].杭州大学学报(自然科学版),1997,24(2):170-177.
[6] 王晓蕾,高慧英,蒋沁,等.他克莫司产生菌原生质体制备、再生与诱变[J].河北大学学报(自然科学版),2006,26(1):25-29.
[7] 朱林东,金志华.普那霉素产生菌的原生质体诱变育种[J].中国抗生素杂志,2006,31(10):591-619.
[8] 诸葛健,唐是雯.工业微生物实验技术手册[J].北京:中国轻工业出版社,1994.
