阿仑膦酸钠治疗腰椎侧凸术后疼痛的疗效研究
2014-03-20盛晓文钱宇锋薛峰陆建民陈兵乾
盛晓文,钱宇锋,薛峰,陆建民,陈兵乾
(江苏省常熟市第一人民医院骨科,江苏 常熟 215500)
退行性腰椎侧凸(degenerative lumbar scoliosis,DLS)是临床上常见的中老年腰腿痛原因之一,现有的研究认为退行性腰椎侧凸始发于椎间盘和关节突关节、韧带的退行性改变[1],但骨质疏松(osteoporosis,OP)因容易导致椎体非对称性压缩骨折以及使凹侧承重较大出现骨小梁的微骨折等因素而被认为是DLS产生和加重的独立因素。临床上对于DLS先予以保守治疗,如保守治疗效果不佳,出现明显神经压迫或椎管狭窄表现的患者则需要手术治疗。可选的手术方式较多,但许多学者推荐后路选择性减压加短节段矫形融合,以期在保证治疗效果的基础上减少手术并发症。笔者在早期病例术后未重视抗骨质疏松治疗,随访中发现部分患者术后仍残留较严重的疼痛,且伴有低骨密度,予以抗骨质疏松治疗后好转,故进行本次研究。选取2009年1月至2011年12月在我院行后路选择性减压短节段融合固定术治疗的退变性腰椎侧凸症患者73 例,进行随机分组、前瞻性对照研究,探讨DLS术后的骨质疏松情况及抗骨质疏松临床效果,现将结果报道如下。
1 资料与方法
1.1 纳入与剔除标准 对2009年1月至2011年12月在我院行后路选择性减压短节段融合固定术治疗的退变性腰椎侧凸症患者进行筛选。纳入标准:a)站立位Cobb角≥10°;b)年龄≥50 岁;c)能遵守本研究随访要求。剔除标准:a)有先天性脊柱畸形者;b)曾有胸腰椎手术史者;c)非退变性脊柱侧凸,即其他类型的脊柱侧凸者;d)近5年内有骨折病史、瘫痪、行动不便者;e)有心、脑、肝、肾及内分泌等系统严重器质性疾病者;f)长期使用类固醇、细胞性毒药物、抗惊厥药物、肝素、锂制剂、长期酗酒者;g)有库欣综合征、甲旁亢、胰岛素依赖性糖尿病、胃肠吸收障碍性疾病、多发性骨髓瘤者;h)近3个月内使用影响骨代谢药物者。本研究方案事先通过医院伦理委员会批准。
1.2 一般资料 共有73 例退变性腰椎侧凸患者纳入本研究,所有患者入院时根据病史、体征及影像学检查诊断为退变性腰椎侧凸,其中有43 例合并腰椎管狭窄症,有21 例合并腰椎间盘突出症,有52 例腰椎动力位片显示节段不稳。通过询问基础病史、用药史及检测肝肾功能、内分泌和自身免疫指标发现有26 例合并有其他基础病,如高血压、非胰岛素依赖性糖尿病、心律失常、轻度慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)、轻度贫血、骨关节炎等。所有内科合并症均予以内科治疗,并尽量避免应用干扰骨代谢的药物。所有患者均由经验丰富的医师行后路选择性减压短节段融合固定术[2,3]。术后处理均一致,予以相同的饮食指导及锻炼指导,鼓励患者术后1周在腰围保护下床活动。术后2周拆线后出院。
采用随机数表法将纳入患者随机分成两组:阿仑膦酸钠组39 例,对照组34 例。两组患者的性别、年龄、体重指数、手术时间、失血量、输血量、手术节段数量差异均无统计学意义(见表1),具有可比性。
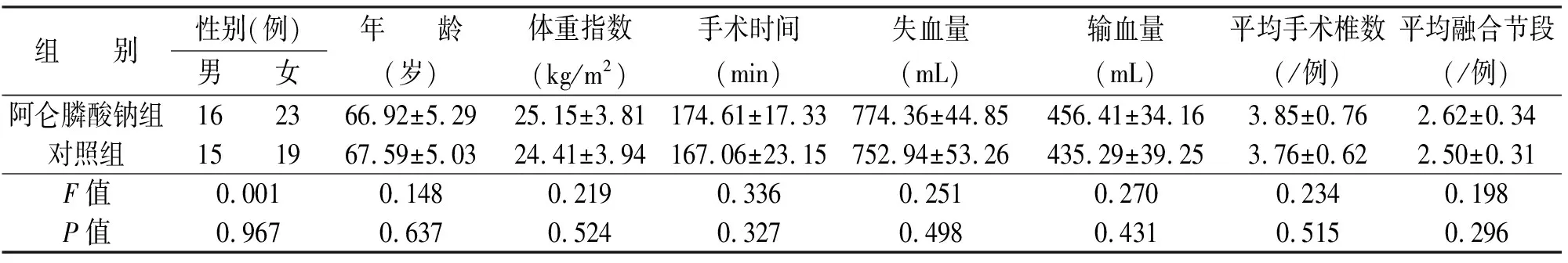
表1 两组患者一般情况比较
1.3 干预、随访方法及观察指标 干预方法:对照组自术后2周开始长期口服钙600 mg/d和维生素D3125 U/d,阿仑磷酸钠组在对照组基础上加用阿仑膦酸钠70 mg/周,也自术后2周开始。
随访及观察指标:术后在两组干预前所有患者行站立位腰椎正侧位片、动力位片,腰椎CT,腰椎MRI等检查(包括脂肪抑制序列),检测血生化指标,包括钙、磷、骨形成指标血清总碱性磷酸酶(alkaline phosphatase,ALP)、骨转化指标血清Ⅰ型胶原C端肽(S-CTX,酶联免疫法)浓度,进行跟骨定量超声骨密度检查(仪器:OsteoPro UBD2002A),进行视觉模拟评分法(visual analogue scale,VAS)评分及Oswestry功能障碍指数(Oswestry disability index,ODI)评分(采用比分表示)。术后3、6个月及每整年时门诊随访,记录骨折等不良事件,复查上述指标。
1.4 数据测量收集和统计学方法 在站立位腰椎正侧位片上测量Cobb角,腰椎动力位片了解椎间植骨融合情况(融合标准:植骨材料和椎体间无透亮影,过伸过屈位片椎间角度变化小于3°)。影像学数据均由本文第一作者和第二作者独立测量后取平均值。
2 结 果
所有患者手术均顺利完成,未出现深部感染、深静脉血栓(deep venous thrombosis,DVT)等严重手术并发症。至末次随访时阿仑磷酸钠组有2 例分别因为严重的胃肠道反应和肝肾功能明显受损而退出,对照组有2 例失访。最终阿仑磷酸钠组和对照组各有37 例、32 例完成随访(94.5%),平均随访(2.87±0.77)年(2~5年)。两组患者术后腰腿痛症状均明显缓解,影像学显示术后侧凸获得明显纠正。
两组患者在实施干预前的基线特点接近,在VAS、ODI、术后Cobb角、跟骨超声骨质指数、平均跟骨T值、血钙、磷、、血清总碱性磷酸酶(alkaline phosphatase,ALP)、Ⅰ型胶原C端肽(serum C-tenninal telopeptides of type Ⅰ collagen,S-CTX)指标上差异均无统计学意义(见表2)。干预开始前约术后2周时采集到的VAS和ODI值稍高,这可能是由于术后短期仍受到手术创伤、切口疼痛等的影响。而患者骨质方面整体呈现骨质疏松,血钙磷水平正常,ALP轻度升高代表成骨活跃,但S-CTX明显高于正常人说明骨转化也活跃。
两组患者经过平均2.87年的随访,发现VAS、ODI在术后1年内表现为进一步的恢复,而在接下来的随访中对照组表现出VAS、ODI和Cobb角缓慢增加,而阿仑膦酸钠组则基本稳定在术后1年的水平,未出现明显进展,在末次随访中两组数据差异具有统计学意义。同样的,阿仑膦酸钠组干预后骨密度逐步增加和骨转化逐渐降低,末次随访时与干预前相比有明显差异。组间相比末次随访时阿仑膦酸钠组的超声骨密度指标明显优于对照组,成骨、骨转化指标也明显低于对照组,且血钙磷明显低于干预前。至末次随访,两组的椎间植骨融合率分别为97.9%和96.3%,组间相比差异无统计学意义;同样至末次随访,对照组的脆性骨折发生率为5人次,明显高于阿仑膦酸钠组的1人次。以T值<-2.5SD为骨质疏松的诊断指标统计两组骨质疏松患者比例,干预前阿仑膦酸钠组和对照组分别占16.22%和15.63%,而末次随访时变为8.11%和18.75%,阿仑膦酸钠组干预后出现骨质疏松患者比例明显减少,具有统计学意义。这说明钙尔奇D+阿仑膦酸钠的联用可以有效抑制破骨活动,提高骨密度,减少脆性骨折,优于单用钙尔奇D,并可以维持DLS术后效果,改善患者术后腰椎功能和生活质量,预防Cobb角进一步进展。
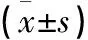
表2 两组患者治疗前后临床症状及骨代谢指标比较
3 讨 论
退变性腰椎侧凸症是中老年常见的腰腿痛原因,常导致多种不同的临床症状[1],包括轴性痛及神经性跛行、侧凸进展。Li等[3]发现患者睡眠减少与DLS进展相关。Kohno等[5]分析DLS的进展因素后发现顶椎旋转度与侧凸进展有很好的相关性。陆建民等[6]随访DLS患者发现26.4%的侧凸患者出现进展,并分析影像后发现负重下顶椎旋转和腰椎前凸角进展与Cobb进展具有较好的一致性。老年患者大都伴有骨密度减少,Urrutia等[2]报道在50 岁以上的绝经后妇女中DLS占12.9%,年龄和体重指数是DLS的影响因素,本组患者干预前骨质疏松比例为15.63%~16.22%,Ding等[7]对DLS患者进行10年随访后认为侧凸与骨密度存在负相关关系。
临床上根据DLS病情予以非手术治疗或手术治疗,前者包括锻炼、药物控制疼痛、支具固定以及硬膜外注射等,后者包括单纯减压、有限或广泛的前路或后路融合手术、畸形纠正等,但围手术期的并发症发生率需要考虑,比如内固定松动切出,脊柱失衡,畸形加重,邻椎退变等。对于轻度的侧凸(小于30°),单纯减压或短节段减压融合固定[3,8]是明智的选择,而严重侧凸畸形通常比较僵硬,需要联合松解术[9]。虽然Yagi等[10]认为骨质疏松与术前Cobb角、术后融合率、手术并发症发生率之间无相关性,但是伴有骨质疏松的患者脊柱融合术后将面临内固定松动、植骨不愈合等问题,这与术后残余疼痛有密切关系。但是本研究中对照组的腰背痛症状和腰部障碍从干预前与阿仑磷酸钠组无明显差别至末次随访时表现的更严重,且这些变化与骨密度、T值降低一致,这可能是骨质疏松者在脊柱融合术后应力集中导致的微骨折所致,这也说明融合术后抗骨质疏松治疗术后残余疼痛的意义。
在抗骨质疏松的药物中,阿仑膦酸钠是常用的一种双膦酸盐制剂,可以有效抑制骨吸收,增加骨密度。Kuĉukaliĉ等[11]发现绝经后骨质疏松妇女每周补充70 mg阿仑膦酸钠,1年后出现骨转化指标显著降低:CTX降低49%,骨钙素降低29.7%,同时脊柱骨密度增加13.46%,并且对男性也有类似作用[12]。动物实验发现阿仑膦酸钠可以延缓去势大鼠腰椎间盘的退变,这可能是因为保护了椎间盘相邻的终板、椎体,调节稳定椎间盘的基质代谢[13]。最近的报道发现阿仑膦酸钠口服或是低剂量口服(70 mg/2周)以及静脉使用900 μg/月均有类似效果[14,15]。Peris等[16]指出血清25(OH)D与阿仑膦酸钠有协同作用,如果血清25(OH)D不足则出现阿仑膦酸钠效果下降,所以联合应用阿仑膦酸钠和维生素D以及钙剂可以提高抗骨质疏松的效果[17,18]。
阿仑膦酸钠在脊柱术后应用也有积极意义。Giro等[19]发现阿仑膦酸钠可以维持钛内植物周围的骨量。Xue等[20]在动物模型上证实阿仑膦酸钠可通过抑制骨吸收改善骨螺钉界面,减少远期螺钉松动的效果。Nakao等[21]在动物模型上证实脊柱融合后使用阿仑膦酸钠可以在影像学、生物力学和组织学上表现出有效的抗骨质疏松作用。Nagahama等[22]的临床前瞻性随机试验证实阿仑膦酸钠可以提高骨块融合率,减少内固定失败,提高术后的腰椎功能,并推荐融合术围手术期使用阿仑膦酸钠。本研究中阿仑膦酸钠组也获得了类似的作用。McNabb等[23]报道阿仑膦酸钠治疗3~5年后停药仍出现骨质流失。Huang等[24]发现短期应用后阿仑膦酸钠的效果并不能长期维持,建议长期应用或间隔应用。
DLS患者常为中老年患者,骨质疏松症及内科合并症常见,这些情况可能会影响患者术后活动能力,干扰手术治疗的效果。本研究发现DLS术后联合应用阿仑膦酸钠和钙尔奇D具有提高骨块融合率,减少内固定失败,提高术后腰椎功能的作用,对DLS的术后残余疼痛具有明显的缓解作用。
参考文献:
[1]Kotwal S,Pumberger M,Hughes A,etal.Degenerative scoliosis:a review[J].HSS J,2011,7(3):257-264.
[2]Urrutia J,Diaz-Ledezma C,Espinosa J,etal.Lumbar scoliosis in postmenopausal women:prevalence and relationship with bone density,age,and body mass index[J].Spine,2011,36(9):737-740.
[3]Li H,Liang C,Shen C,etal.Decreased sleep duration:A risk of progression of degenerative lumbar scoliosis[J].Med Hypotheses,2012,78(2):244-246.
[4]Kohno S,Ikeuchi M,Taniguchi S,etal.Factors predicting progression in early degenerative lumbar scoliosis[J].J Orthop Surg(Hong Kong),2011,19(2):141-144.
[5]陆建民,钱宇锋,薛峰,等.退变性腰椎侧凸症的自然进展和影像学测量指标间相关性的研究[J].颈腰痛杂志,2013(2):98-101.
[6]Ding WY,Yang DL,Cao LZ,etal.Intervertebral disc degeneration and bone density in degenerative lumbar scoliosis:a comparative study between patients with degenerative lumbar scoliosis and patients with lumbar stenosis[J].Chin Med J(Engl),2011,124(23):3875.
[7]Daubs MD,Lenke LG,Bridwell KH,etal.Decompression alone versus decompression with limited fusion for treatment of degenerative lumbar scoliosis in the elderly patient[J].Evid Based Spine Care J,2012,3(4):27.
[8]钱宇锋,薛峰,盛晓文,等.后路选择性短节段矫形固定治疗退变性腰椎侧凸症疗效分析[J].颈腰痛杂志,2013,34(4):324-327.
[9]Zhou C,Liu L,Song Y,etal.Anterior release internal distraction and posterior spinal fusion for severe and rigid scoliosis[J].Spine,2013,38(22):1411-1417.
[10]Yagi M,Boachie-Adjei O,King AB.Characterization of osteopenia/osteoporosis in adult scoliosis.does bone density affect surgical outcome?[J].Spine J,2011,36(20):1652-1657.
[11]Kuĉukaliĉ-Selimoviĉ E,Valjevac A,Hadĉoviĉ-Dĉuvo A,etal.Evaluation of bone remodelling parameters after one year treatment with alendronate in postmenopausal women with osteoporosis[J].Bosn J Basic Med Sc,2011,11(1):41-45.
[12]Swenson ED,Hansen KE,Jones AN,etal.Characteristics associated with bone mineral density responses to alendronate in men[J].Calcifi Tissue Int,2013,92(6):548-556.
[13]Luo Y,Zhang L,Wang WY,etal.Alendronate retards the progression of lumbar intervertebral disc degeneration in ovariectomized rats[J].Bone,2013,55(2):439-448.
[14]Shiraki M,Nakamura T,Fukunaga M,etal.A multicenter randomized double-masked comparative study of different preparations of alendronate in osteoporosis-monthly(four weeks)intravenous versus once weekly oral administrations[J].Curr Med Res Opin,2012,28(8):1357-1367.
[15]Li M,Zhang Z,Liao E,etal.Effect of low-dose alendronate treatment on bone mineral density and bone turnover markers in Chinese postmenopausal women with osteopenia and osteoporosis[J].Menopause,2013,20(1):72-78.
[16]Peris P,Martínez-Ferrer A,Monegal A,etal.25 hydroxyvitamin D serum levels influence adequate response to bisphosphonate treatment in postmenopausal osteoporosis[J].Bone,2012,51(1):54-58.
[17]Ralston SH,Binkley N,Boonen S,etal.Randomized trial of alendronate plus vitamin D3 versus standard care in osteoporotic postmenopausal women with vitamin D insufficiency[J].Calcif Tissue Int,2011,88(6):485-494.
[18]Roux C,Binkley N,Boonen S,etal.Vitamin D status and bone mineral density changes during alendronate treatment in postmenopausal osteoporosis[J].Calcif Tissue Int,2014,94(2):1-5.
[19]Giro G,Coelho PG,Pereira RMR,etal.The effect of oestrogen and alendronate therapies on postmenopausal bone loss around osseointegrated titanium implants[J].Clin Oral Implants Res,2011,22(3):259-264.
[20]Xue Q,Li H,Zou X,etal.Alendronate treatment improves bone-pedicle screw interface fixation in posterior lateral spine fusion:An experimental study in a porcine model[J].Int Orthop,2010,34(3):447-451.
[21]Nakao S,Minamide A,Kawakami M,etal.The influence of alendronate on spine fusion in an osteoporotic animal model[J].Spine,2011,36(18):1446-1452.
[22]Nagahama K,Kanayama M,Togawa D,etal.Does alendronate disturb the healing process of posterior lumbar interbody fusion?A prospective randomized trial:Clinical article[J].J Neurosurg Spine,2011,14(4):500-507.
[23]McNabb BL,Vittinghoff E,Schwartz AV,etal.BMD changes and predictors of increased bone loss in postmenopausal women after a 5-year course of alendronate[J].J Bone Miner Res,2013,28(6):1319-1327.
[24]Huang B,Zou X,Li H,etal.Short-term alendronate treatment does not maintain a residual effect on spinal fusion with interbody devices and bone graft after treatment withdrawal:an experimental study on spinal fusion in pigs[J].Eur Spine J,2013,22(2):287-295.
