以谷胱甘肽修饰的CdTe 量子点为荧光探针测量超痕量As(Ⅲ)
2014-03-18伍文彬何兴羽殷晓翠
伍文彬 何兴羽 殷晓翠 丁 琳
(南昌航空大学环境与化学工程学院,江西省持久性污染物控制与资源循环利用重点实验室,江西 南昌 330063)
1 引言
砷的许多形态都是高毒性的,这引起了广大研究者的极大关注[1]。在还原条件或者低的pH值下As(Ⅲ)比As(Ⅴ)更稳定,在没有被污染的表面和深海水域中As(Ⅲ)占总砷含量的10%。As(Ⅲ)是最有毒的砷形态之一,对于老鼠来说As(Ⅲ)的半数致死量(LD50)低于14 mg·kg-1[2-3]。已经有很多证据表明癌症和其它疾病是由砷导致的[4-6]。这些证据促使美国环保署规定引用水中砷含量必须低于50到5 μg·L-1这个范围[7]。在许多情况下,原子荧光光谱法(AFS)是检测超痕量砷的最好选择[8-9]。然而,AFS是在实验室中的技术,很难被应用到户外进行化学分析。最近,量子点因为粒径可控的荧光性质、高的荧光量子产率和好的稳定性,引起了研究者极大的兴趣,被应用于探索感应系统,识别生物大分子[10-11]和无机离子[12-15]。谷胱甘肽(GSH)是一种三肽,能够保护细胞免于重金属离子和自由基的毒害。但是这个过程会被As(Ⅲ)严重干扰和阻碍[16],这种干扰已经被用于研究包含有巯基的酶的活性位点[17]。GSH是合成量子点是一种很好的配体,在不经过预处理情况下,就可以在水相中直接合成出荧光量子产率很高的GSH修饰的CdTe QDs[18-19]。GSH修饰的量子点在水溶液中具有很好的稳定性和高的生物相容性,使得这种量子点被应用到生物成像[20]和离子或者分子检测方面[21-22]。量子点的荧光光谱法主要是基于量子点的修饰剂GSH与分析物发生交联导致荧光淬灭的一种方法。例如,GSH 修饰的CdZnSe QDs被应用于超痕量检测Pb2+[21]。这是因为Pb-S的Ksp值远远低于Zn-S,与Cd-S Ksp值相当,当存在Pb2+时荧光强度会选择性的减小。
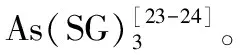
2 实验部分
2.1 实验药品
实验所用药品主要有:氯化镉、谷胱甘肽(还原型,GSH),乙醇、硼氢化钠、氢氧化钠、亚砷酸钠,亚碲酸钠,其中实验中所有药品和试剂均为分析纯,实验用水均为去离子水。
2.2 实验仪器
紫外可见分光光度计(U-3900H,日本日立),荧光分光光度计(F-7000,日本日立),恒温加热磁力搅拌器(DF-101S,巩义市于华仪器有限责任公司),高速冷冻离心机(CR220GⅢ,日本日立),超声波清洗机(SK5210LHC,上海科导超声仪器有限公司)。
2.3 GSH-CdTe QDs的制备
GSH-CdTe量子点按照文献[25]通过水相法合成:在250 mL三口烧瓶中加入22.5 mL 2×10-2M CdCl22.5H2O,0.1844 g GSH和55 mL超纯水,用1 M NaOH溶液将混合液pH值调至10.5,然后将0.0038 g NaBH4和0.0222 g Na2TeO3加入,当溶液变成浅绿色后,100 ℃下密封回流反应120 min得到橘红色的量子点溶液。用乙醇沉淀,离心分离,重复三次,最后保存于Tris-HCl(pH=7.4)缓冲溶液中。
2.4 检测金属离子
2.5 选择性实验
我们研究了潜在干扰离子对CdTe QDs荧光性能的影响。潜在干扰离子,如加入Ca2+,Al3+,Ni2+,Fe2+,Mn2+,Cr3+,Mg2+,Cu2+,Fe3+,Zn2+,Cd2+,Na+,As3+。首先配置10 mM各种金属离子的储备溶液,然后用Tris-HCl(pH=7.4)缓冲溶液再配置10 μM各种金属离子的溶液。
3 结果与讨论
3.1 量子点的荧光性质
与传统有机荧光染料相比,量子点可以通过改变尺寸大小和组成来调节量子点的发射峰从可见到红外区域。图1是不同反应时间下所制备的CdTe QDs的紫外可见吸收光谱图和荧光发射光谱图(激发波长为400 nm)。从图中可知,延长反应时间,量子点发生了红移,这表明了随着时间的延长,量子点的粒径也逐渐的增大。量子点的粒径可以通过彭的公式计算[26],通过计算可知反应时间为80 min,120 min,150 min的CdTe QDs的粒径分别为3.29 nm、3.85 nm和3.96 nm,这进一步证实了随着反应时间的加长,粒径也随之增大。荧光发射峰窄而对称说明合成出的量子点的光学性能很好,满足接下来的实验要求。
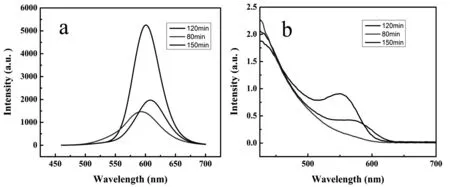
图1 不同反应时间CdTe量子点的荧光发射光谱(a,激发波长为400 nm)和紫外可见吸收光谱(b)
3.2 不同价态砷对CdTe QDs的影响
本文中研究了不同毒性的四种价态砷(3,0,+3和+5)对GSH-CdTe QDs荧光强度的影响,如图2所示。由图可知,在相同浓度下As(V),甲胂酸 (MMA),二甲胂酸(DMA),偶砷 (AsB)和砷胆碱 (AsC)对量子点的荧光性能没有很明显的影响,而加入As(III)后量子点的荧光强度几乎淬灭。这表明了只有As(III)可以与量子点表面的GSH修饰层结合,破坏表面结构,导致表面缺陷增多,荧光发生淬灭。由于其它价态的砷对量子点的荧光性能没有什么影响,所以在实际应用中的应用范围更加广阔。

图2 10 μM不同形态砷对GSH-CdTe(10 μM)量子点荧光性能的影响
3.3 CdTe QDs检测As(III)
谷胱甘肽是一种含有巯基的三肽,对于合成CdTe QDs来说是一种理想的修饰剂,这对维持量子点的稳定有很大的作用。因此,金属与GSH的相互作用对于荧光淬灭效应是一个非常重要的参数。As(III)可以与GSH发生反应:
As3++3GSH → As(SG)3+3H+

图3 不同浓度As3+(a)对CdTe量子点荧光强度的影响;不同浓度As3+(b)相应的标准曲线
3.4 CdTe QDs选择性检测As(III)
本课题研究了潜在干扰离子对CdTe QDs荧光性能的影响。潜在干扰离子,如Ca2+,Al3+,Ni2+,Fe2+,Mn2+,Cr3+,Mg2+,Cu2+,Fe3+,Zn2+,Cd2+,Na+,As3+。首先配置10 mM各种金属离子的储备溶液,然后用Tris-HCl(pH=7.4)缓冲溶液再配置10 μM各种金属离子的溶液。如图4所示,当加入Na+,Ni2+,Mn2+,Fe2+,Cd2+后量子点荧光强度几乎不变。加入Ca2+,Al3+,Mg2+,Cr3+,Zn2+离子后量子点荧光强度只是稍微降低了一点。相对其它金属离子Cu2+,Fe3+对量子点的荧光强度稍微大一点,但是也是在可以控制的范围内。而加入同等浓度的As3+时,GSH-CdTe QDs的荧光强度几乎淬灭。这表明了CdTe QDs作为荧光探针可以选择性检测实际废水中的As3+。

图4 CdTe 量子点的选择性
4 结论
本章中,利用GSH能够与As3+特异性结合这一性质,合成出水溶性GSH-CdTe QDs作为荧光探针选择性检测As(III)。CdTe QDs表面的谷胱甘肽修饰层很容易被As(III)所取代,从而破坏量子点的表面结构,增加不饱和悬空键,导致量子点表面缺陷增多,促进了非辐射再重合过程,最终使量子点发生荧光淬灭效应。实验表明,As(III)浓度在0.2到2.2 μM范围内与量子点的荧光强度呈现出很好的线性关系,检出限达到20 nM。在这个浓度范围内,随着As(III)浓度不断的增加,量子点的荧光强度也不断的降低,当增加到一定程度时,荧光几乎淬灭。并且其它价态砷对量子点的荧光性能几乎没有影响,这说明了量子点的抗干扰能力强。选择性实验也证明了这种探针可以高选择性的检测As(III),溶液中其它金属离子对量子点的荧光性能几乎没有影响,当加入As(III)时则发生明显的淬灭。这些优良的性质拓宽了GSH-CdTe QDs的应用领域,作为荧光探针也将有望被应用到分析化学中,用于检测实际废水中As3+的含量。
[1]Cullen W R, Reimer K J. Arsenic speciationin the environment[J]. Chem. Rev,1989,89(4):713-764.
[2]Alan M S L, Welch H, Hughes J L. Arsenic in ground water of the western United States[J]. Groundwater, 1988,26(3):333-347.
[3]Andreae M O. Determination of arsenic species in natural waters[J]. Anal. Chem,1977,49(6):820-823.
[4]Smith A H ,Hopenhaynrich C, Bates M N, et al. Cancer risks from arsenic in drinking water[J]. Environ. Health. Perspect, 1992,97:259-267.
[5]Nakamura Y, Narukawa T, Yoshinaga J. Cancer risk to Japanese population from the consumption of inorganic arsenic in cooked Hijiki[J]. J. Agric. Food. Chem,2008,56(7):2536-2540.
[6]Regelson W, Kim U, Ospina J. Hemangioendothelial sarcoma of liver from chronic arsenic intoxication by Fowler’s solution[J]. Cancer,1968,21(3):514-522.
[7]Mulvihil M l, Tao A, Benjauthrit K, et al. Surface-enhanced raman spectroscopy for trace arsenic detection in contaminated water[J]. Chem. Int. Ed,2008,120(34):6556-6560.
[8]Sanchez-Rodas D, Corns W T, Chen B, et al. Atomic Fluorescence Spectrometry: a suitable detection technique in speciation studies for arsenic, selenium, antimony and mercury[J]. J. Anal. Atom. Spectrom,2010,25(7):933-946.
[9]Liu R, Wu P, Xi M Y, et al. Inorganic arsenic speciation analysis of water samples by trapping arsine on tungsten coil for atomic fluorescence spectrometric determination[J]. Talanta,2009,78(3):885-890.
[10]Chan W C , Nie W S. Quantum dot bioconjugates for ultrasensitive nonisotopic detection[J].Science, 1998,281(5385):2016-2018.
[11]Ma Q, Wang X Y , Li Y B, et al. Multicolor quantum dot-encoded microspheres for the detection of biomolecules[J]. Talanta,2007,72(4):1446-1452.
[12]Gattas-Asfura K A, Leblanc R M. Peptide-coated CdS quantum dots for the optical detection of copper(II) and silver(I)[J]. Chem. Commun,2003(21):2684-2685.
[13]Banerjee S, Kara S, Santra S. A simple strategy for quantum dot assisted selective detection of cadmium ions Subhash Banerjee, Soumitra Kar and Swadeshmukul Santra[J]. Chem. Commun,2008(26):3037-3039.
[14]Xia Y S, Zhu C Q. Use of surface-modified CdTe quantum dots as fluorescent probes in sensing mercury (II)[J]. Talanta, 2008,75(1):215-221.
[15]Wu P, Yan X -P. A simple chemical etching strategy to generate “ion-imprinted” sites on the surface of quantum dots for selective fluorescence turn-on detecting of metal ions[J]. Chem. Commun,2010,46(37):7046-7048.
[16]Scott N, Hatlelid K M, Mackenzie N E, et al. Reactions of arsenic(III) and arsenic(V) species with glutathione[J]. Chem. Res. Toxicol,1993,6(1):102-106.
[17]Lakshmanan M R, Cama H R, Vaidyanathan C S. Oxidation of vitamin A1 aldehyde and vitamin A2 aldehyde to the corresponding acids by aldehyde oxidase from different species[J]. Biochem. J,1964,90(3):569-573.
[18]Qian H F, Weng J. Facile one-pot synthesis of luminescent, water-soluble, and biocompatible glutathione-coated CdTe nanocrystals[J]. J. Ren. Small,2006,2(6):747-751.
[19]Zheng Y G, Gao S J, Ying J Y. Synthesis and Cell-Imaging Applications of Glutathione-Capped CdTe Quantum Dots[J]. Adv. Mater,2007,19(3):376-380.
[20]Dong W, Ge W, Wang M, et al. Labeling of BSA and imaging of mouse T-lymphocyte as well as mouse spleen tissue by l-glutathione capped CdTe quantum dots[J],Luminescenc,2001,25(1):55-60.
[21]Ali E M, Zheng Y G, Yu H H, et al. Ultrasensitive Pb2+ detection by glutathione-capped quantum dots[J]. Anal. Chem, 2007,79(24):9452-9458.
[22]Yuan J, Guo W, Yin J,Wang E. Glutathione-capped CdTe quantum dots for the sensitive detection of glucose[J].Talanta, 2009,77(5):1858-1863.
[23]Csanaky L, Gregus Z, Species variations in the biliary and urinary excretion of arsenate, arsenite and their metabolites[J],Comp. Biochem. Physiol. C: Pharmacol. Toxicol. Endocrinol,2002,131(3):355-365.
[24]Raab A, Meharg A A, Jaspars M, et al. Arsenic-glutathione complexes-their stability in solution and during separation by different HPLC modes[J]. J. Anal. Atom. Spectrom,2004,19(1):183-190.
[25Water-Soluble CdTe: Zn2+ Quantum Dots[J]. Inorg. Chem,2012,51(17):9208-9213.
[26]Yu W W, Qu L, Guo W, et al. Experimental Determination of the Extinction Coefficient of CdTe, CdSe, and CdS Nanocrystals[J]. Chem. Mater,2003,15(14):2854-2860.
