VEGF-D在口腔鳞癌相关成纤维细胞的表达研究
2014-03-18莫金龙唐婉容
刘 英,莫金龙,刘 震,唐婉容
(1.川北医学院附属医院口腔科,四川 南充 637000;2.遂宁市中心医院信息科,四川 遂宁 629000 )
鳞状细胞癌(oral squamous cell carcinoma,OSCC)是口腔肿瘤中最常见的恶性肿瘤,约占90%以上,颈淋巴结转移是口腔癌早期常见的转移途径,其转移率高达37%~58%,是导致早期口腔鳞癌治疗失败的重要原因[1]。近年来,肿瘤微环境日益成为研究热点,学者们发现间质细胞与癌上皮细胞的交互作用在肿瘤的发生发展中起着重要作用[2]。在实体肿瘤微环境中,成纤维细胞是数目众多、功能强大、获得活化表型的间质细胞,被称为癌相关成纤维细胞(carcinoma-associated fibroblasts,CAFs) 。CAFs通过其产生的多种生长因子以及趋化因子影响肿瘤细胞的生长和转移[3-4]。已有研究表明CAFs分泌血管内皮生长因子(vascular endothelial growth factor,VEGF)在促进口腔癌血管生成及远处转移中起作用,本研究旨在探究CAFs是否促进淋巴管的生成,在口腔癌的淋巴结转移中是否起作用。
1 材料和方法
1.1 用于原代人口腔鳞癌CAFs培养的标本收集
收集川北医学院附属医院口腔颌面外科原发性OSCC患者组织,所有患者术前均未行化疗、放疗和其他生物治疗,所有标本均由病理科确诊。所取组织包括癌邻近结缔组织用于CAFs分离培养,手术边界正常结缔组织用于NFs分离培养。手术标本切取过程中严格无菌操作,取材后立即放入含有双抗的磷酸盐缓冲液中,在超净台内修剪完成后续操作(标本信息见表1 )。

表1 用于原代CAFs培养的标本信息
1.2 人口腔CAFs和NFs的分离培养及鉴定
运用CAFs组织块分离培养方法,在超净台内修剪组织,取邻近癌上皮的结缔组织和手术边界正常的结缔组织分别用于CAFs和NFs的分离培养。用眼科剪将组织剪成1 mm3左右的小块,用含青霉素100 U/mL、链霉素100 μg/mL的PBS液漂洗3次,用眼科镊送入培养瓶,用牙科探针将组织块在瓶底上均匀摆置。加入含10%胎牛血清的DMEM培养基(HyClone公司产),培养条件为37 ℃,5%CO2饱和湿度,3~5 d换液。0.25%胰酶消化传代,差速消化法对CAFs进行纯化,得到第3代纯化细胞,实验用6代以内的细胞[3,6]。
1.3 细胞组化鉴定口腔CAFs
胰酶消化细胞后,均匀接种至细胞爬片上,加培养基2 mL,培养2~3 d,观察细胞铺满爬片40%~60%,用4%多聚甲醛固定后用于细胞组化染色检测。固定细胞用0.5% TxitonX-100处理后,在相同条件下采用SP法试剂盒进行免疫组化染色,以PBS作为阴性对照,每例样本组每个指标设3个平行细胞爬片染色。采用鼠抗人cytokeratin、vimentin、α-SMA、VEGF-D抗体检测,其中cytokeratin、vimentin、α-SMA购自北京中杉金桥试剂公司,一抗稀释度分别为1∶200、1∶200、1∶100;VEGF-D购自Abcam,一抗稀释度为1∶200。同时结合观察细胞的形态和生长方式,对生长至第3代的细胞进行初步鉴定。
1.4 RT-PCR检测CAFs表达VEGF-D的mRNA水平
取对数生长期的细胞,分别提取CAFs和NFs的RNA,参照试剂盒说明(TakaRa)每例样本组设 3 个平行复孔,实验重复3次。VEGF-D引物为上游5’-AGC TGG GGA AGA GTA CCA ACA-3’,下游为5’-CAC AGA GAG CTG GTT CCT GGA-3’,以β-actin基因作为内参。采用RT-PCR 仪自带分析软件分析各样品mRNA表达情况,相对定量采用 2-ΔΔCT法计算。通过计算CT值的方法对VEGF-D mRNA进行相对定量分析。
1.5 统计学分析
实验结果用SPSS17.0软件统计分析,组间比较采用单因素方差分析,以P<0.05认为差异具有统计学意义。
2 结果
2.1 人口腔CAFs的分离培养及鉴定
倒置相差显微镜下观察,CAFs生长速度较快,细胞排列无序,密度和接触抑制丧失,细胞体和细胞核均较大。正常成纤维细胞NFs排列规则,无重叠生长,密度和接触抑制保留,胞体和胞核较小。通过细胞组化染色,原代培养的CAFs和NFs 细胞均表达Vimentin,而不表达Cytokeratin,这证明无论是CAFs还是NFs均为成纤维细胞来源,而非上皮细胞来源。CAFs表达α-SMA,染色阳性,证明是生物学特性已经发生变化的癌旁成纤维细胞,见图1、图2。


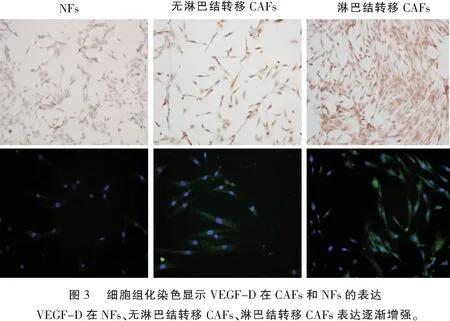
2.2 细胞免疫组化染色显示人口腔CAFs、NFs表达VEGF-D 的差异
细胞爬片组化染色的阳性抗原定位准确,背景着色浅或无,颜色鲜明,二者的比值大于1(阳性/背景),(HRP-DAB/H2O2)则表现为淡黄色细颗粒、棕黄色颗粒和褐黄色粗颗粒,染色强度分“弱(+)、中(++)、强(+++)”3级。细胞免疫荧光法(FITC为例)则表现为浅绿色荧光、明显绿色荧光和亮绿眼荧光;后者耀眼易见。
VEGF-D免疫染色阳性物质主要存在于胞浆,阳性染色表现为浅淡黄色细颗粒,荧光染色阳性表现为绿色荧光。NFs、无淋巴结转移CAFs、淋巴结转移CAFs均表达VEGF-D阳性,但CAFs表达高于NFs,而淋巴结转移CAFs又明显高于无淋巴结转移CAFs。实验重复3次,染色强度趋势一致(图3代表1次染色结果)。
2.3 用RT-PCR检测VEGF-D mRNA在CAFs、NFs 的表达
采用Quantitative Real-time PCR检测VEGF-D mRNA 在 CAFs和NFs的表达,采用 2-ΔΔCT法以β-actin为内参基因,计算其表达值。用SPSS17.0软件统计分析,组间比较采用单因素方差分析。可见VEGF-D的mRNA在淋巴结转移CAFs明显升高(P<0.05),见表2与图4。
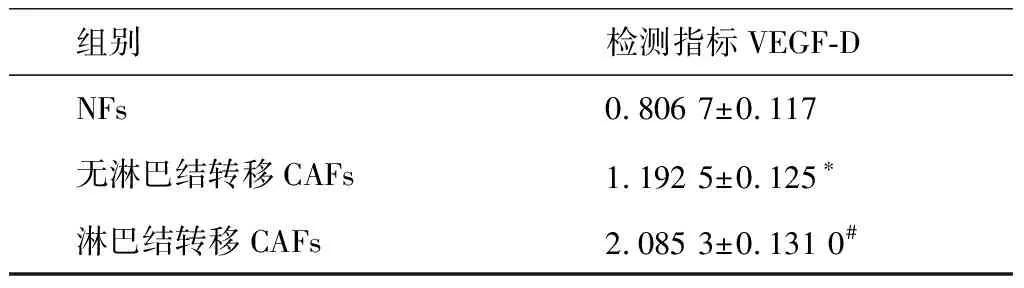
表2 NFs、CAFs表达VEGF-D mRNA均值
*P<0.05,与NFs组比较;#P<0.05,与无淋巴结转移CAFs组比较。

3 讨论
口腔癌发病率较高,位居全身恶性肿瘤的第6位。鳞状细胞癌是口腔肿瘤中最常见的恶性肿瘤,约占90%以上,治疗后5年生存率仍然徘徊在50%左右。颈淋巴结转移是口腔癌早期常见的转移途径,其转移率高达37%~58%,只要有同侧或对侧单个淋巴结转移,其生存率会降低50%左右,这是导致早期OSCC治疗失败的重要原因[5]。所以,OSCC的淋巴结转移对于其预后评估和治疗方法的选择具有重要意义。肿瘤的发生、发展与微环境密切相关,肿瘤细胞与间质的相互作用,既保证其生存又促进其向恶性发展和转移。在实体肿瘤的微环境中,成纤维细胞是最丰富的一类细胞,已有大量研究表明,肿瘤微环境中的CAFs与正常成纤维细胞不同,已经发生表型及功能的改变,在介导OSCC的发生、调节发展、促进血管生成及调控免疫信号等方面起核心作用[6-9]。但对于CAFs在口腔鳞癌淋巴管生成的作用却少有研究。因此,本课题旨在探究CAFs是否促进淋巴管的生成,在OSCC的淋巴结转移中是否起作用。
淋巴管在肿瘤的生长、转移中起着重要作用。首先,在肿瘤生长早期,其营养物质主要靠弥散方式及微淋巴管提供;其次,肿瘤淋巴管是肿瘤细胞转移的重要途径 。VEGF是调节血管生成的最重要因子之一,在肿瘤新生血管生成中起着重要的作用。VEGF-C/D是淋巴管生成因子,能诱导肿瘤淋巴管的生成,进而促进淋巴结转移。已有研究表明VEGF-C在乳腺癌、前列腺癌、肺癌组织中增高表达,并对促进淋巴管转移有作用[10-12]。VEGF-D基因定位于性染色体Xp22.31上,全场50 kb,1998年由Achen等确认为VEGF家族中的新成员。Karnezis等[13]在对乳腺癌的研究中发现,VEGF-D能促进前列腺素的分泌,扩张淋巴管,从而促进肿瘤细胞经淋巴管的转移(Cancer Cell,2012)。对于口腔CAFs是否分泌VEGF-D,是否促进OSCC的淋巴结转移目前未见有相关研究。
在本研究中,我们首先用组织块培养法获得口腔CAFs,用差速胰酶消化法纯化细胞,3~4代CAFs能很好的纯化而没有癌上皮细胞的污染。用倒置相差显微镜观察细胞形态及生长情况,用cytokeratin、vimentin、α-SMA进行表达蛋白的鉴定,发现CAFs与NFs相比,生长增殖速度快,密度抑制和接触抑制丧失,细胞排列无序;Vimentin、α-SMA 染色均为阳性,Cytokertain染色为阴性,具有CAFs的基本生物学特性。对所获得的CAFs和NFs细胞进行VEGF-D的细胞免疫组化和免疫荧光的对比研究,证明了CAFs和NFs均表达VEGF-D,但CAFs表达高于NFs,且有淋巴结转移的CAFs高于无淋巴结转移的CAFs。通过RT-PCR检测VEGF-D mRNA的表达量,用2-ΔΔCT法计算与内参基因β-actin的比值,分别为0.806 7±0.117、1.192 5±0.125、2.085 3±0.131。结果显示,VEGF-D mRNA表达水平在淋巴结转移的CAFs明显升高。以上实验初步证明了口腔CAFs分泌VEGF-D较NFs有所升高,其表达水平升高可促进口腔鳞癌的淋巴结转移。
口腔CAFs能够影响肿瘤微环境中的肿瘤细胞、内皮细胞、炎性细胞等,促进肿瘤细胞的生长增殖,通过增加分泌VEGF、VEGF-D促进OSCC的血管和淋巴管转移,显示其在口腔癌发生发展中的重要作用[14-15]。CAFs靶向肿瘤治疗旨在对其进行特异性生物学干扰,同时抑制其在肿瘤发生发展各方面的介导作用。这既可以干扰肿瘤进展转移的能力,又可以克服针对癌细胞治疗的耐药性。本研究仅对CAFs表达VEGF-D进行了研究,对其调控机制及信号传导均有待深入研究。
【参考文献】
[1] Pasini FS,Maistro S,Snitcovsky I.Four-Gene expression model predictive of lymph node metastases in oral squamous cell carcinoma [J].Acta Oncologica, 2012,51(1):77-85
[2] Fang H,DeClerck YA.Targeting the tumor microenvironment:from understanding pathways to effective clinical trials[J].Cancer Res,2013,73(16):4965-4977
[3] Reisfeld RA.The tumor microenvironment:a target for combination therapy of breast cancer [J].Crit Rev Oncog,2013,18(1-2):115-133
[4] Yang X,Zhang X,Fu ML,et al.Targeting the tumor microenvironment with interferon-β bridges innate and adaptive immune responses[J].Cancer Cell,2014,25(1):37-48
[5] Bhowmick NA,Neilson EG,Moses HL.Stromal fibroblasts in cancer initiation and Progression [J].Nature,2004,432 (7015):332-337
[6] Liu Y,Hu T,Shen J,et al.Separation,cultivation and biological characteristics of oral carcinoma-associated fibroblasts [J].Oral Dis,2006,12(4):375-380
[7] Lin JW,Liu CX,Ge L,et al.Carcinoma-associated fibroblasts promotes the proliferation of a lingual carcinoma cell line by secreting keratinocyte growth factor [J].Tumor Biology,2011,32(3):597-602
[8] Paolo C,Paola C.Cancer associated fibroblasts:the dark side of the Coin [J].Am J Cancer Res,2011,1(4):482-497
[9] Orimo A,Gupta PB,Sgrol DC,et al.Stromal fibroblasts present in invasive human breast carcinomas promote tumor growth and angiogenesis through elevated SDF-1/CXCL12 secretion[J].Cell,2005,121(3):335-348
[10] Rak J.VEGF-D (ilated) Lymphatics as Gateways to Metastasis [J].Cancer Cell,2012,21 (2):139-140
[11] Stacker SA,Caesar C,Baldwin ME,et al.VEGF-D promotes the metastatic spread of tumor cells via the lymphatics [J].Nat Med,2001,7(2):186-191
[12] Rissanenn TT,Markkanen JE,Gruchala M,et al.VEGF-D is the strongest angiogenic and lymphangiogenic effector among VEGFs delivered into skeletal muscle via adenoviruses[J].Circulation Research,2003,92(10):1098-1106
[13] Karnezis T,Shayan R,Caesar C,et al.VEGF-D promotes tumor metastasisby regulating prostaglandins produced by the collecting lymphatic endothelium [J]. Cancer Cell,2012,21(2):181-195
[14] Stacker SA,Caesar C,Baldwin ME,et al .VEGF-D promotes the metastatic spread of tumor cells via the lymphatics [J].Nat Med,2001,7(2):186-191
[15] Robert RJ.Vascular endothelial growth factor (VEGF) signaling in tumor Progression [J].Critical Reviews in Oncology/Hematology,2007,62(3):179-213
