半封闭状态下电解制备氢氧化亚铁
2014-03-16梁金玲张爱菊
梁金玲 张爱菊
(甘肃省平凉医学高等专科学校 甘肃平凉 744000)
半封闭状态下电解制备氢氧化亚铁
梁金玲 张爱菊
(甘肃省平凉医学高等专科学校 甘肃平凉 744000)

电解;氢氧化亚铁
常规法制备Fe(OH)2成功率不高,一是很难看到有白色沉淀产生;二是颜色变化莫测,不利于学生实验和教师演示。电解法制备有报道,但靠自身电解所得氢气隔绝氧气很难凑效,现象不够明显。本文采用通氢除氧热电解制备Fe(OH)2,实验改进后能确保白色絮状沉淀30分钟保持不变。
一、实验用品
Na2SO4溶液、稀盐酸、导线、学生电源、碳棒、铁电极(5cm铁钉代)、砂纸、导气管(输液管代替,可活动)。
二、实验装置
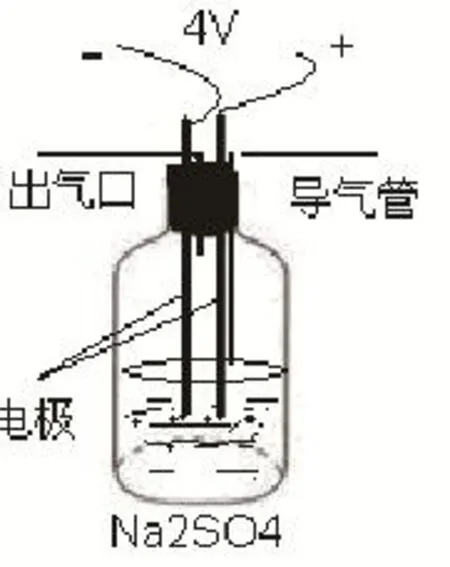
图1 电解制备氢氧化亚铁装置图
三、实验原理
阴极附近产生的OH-与阳极溶解产生的Fe2+结合生成Fe(OH)2。方程式为:
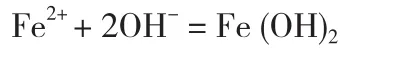
四、实验步骤
1.电极活化处理
用砂纸打磨铁电极,然后将两电极浸入稀盐酸中,除去电极表面的氧化层,蒸馏水冲洗,滤纸擦干即用。
2.电解液通氢除氧处理
将100mL新烧煮的Na2SO4倒入原装置广口瓶中,加盖,将氢气导气管(可活动)伸入到溶液底层,通氢除氧3分钟。
3.电解制备Fe(OH)2
将导气管移至溶液表面,继续通氢气,按如图1所示装置接通直流电源,将电压调至4V,观察Fe(OH)2白色絮状沉淀生成过程。
五、现象分析
通电后可看到阴极有气体产生;阳极瞬间变黑,表层有黑色粉末状物质生成(见图2);2分钟后,阳极周围缠绕着一层白色絮状物,半小时内未出现变色(见图3),这是因为在半密封状态下,电解质溶液完全处于H2的保护下,无氧环境有利于Fe(OH)2稳定存在。

图2

图3
新煮沸Na2SO4效果明显优于文献[1]中提到的冷沸水溶解Na2SO4。通过烧煮,一方面实现随机除氧;另一方面,温度升高促使电极反应速率加快,瞬间有大量Fe2+和OH-生成。
持续电解5分钟,白色絮状物Fe(OH)2增加,同时将有部分黑色颗粒物脱离电极表层向周边扩散,影响外观形态及纯洁度,所以要把最佳电解时间控制在3分钟内。
实验后,刮取阳极表层黑色粉末状物质,用盐酸浸泡,仍处于固体状态,未出现气体放出,说明该物质为单质碳。在黑色碳粒未脱落情况下,足以保证Fe(OH)2呈纯白色絮状沉淀。
[1]郑雅敏.关于用电解原理制取白色氢氧化亚铁的研究[J].化学教学,2007,4.
The electrolytic preparation of ferrous hydroxide under semi closed state
Liang Jin-ling, Zhang Ai-ju
(Gansu Pingliang Medical College, Pingliang Gansu,744000, China)
Objective: To put forward the new schemes of electrolytic preparation of Fe(OH)2. Methods: in the hydrogen oxygen and hydrogen atmosphere, the nails as electrode, low voltage electrolytic Na2SO4to prepare Fe(OH)2. Results: the anode to generate white floc of Fe(OH)2, form is stable, save for a long time. Significance: the operation is simple, phenomenon is obvious, easy projection demonstration.
electrolysis; ferrous hydroxide
G633.8
A
1000-9795(2014)03-0037-01
[责任编辑:董 维]
2014-01-17
梁金玲(1980-),女,甘肃平凉人,讲师,从事物理教育方向的研究。
张爱菊(1981-),女,甘肃定西人,讲师,从事分析化学方向的研究。
