Ezrin介导中性粒细胞弹性蛋白酶诱导的人气道上皮细胞株分泌黏蛋白增加
2014-03-15尤列皮尔曼维克多科罗索夫周向东
李 琪,李 娜,尤列.皮尔曼,维克多.科罗索夫,周向东*
(1.重庆医科大学第二附属医院呼吸内科,重庆400010;2.俄罗斯医学科学院远东呼吸生理与病理研究中心,布拉戈维申斯克675000)
慢性阻塞性肺疾病急性加重期及哮喘重度发作尤其是致死性哮喘发作的患者,中性粒细胞在气道大量募集,气道黏液常呈“爆发式”分泌状态,短时期内急剧增多的黏液致广泛黏液栓形成,出现严重气道阻塞、导致窒息甚至死亡。此现象与细胞的胞吐行为密切相关。胞吐行为主要归因于细胞的极性活动。Ezrin 作为膜连接蛋白(ezrin/radixin/moesin,ERM)家族的一员,是膜蛋白和肌动蛋白细胞骨架间确切的连接分子,存在于富含肌动蛋白的表面结构,在肺组织里也有明显表达,其能参与细胞的多种功能活动如细胞黏附、迁移以及细胞表面结构的组装,与细胞的运动及极性分泌有关[1]。故此推测,Ezrin 是否与气道上皮细胞的极性分泌有关?是否参与气道的黏液分泌过程?本研究以中性粒细胞弹性蛋白酶(neutrophil elatase,NE)作为气道黏蛋白(mucin,MUC)主要病理性表型MUC5AC 分泌的诱导因素,对Ezrin 在其中的作用作一探讨,以期明确气道炎性反应时黏蛋白胞吐的潜在动力机制。
1 材料与方法
1.1 材料
人气道上皮HBE16 细胞株(上海复祥生物科技有限公司);pEGFP-N1-Ezrin-Wt、pEGFP-N1-Ezrin-T567D 和 pEGFP-N1-Ezrin-T567A (法国 Monique Arpin 教授馈赠);pEGFP-N1 空载体(Clontech 公司);DEME/Ham's F12 培养基、HEPES、Trizol 和小牛血清(Sigma 公司);NE(Calbiochem 公司);兔抗Ezrin(H-276)多克隆抗体、HRP-羊抗兔抗体、HRP-兔抗鼠抗体(Santa Cruz 公司);小鼠抗MUC5AC 45M1 单克隆抗体(Neomarkers 公司);OPTI-MEM 无血清培养基培养(Invitrogen 公司);X-treme GENE9DNA 转染试剂(Roche 公司);MMLV(重组鼠白血病病毒反转录酶)第一链cDNA 合成试剂盒(上海生工生物工程技术服务有限公司);其余试剂均为国产分析纯。
1.2 方法
1.2.1 重组质粒的双酶切鉴定:提取纯化各组质粒,分别以限制性内切酶Xho Ⅰ及BamH Ⅰ各0.5 μL加入反应体系进行酶切,37 ℃水浴酶切反应2 h。酶切完成后进行电泳分析。
1.2.2 细胞转染:处于对数生长期的细胞数调整浓度至每孔(1 ~2)×105个/mL,细胞汇合达30% ~50%左右,以OPTI-MEM 无血清培养基培养,加入4 μL X-treme GENE9DNA 转染试剂混匀,加入重组质粒转染细胞,按操作说明进行。于37 ℃、5% CO2湿度培养箱孵育,4 ~6 h 换液1 次,24 h 后进行细胞处理并行相关检测。
1.2.3 细胞的培养及分组处理:于6 孔培养板中培养HBE16 气道上皮细胞每孔5 ×105个/mL,加入2 mL DMEM/Ham's F12 培养液(含10% 小牛血清),37 ℃、5% CO2湿度培养箱孵育,常规换液培养,当细胞汇合达70% ~80%时传代,调整细胞浓度至2 ×105个/mL并分组:1)空白对照组:无血清DMEM/Ham's F12 液中继续培养;2)NE 刺激组:培养液中加入NE 0.5 μmol/L;3)pEGFP-N1 组:细胞转染pEGFP-N1 后,无血清DMEM/Ham's F12 液中常规换液培养,不予其他处理;4)pEGFP-N1-Ezrin-Wt组:细胞转染野生型pEGFP-N1-Ezrin-Wt 后,无血清DMEM/Ham's F12 液中常规换液培养,不予其他处理;5)NE + pEGFP-N1-Ezrin-Wt 组:以pEGFP-N1-Ezrin-Wt 转染细胞后再加入NE 0.5 μmol/L;6)NE+pEGFP-N1-Ezrin-T567D 组:pEGFP-N1-Ezrin-T567D 中Ezrin 苏氨酸Thr567 定点突变为天冬氨酸Asp,模拟永久磷酸化Ezrin。以其转染细胞后再加入NE 0.5 μmol/L;7)NE + pEGFP-N1-Ezrin-T567A 组:pEGFPN1-Ezrin-T567A 中Ezrin 苏氨酸Thr567 定点突变为丙氨酸Ala,模拟被遏制磷酸化的Ezrin。以其转染细胞后再加入NE 0.5 μmol/L。由NE 作用的剂量、时间曲线分析选择浓度为0.5 μmol/L作用30 min(表1)。各组均3 个复孔,继续培养30 min 后分别收集培养上清和细胞行相关检测,每组重复实验3 次。
1.2.4 MTT 检测各组细胞的活力:96 孔板中每孔按浓度1×104个/mL加入200 μL 细胞悬液,以上处理组各6 个复孔,37 ℃、5% CO2湿度培养箱孵育,分别取10、20、30 和60 min 时间点行MTT 测定。吸除各孔旧培养液,加入200 μL/孔无血清的RPMI-1640 培养液及20 μL/孔MTT 液(5 g/L),放入37 ℃、5%CO2、饱和湿度培养箱内培养4 h,吸除各孔原液后加入150 μL/孔二甲基亚砜(DMSO),微量振荡器振荡15 min,自动酶标读数仪(TECAN sunrise remote 奥地利)以570 nm 波长测定各孔吸光度(A)值。
1.2.5 实时荧光定量PCR 法检测MUC5AC mRNA水平:Trizol 法分别提取各组细胞内总RNA,经鉴定,样品A260/A280比值均介于1.8 ~2.0,初步定量后保存于-20℃备用。两步法行RT-PCR。cDNA 反转录反应按PrimeScript 反转录试剂盒说明进行。MUC5AC上游引物:5'-CAGCCACGTCCCCTTCAATA-3',下游引物:5'-ACCGCATTTGGGCATCC-3'。GAPDH 上游引物:5'-GGGAAGGTGAAGGTGGGAGTG-3',下游引物:5'-AGC AGAGGGGGCAGAGATGAT-3'。反应参数:94 ℃预变性3 min,后紧随35 个循环,循环参数:94 ℃45 s,58 ℃30 s,70 ℃60 s,后72 ℃延伸5 min采用2-△△CT方法分析目的基因mRNA 相对表达量。CT 是荧光达到荧光阈值的循环数,△△CT=(CT 目的基因-CT 管家基因)实验组-(CT 目的基因-CT 管家基因)对照组。
1.2.6 ELISA 法检测细胞及培养上清MUC5AC 蛋白含量:RIPA 裂解液裂解细胞,提取细胞总蛋白,测定并调整蛋白浓度备用;收集细胞培养上清液并测定蛋白含量备用。以提取的细胞蛋白或培养上清液于40 ℃包被96 孔酶标反应板,干燥,以PBS 清洗酶标板3 次,2%小牛血清室温封闭1 h;再次PBS洗涤3 次,加入小鼠抗MUC5AC 单克隆抗体45M1(1∶100,用含0.05%吐温20 (Tween-20)的PBS 稀释至50 μL),孵育1 h;洗涤3 次,加入100 μL 辣根过氧化物酶-羊抗小鼠IgG(1∶10 000)孵育1 h;四甲基联苯胺过氧化物酶溶液显色,终止反应后测各孔吸光度A 值(λ =450 nm),与标准品比较而得到MUC5AC 的相对值。
1.2.7 免疫荧光观察Ezrin 在HBE16 气道上皮细胞的表达:贴壁生长良好的HBE16 气道上皮细胞经消化后,调整细胞浓度为1 ×105个/mL,接种于24孔板中8 mm×8 mm 小玻片进行培养。细胞汇合约70%左右后,换用无血清培养液维持24 h,分组进行不同处理。吸弃培养液,PBS 漂洗。4%多聚甲醛室温下固定30 min,PBS 漂洗后以0.4%聚乙二醇辛基苯基醚Triton-X 100 作用20 min,PBS 冲洗加5%羊血清封闭30 min。倾去血清后滴加兔抗Ezrin 多克隆抗体(1∶500;1 mg/L),置湿盒内4 ℃过夜。PBS 漂洗后加FITC 标记的羊抗兔IgG(1∶500),置湿盒内室温下孵育30 min,PBS 清洗后滴加5 g/mL PI,孵育5 min 后PBS 漂洗5 min ×3 次。50%的甘油封片,激光共聚焦显微镜观察,以QuantReport 软件分析细胞荧光强度。
1.3 统计学分析
表1 各组MTT 吸光度(A)值Table 1 MTT absorbance value in different cell groups (±s,n=6)
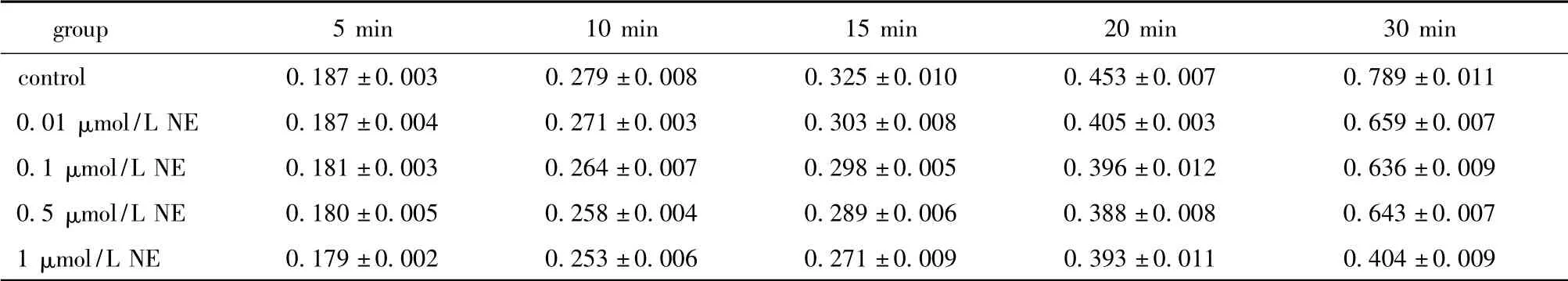
表1 各组MTT 吸光度(A)值Table 1 MTT absorbance value in different cell groups (±s,n=6)
group5 min10 min15 min20 min30 min control0.187 ±0.0030.279 ±0.0080.325 ±0.0100.453 ±0.0070.789 ±0.011 0.01 μmol/L NE0.187 ±0.0040.271 ±0.0030.303 ±0.0080.405 ±0.0030.659 ±0.007 0.1 μmol/L NE0.181 ±0.0030.264 ±0.0070.298 ±0.0050.396 ±0.0120.636 ±0.009 0.5 μmol/L NE0.180 ±0.0050.258 ±0.0040.289 ±0.0060.388 ±0.0080.643 ±0.007 1 μmol/L NE0.179 ±0.0020.253 ±0.0060.271 ±0.00 90.393 ±0.0110.404 ±0.009
2 结果
2.1 重组质粒的双酶切鉴定结果
分别在4 700 bp、1 801 bp 左右出现目的条带,与预期的pEGFP-N1 和Ezrin 目的基因片段长度一致(图1)。
2.2 各组中细胞增殖的变化
各处理因素对细胞的增殖活力无明显影响(表2)。

图1 重组质粒的双酶切鉴定结果Fig 1 Indentification of recombinant constructs by restriction enzyme
2.3 pEGFP-N1-Ezrin 各突变体对MUC5AC 蛋白及MUC5AC mRNA 含量的影响
转染pEGFP-N1-Ezrin-T567D 的细胞经NE 刺激后,分泌至上清液的MUC5AC 蛋白含量较单纯NE 刺激组有明显上升(P<0.01),但细胞内MUC5AC 蛋白含量及MUC5AC mRNA 水平则无明显变化。而pEGFP-N1-Ezrin-T567A 转染组在NE刺激后,上清液中MUC5AC 蛋白含量与单纯NE组相比有明显下降(P<0.05),胞浆MUC5AC 蛋白含量却较单纯NE 刺激组有所升高(P<0.05);而MUC5AC mRNA 水平与单纯NE 刺激组相比无差别(表3)。
2.4 pEGFP-N1-Ezrin 各突变体对Ezrin 蛋白细胞内表达及分布的影响
转染pEGFP-N1-Ezrin-T567D 的细胞经NE 刺激后,细胞内Ezrin 表达较野生型pEGFP-N1-Ezrin-Wt转染组及NE 刺激组明显增强,且胞膜分布增多(P<0.05)。pEGFP-N1-Ezrin-T567A 转染组在NE刺激后,Ezrin 蛋白表达较野生型pEGFP-N1-Ezrin-Wt 转染组无明显变化;而与pEGFP-N1-Ezrin-T567D组相比,表达有明显减少,且未出现向胞膜聚集的趋势(P<0.05)(图2,表4)。
表2 各组MTT 吸光度(A)值Table 2 MTT absorbance value in different cell groups(±s,n=6)
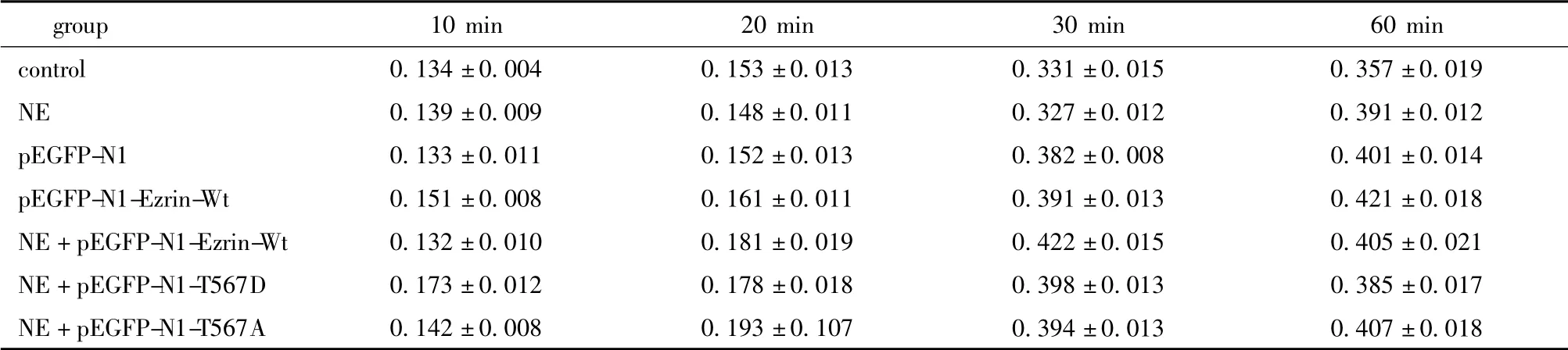
表2 各组MTT 吸光度(A)值Table 2 MTT absorbance value in different cell groups(±s,n=6)
group10 min20 min30 min60 min control0.134 ±0.0040.153 ±0.0130.331 ±0.0150.357 ±0.019 NE0.139 ±0.0090.148 ±0.0110.327 ±0.0120.391 ±0.012 pEGFP-N10.133 ±0.0110.152 ±0.0130.382 ±0.0080.401 ±0.014 pEGFP-N1-Ezrin-Wt0.151 ±0.0080.161 ±0.0110.391 ±0.0130.421 ±0.018 NE+pEGFP-N1-Ezrin-Wt0.132 ±0.0100.181 ±0.0190.422 ±0.0150.405 ±0.021 NE+pEGFP-N1-T567D0.173 ±0.0120.178 ±0.0180.398 ±0.0130.385 ±0.017 NE+pEGFP-N1-T567A0.142 ±0.0080.193 ±0.107 0.394 ±0.0130.407 ±0.018

Table 表33T h各e l组ev细els胞 of中 M黏U蛋C5白AC5AiCn e含ac量h 检gr测ou结p 果(x比±较s,n=3)

图2 免疫荧光检测各组Ezrin 蛋白的表达Fig 2 Expression of Ezrin protein detected by immunofluorescence (×100)
表4 各组细胞中Ezrin 蛋白表达相对荧光强度Table 4 The Ezrin protein expression in each group(±s,n=3)

表4 各组细胞中Ezrin 蛋白表达相对荧光强度Table 4 The Ezrin protein expression in each group(±s,n=3)
#P<0.01,*P<0.01 compared with pEGFP-N1 group;*P<0.05 compared with NE+pEGFP-N1-Ezrin-Wt group.
groupfluorescence intensity pEGFP-N128.97 ±5.36 NE+pEGFP-N140.64 ±7.05 NE+pEGFP-N1-Ezrin-Wt48.85 ±9.32#NE+pEGFP-N1-Ezrin-T567D59.43 ±8.41*NE+pEGFP-N1-Ezrin-T567A41.82 ±4.16
3 讨论
气道黏液的基础性分泌是呼吸系统的重要屏障,具有异物清除、气道微环境保护等功能。而病原体、炎性介质、蛋白酶等可诱导细胞胞吐动作的发生,使黏液呈“爆发式”分泌状态[2-3]。细胞黏液胞吐分泌是一复杂的生物动力学过程,有众多分子参与。研究发现,膜骨架相关蛋白ERM 家族中的Ezrin 具有连接膜蛋白和细胞骨架的作用,与细胞运动及极性分泌有关[4]。Ezrin 蛋白是多种氨基酸激酶的底物,磷酸化是Ezrin 蛋白活性的重要调节方式[5]。Ezrin 的保守磷酸化位点位于Ezrin Thr 567和Thr564[6]。其中EzrinThr567 还参与胃壁细胞的极性形成[7]、细胞表面膜皱褶及微绒毛的形成[8]。
既往研究证实,NE 是一极强的黏液促动剂,能通过促进黏蛋白表达及胞吐增加使气道呈现黏液高分泌状态[9]。本研究结果显示,经NE 刺激及转染野生型pEGFP-N1-Ezrin-Wt 后,细胞中Ezrin 蛋白表达明显增加,在胞膜的聚集亦明显增多;而模拟Ezrin 永久磷酸化的载体pEGFP-N1-Ezrin-T567D 转染组,Ezrin 蛋白表达增加更为显著,主要积聚于胞膜。细胞经转染模拟被遏制磷酸化Ezrin 的载体pEGFP-N1-Ezrin-T567A 后,Ezrin 在胞膜的表达明显减少,散在分布于胞质。说明NE 能诱导细胞中Ezrin 向细胞顶膜定位,而在磷酸化载体pEGFP-N1-Ezrin-T567D 转染组中,该引导作用更为显著。
pEGFP-N1-Ezrin-T567D 转染组细胞培养上清中MUC5AC 的蛋白水平较单纯NE 组及pEGFP-N1-Ezrin-Wt 组有明显增加。但胞质中MUC5AC 蛋白水平却显示有减少,表明Thr567 永久磷酸化的Ezrin 与野生型Ezrin 相比,更能增加黏蛋白MUC5AC 的胞吐外分泌,使得胞内贮存的MUC5AC相对减少。但就胞内胞外分泌的蛋白总量而言,野生型Ezrin 载体组和磷酸化Ezrin 载体组并无显著差异。提示Ezrin Thr567 磷酸化对MUC5AC 蛋白的合成并无显著影响,但在MUC5AC 从胞质向胞外分泌的过程中起着积极推动作用。
此外,pEGFP-N1-Ezrin-T567A 组中,分泌至培养上清的MUC5AC 蛋白较对照组相比,有明显减少,而胞质中MUC5AC 蛋白含量则高于对照组。表明若EzrinTh567 位点丧失磷酸化功能,NE 尚能刺激MUC5AC 蛋白合成,但其的胞外分泌过程则较EzrinThr567 磷酸化功能正常的野生型载体组明显减少,导致胞内贮存的MUC5AC 蛋白含量相对增高。
综上,本实验表明,Ezrin 是NE 诱导的气道黏蛋白分泌的重要促动因子,其Thr567 位点磷酸化可能起着关键作用。
[1]Stapleton G,Malliri A,Ozanne BW.Downregulated AP-1 activity is associated with inhibition of Protein-Kinase-C-dependent CD44 and ezrin localisation and upregulation of PKC theta in A431 cells[J].J Cell Sci,2002,115:2713-2724.
[2]Chen EY,Garnica M,Wang YC,et al.Mucin secretion induced by titanium dioxide nanoparticles[J].PLoS One,2011,6:e16198.doi.10.1371./journal.pone.0016198.
[3]Curran DR,Cohn L.Advances in mucous cell metaplasia:a plug for mucus as a therapeutic focus in chronic airwaydisease[J].Am J Respir Cell Mol Biol,2010,42:268-275.
[4]Liu Y,Belkina NV,Park C,et al.Constitutively active ezrin increases membrane tension,slows migration,and impedes endothelial transmigration of lymphocytes in vivo in mice[J].Blood,2012,119:445-453.
[5]Zhu L,Crothers J,Zhou R,et al.A possible mechanism for ezrin to establish epithelial cell polarity[J].Am J Physiol Cell Physiol,2010,299:431-443.
[6]Zhu L,Zhou R,Mettler S,et al.High turnover of ezrin T567 phosphorylation:conformation,activity,and cellular function[J].Am J Physiol Cell Physiol,2007,293:874-884.
[7]Chen EJ,Shaffer MH,Williamson EK,et al.Ezrin and moesin are required for efficient T cell adhesion and homing to lymphoid organs[J].PLoS One,2013,8:e52368.doi:10.1371/journal.pone.0052368.
[8]Zwaenepoel I,Naba A,Da Cunha MM,et al.Ezrin regulates microvillus morphogenesis by promoting distinct activities of Eps8 proteins[J].Mol Biol Cell,2012,23:1080-1094.
[9]Shao MX,Nadel JA.Neutrophil elastase induces MUC5AC mucin production in human airway epithelial cells via a cascade involving protein kinase C,reactive oxygen species,and TNF-alpha-converting enzyme[J].J Immunol,2005,175:4009-4016.
