FISH检测宫颈上皮内瘤变及其旁组织中hTERC基因表达的变化及意义*
2014-03-15曹志星吕威赵晔莫海波谢亚峰吴晓媚李玉梅周宾范思格陈细妹
曹志星吕威赵晔莫海波谢亚峰吴晓媚李玉梅周宾范思格陈细妹
FISH检测宫颈上皮内瘤变及其旁组织中hTERC基因表达的变化及意义*
曹志星①吕威①赵晔①莫海波①谢亚峰①吴晓媚①李玉梅①周宾①范思格①陈细妹①
目的:检测宫颈活检组织中上皮内瘤变(CIN)及其旁组织中hTERC基因的表达情况,对比分析其阳性率的变化,试图找到基因水平上CIN手术治疗范围。方法:采用荧光原位杂交技术(FISH)检测63例宫颈活检标本中hTERC基因的表达变化情况。结果:宫颈高级别上皮内瘤变(HSIL)区、瘤变边缘≤1 mm、1 mm<瘤变边缘≤2 mm、2 mm<瘤变边缘≤3 mm以及3 mm<瘤变边缘≤4 mm的hTERC基因阳性率分别为100%、92.31%、87.18%、64.10%和30.77%,其中,HSIL与瘤变边缘2 mm以内范围各点比较差异无统计学意义(P>0.05);HSIL与瘤变边缘2 mm以外范围各点比较差异有统计学意义(P<0.05);宫颈低级别上皮内瘤变(LSIL)区、瘤变边缘≤1 mm范围、1 mm<瘤变边缘≤2 mm、2 mm<瘤变边缘≤3 mm以及3 mm<瘤变边缘≤4 mm的hTERC基因阳性率分别为41.67%、25.00%、4.17%、4.17%和4.17%,其中,LSIL与瘤变边缘1 mm以内范围各点比较差异无统计学意义(P>0.05),而LSIL与瘤变边缘1 mm以外范围点比较差异有统计学意义(P<0.05)。结论:活检标本中,随着距瘤变区范围的增加,hTERC基因的阳性率明显下降,其中,距瘤变边缘>2 mm和>1 mm或许可以分别作为HSIL和LSIL基因水平上(更精确意义上的)CIN的手术治疗范围。
荧光原位杂交; 宫颈上皮内瘤变; hTERC基因; 宫颈活检组织; 手术治疗范围
在世界范围内,女性宫颈癌发病率居女性生殖系统恶性肿瘤第2位[1]。近年来,其发病呈年轻化趋势,但因宫颈癌有较长的癌前病变期,早期诊断及合理治疗便成为改善预后的关键[2]。目前研究得知,宫颈细胞由非典型性异常病变细胞转化成癌细胞的过程中几乎都伴有3号染色体长臂的扩增,其中涉及到的最重要的基因可能是人染色体末端酶基因(human telomerase gene,hTERC),它有望成为非典型细胞癌变的基因[3]。Heselmeyer-haddad等[4]研究认为hTERC基因可以作为预测高度病变(HSIL)的指标,随访这些病例1~3年后,hTERC基因扩增病例中CINⅠ/Ⅱ进展到CINⅢ多于hTERC基因不扩增病例,表明特异的基因组改变是CIN发展到宫颈癌所必需的[5]。同时,多项研究表明,采用FISH技术检测宫颈细胞hTERC基因的阳性率,可作为宫颈上皮内瘤变由低级别进展到高级别的指标,还可以提高宫颈癌前病变的筛查几率,是一种损伤较小的、比较可靠的检测手段[6-10]。有研究报道不同制片方法中,hTERC基因杂交成功率石蜡包埋组织切片为85.7%,其荧光信号满意率也最高,且在指导宫颈病变及宫颈癌的治疗中,石蜡包埋组织切片法的染色体破坏最小,实际意义更大。因而,不同于以往的使用脱落细胞进行的研究,本实验全部采用组织活检标本。同时,除检测CIN处的hTERC基因阳性率外,还对病变旁组织做不同范围的hTERC基因表达研究,试图找到规律性变化,探讨基因水平上CIN的手术治疗范围。现报道如下。
1 材料与方法
1.1 材料 选取2013年10月-2014年7月本院宫颈组织活检标本63例,每例均完整包含连续的瘤变组织及其旁组织(距瘤变边缘≥4 mm)。其中,低级别病变24例,高级别病变39例,年龄22~62岁,取标本前所有患者均未进行放疗、化疗及其他特殊治疗。另外选取20例正常宫颈组织活检标本建立阈值。
1.2 FISH探针 北京金菩嘉医疗科技有限公司生产的TERC/CSP3 DNA双色探针。TERC基因标记在3q26.3位点,CSP3 DNA标记在3号染色体着丝粒处(3q11.1-q11.1),分别用红色和绿色荧光信号标记,以CSP3探针作为对照。
1.3 方法
1.3.1 样本制备 将普通载玻片清洗干净后,涂多聚赖氨酸以防脱片,自然晾干备用。将预先筛选出的石蜡包埋组织做2 μm连续切片,展开后捞片,置70 ℃烤箱中2 h。
1.3.2 样本预处理 将玻片置于二甲苯中脱蜡,两缸,各10 min,依次经100%乙醇、85%乙醇、75%乙醇至去离子水,各1缸,各2 min,然后置于火力60的微波炉内水煮20 min,在2×SSC溶液中浸泡5 min后晾干,加胃蛋白酶20 μL(20 mg/mL),消化5 min左右,室温下2×SSC溶液中漂洗2次,5 min/次。最后将玻片依次置于75%乙醇、85%乙醇、100%乙醇各2 min脱水,烤片至56 ℃,干燥备用。
1.3.3 杂交 避光环境中,将探针混合液10 μL(2 μL探针,8 μL杂交缓冲液)滴于玻片杂交区域,加上盖玻片,封胶;83 ℃水浴中变性5 min,将玻片置于预热的湿盒中,42 ℃恒温培养箱中过夜杂交。
1.3.4 洗片 第2天在暗处移去盖玻片,依次经46 ℃预热的2×SSC溶液和NP40溶液(40 mL 2×SSC溶液,40μL NP40洗涤液)洗涤,各1缸,分别为10 min和5 min,70%乙醇浸泡3 min,自然干燥,滴加15 μL DAPI(联咪二苯吲哚)复染剂,加盖玻片,分析。
1.4 FISH信号分析 复染后的玻片用OLYMPUS B×51荧光显微镜在DAPI/FIFC/RHOD三色滤光镜激发下,观察间期细胞的荧光杂交信号。
1.5 阈值建立 20例正常宫颈组织活检标本,在100×10油镜下观察,每例随机计数100个细胞。单个间期细胞核中红绿信号比2:2为正常细胞;红色信号>2个,绿色信号≥2个判断为阳性细胞。计算每例出现阳性细胞的百分比,建立阈值,阈值=平均数(x)+3×标准差(SD)。本例阈值为8.66%,取整数9。
1.6 结果判定 100×10倍油镜下观察,每例随机计数100个间期细胞,单个间期细胞核中红绿信号比2∶2为正常细胞;红色信号>2个,绿色信号≥2个判断为阳性细胞。记录红绿信号数hTERC:CSP3,阳性细胞个数≥阈值(本实验为9个)为hTERC基因扩增阳性。
1.7 统计学处理 采用SPSS 13.0统计学软件对数据进行处理,计数资料比较采用 χ2检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 宫颈活检正常组织中hTERC基因的扩增情况 宫颈活检正常组织中hTERC基因偶尔可见扩增情况,大部分hTERC:CSP3呈2:2状态,见图1。

图1 正常组织中hTERC基因的扩增情况
2.2 宫颈活检高级别上皮内瘤变(HSIL)区及其旁组织中hTERC基因的扩增情况 宫颈高级别上皮内瘤变(HSIL)区、瘤变边缘≤1 mm、1 mm<瘤变边缘≤2 mm、2 mm<瘤变边缘≤3 mm以及3 mm<瘤变边缘≤4 mm的hTERC基因阳性率分别为100%、92.31%、87.18%、64.10%和30.77%,其中,HSIL与瘤变边缘≤1 mm、1 mm<瘤变边缘≤2 mm比较差异无统计学意义(χ2=5.10,P>0.05;χ2=3.20,P>0.05);HSIL与2 mm<瘤变边缘≤3 mm、HSIL与3 mm<瘤变边缘≤4 mm、1 mm<瘤变边缘≤2 mm范围与2 mm<瘤变边缘≤3 mm、2 mm<瘤变边缘≤3 mm与3 mm<瘤变边缘≤4 mm范围的比较差异均有统计学意 义(χ2=17.06,P<0.05; χ2=41.29,P<0.05; χ2=5.64,P<0.05; χ2=8.69,P<0.05),见表1及图2~11。

表1 宫颈活检高级别上皮内瘤变(HSIL)区及其旁组织中hTERC基因的阳性率比较

图2 宫颈活检HSIL区hTERC基因的扩增情况(FISH 100×10倍油镜)

图3 宫颈活检HSIL区与其旁组织交界hTERC基因的扩增情况(HE 40×10)

图4 宫颈活检HSIL瘤变边缘≤1 mm hTERC基因的扩增情况(FISH 100×10倍油镜)

图5 宫颈活检HSIL瘤变边缘≤1 mm hTERC基因的扩增情况(HE 40×10)

图6 宫颈活检HSIL区1 mm<瘤变边缘≤2 mm hTERC基因的扩增情况(FISH 100×10倍油镜)

图7 宫颈活检HSIL区1 mm<瘤变边缘≤2 mm hTERC基因的扩增情况(HE 40×10)
2.3 宫颈活检低级别上皮内瘤变(LSIL)区及其旁组织中hTERC基因的扩增情况 宫颈低级别上皮内瘤变(LSIL)区、瘤变边缘≤1 mm、1 mm<瘤变边缘≤2 mm、2 mm<瘤变边缘≤3 mm以及3 mm<瘤变边缘≤4 mm范围的hTERC基因阳性率分别为41.67%、25.00%、4.17%、4.17%和 4.17%, 其 中,LSIL与瘤变边缘≤1 mm、1 mm<瘤变边缘≤2 mm与2 mm<瘤变边缘≤3 mm、2 mm<瘤变边缘≤3 mm 与3 mm<瘤变边缘≤4 mm比较差异均无统计学意义(χ2=1.50,P>0.05; χ2=0,P>0.05; χ2=0,P>0.05), 而LSIL与1 mm<瘤变边缘≤2mm、LSIL与2 mm<瘤变边缘≤3 mm、LSIL与3 mm<瘤变边缘≤4 mm、瘤变边缘≤1 mm与1 mm<瘤变边缘≤2 mm的比较差异均有统计学意义(χ2=9.55,P<0.05; χ2=9.55,P<0.05;χ2=9.55,P<0.05; χ2=4.18,P<0.05),见表2及图12~21。

图8 宫颈活检HSIL区2 mm<瘤变边缘≤3 mm hTERC基因的扩增情况(FISH 100×10倍油镜)
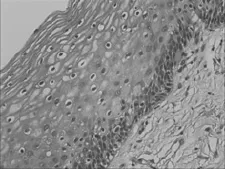
图9 宫颈活检HSIL区2 mm<瘤变边缘≤3 mm hTERC基因的扩增情况(HE 40×10)

图10 宫颈活检HSIL区3 mm<瘤变边缘≤4 mm hTERC基因的扩增情况(FISH 100×10倍油镜)

图11 宫颈活检HSIL区3 mm<瘤变边缘≤4 mm hTERC基因的扩增情况(HE 40×10)

表2 宫颈活检低级别上皮内瘤变(LSIL)区及其旁组织中hTERC基因的阳性率的比较

图12 宫颈活检LSIL区hTERC基因的表达情况(FISH 100×10倍油镜)

图13 宫颈活检LSIL区与其旁组织交界hTERC基因的表达情况(HE 40×10)

图14 宫颈活检LSIL区瘤变边缘≤1 mm hTERC基因的表达情况(FISH 100×10倍油镜)
3 讨论
宫颈癌的发生发展是一个多因素参与的、漫长而又复杂的过程,历经鳞状上皮不典型增生、宫颈上皮内瘤变(CIN)等癌前病变过程。因此,对CIN进行有效的早期筛查、诊治,是非常有必要的[12]。
目前宫颈癌的早期筛查主要依靠TCT和HPV检测,但两者的临床应用有一定局限性。细胞学检查(TCT)是一种形态学检查,受观察者主观因素的影响,有时难以做出正确诊断[13];而针对HPV DNA的实验也只能测出当时HPV的状态,大多数妇女特别是性生活活跃的年轻女性,HPV感染是暂时的,且HPV阳性不能反映细胞变异的状态,使HPV阳性的预测意义较低,事实上ASCUS和轻度细胞学异常在年轻女性中很常见,但低度病变发展到宫颈癌的比率并不高。因此需要寻找其他检测指标以弥补这些检测方法的不足。

图15 宫颈活检LSIL区瘤变边缘≤1 mm hTERC基因的表达情况(HE 40×10)

图16 宫颈活检LSIL区1 mm<瘤变边缘≤2 mm hTERC基因的表达情况(FISH 100×10倍油镜)

图17 宫颈活检LSIL区1 mm<瘤变边缘≤2 mm hTERC基因的表达情况(HE 40×10)

图18 宫颈活检LSIL区2 mm<瘤变边缘≤3 mm hTERC基因的表达情况(FISH 100×10倍油镜)

图19 宫颈活检LSIL区2 mm<瘤变边缘≤3 mm hTERC基因的表达情况(HE 40×10)

图20 宫颈活检LSIL区3 mm<瘤变边缘≤4 mm hTERC基因的表达情况(FISH 100×10倍油镜)

图21 宫颈活检LSIL区3 mm<瘤变边缘≤4 mm hTERC基因的表达情况(HE 40×10)
近几年,大量针对宫颈癌的研究表明,宫颈细胞癌变的过程中几乎都伴有3号染色体3q26~3q27区域的扩增,而hTERC基因定位于该区域,提示,hTERC基因是与宫颈癌相关的一个重要基因[14]。荧光原位杂交(FISH)技术是一项分子细胞遗传学技术,采用标记单链核苷酸为探针,按照碱基互补配对原则,与待测未知单链核苷酸杂交,形成荧光显微镜下可见的荧光信号,近年来应用日益广泛[15-16]。FISH技术敏感性高、特异性好、定位准确、结果直接清晰,是一项客观有效的指标,已被用于膀胱癌、乳腺浸润癌等的基因检测中。利用FISH技术来检测宫颈脱落细胞和石蜡包埋组织细胞中hTERC基因的扩增也已被证实可行,且其阳性率随宫颈病变分级的上升而逐渐增高[17-21]。
本研究应用FISH技术检测宫颈活检组织细胞中hTERC基因的表达情况,不仅检测病变部位组织的hTERC基因表达情况,而且利用测微尺,连续观测及检测距病变部位不同距离的组织中hTERC基因表达情况,以期证实:(1)随着距瘤变部位的距离增加,hTERC基因的扩增是突然降低还是逐渐降低;(2)如果是随着距瘤变区距离的增加,hTERC基因扩增逐渐减少,那么距瘤变区多少的距离处,hTERC基因表达降至与正常鳞状上皮一致。
本研究中,应用FISH技术检测宫颈活检组织细胞中hTERC基因的表达情况,利用测微尺连续观察宫颈活检高级别上皮内瘤变(HSIL)区及其旁组织中hTERC基因的扩增情况,发现:(1)随着距瘤变部位距离的增加,hTERC基因的扩增表达是逐渐下降的,即病变处hTERC基因的扩增100%表达,距病变区越远该基因的扩增率越小并逐渐达到正常,说明hTERC基因的扩增率与距瘤变部位的距离有相关性;(2)HSIL在距瘤变边缘约2 mm处以外hTERC基因的表达下降至接近正常鳞状上皮水平,其各范围阳性率比较差异无统计学意义(P>0.05),表明2 mm以内虽然HE染色镜下观察细胞已无明显异型性,但是2 mm及以外是基因水平上较正常上皮,是否可以在HSIL术中将距病变2 mm作为安全的手术范围仍是值得探讨的问题;(3)对LSIL区及其旁组织中hTERC基因扩增情况的观察表明,病变旁1 mm处两侧的组织中hTERC基因表达率有差异,即距病变部位边缘约1 mm处该基因的表达率可能降至正常鳞状上皮表达水平,其各范围阳性率比较差异无统计学意义(P>0.05)。虽然对LSIL患者不主张手术治疗,但在临床上常遇到患者hTERC基因检测表达率升高,患者因过分紧张、担心而要求手术者,在这种情况下,将距病变1 mm作为安全的手术范围也是值得探讨的。
本实验希望能为今后CIN手术在保证治疗安全的前提下最大可能减少创伤,起到抛砖引玉的作用,为宫颈癌前病变的筛查、早期诊断及治疗提供新的途径。
[1] Liu H Q,Liu S L,Wang H,et al.Genomic amplification of the human telomerase gene (hTERC) associated with human papillomabirus is related to the progression of uterine cervical dysplasia to infasive cancer[J].Diagnostic Pathology,2012,7(4):147.
[2]兆宏图,冯晓杰,马杰,等.FISH技术检测宫颈病变中hTERC基因的表达及意义[J].河南医学研究,2010,19(3):257,262.
[3]陈柯霖,王雅杰,康熙雄,等.FISH技术探讨hTERC基因与子宫颈上皮内瘤样病变和宫颈癌的相关性[J].中国实验诊断学,2012,16(7):1199-1201.
[4] Heselmeyer-Haddad K,Janz V,Castle P E,et al.Detection of genomic amplification of the human telomerase gene (TERC) in cytologic specimens as a genetic test for the diagnosis of cervical dysplasia[J].Am J of Pathol,2003,163(15):1406-1416.
[5] Heselmeyer-Haddad K,Sommerfeld K,White N M,et al.Genomic amplification of the human telomerase gene (TERC) in pap smears predicts the development of cervical cancer[J].Am J Pathol,2005,166(8):1229-1238.
[6] Lan Y L,Yu L,Jia C W,et al.Gain of human telomerase gene is associated with progression of cervical intraepithelial neoplasia grade I or II[J].Chinese Medical Journal,2012,125(9):1599-1602.
[7] Yin G P,Li J,Zhu T Y,et al.The detection of hTERC amplification using fluorescence in situ hybridization in the diagnosis and prognosis of cervical intraepithelial neoplasia:a case control study[J].World Journal of Surgical Oncology,2012,10(8):168.
[8] Zheng X H,Liang P H,Zheng Y R,et al.Clinical significance of hTERC gene detection in exfoliated cervical epithelial cells for cervical lesions[J].Gynecol Cancer,2013,23(5):785-790.
[9] Xiang L B,Yang H J,Li J,et al.Different amplification patterns of the human telomerase RNA gene in invasive cervical carcinomas and cervical intraepithelial neoplasia grade III[J].Diagnostic Cytopatholoty,2011,163(5):1206-1213.
[10]李静然,魏丽惠,刘宁,等.FISH检测宫颈脱落细胞hTERC基因的表达及其临床意义的研究[J].现代妇科进展,2008,17(2):725-729.
[11] Ren F F,Zhao S P,Ma D H,et al.The study of the production methods to detect the hTERC gene with Fluorescence in situ hybridization[J].Progress in Modern Biomedicine,2009,9(5):4126-4129.
[12]甘丹卉,蒋光愉,罗新.FISH技术检测hTERC基因对宫颈上皮内瘤变发展的前瞻性评估[J].中国计划生育和妇产科,2013,5 (1):18-23.
[13] Hopman A H N,Theelen W,Hommelberg P P H,et al.Genomic integration of HPV and gain of human telomerase gene TERC at 3q26 are strongly associated events in the progression of uterine cervical dysplasia to invasive cancer[J].J Pathol,2006,210(4):412-419.
[14]陈道桢,耿金花,薛文群,等.染色体不稳定性及其与妇科肿瘤形成关系的研究进展[J].东南大学学报,2004,23(5):355.
[15] Jehan Z,Uddin S,AL-Kuraya K S.Insitu hybtidization as a molecular tool in cancer diagnosis and treatment[J].Curr Med Chem,2012,19(22):3730-3738.
[16] Schwenner C,Stenzl A,Gakis G.Monitoring high-risk bladder cancer[J].Curr Opn Urol,2012,22(5):421-426.
[17] Li Y,Ye F,Lu W G,et al.Detection of human telomerase RNA gene in cervical cancer and precancerous lesions:comparison with cytological and human papillomavirus DNA test findings[J].Int J Gynecol Cancer,2010,20(4):631-637.
[18]罗新,陈舒,陈芳,等.FISH技术检测宫颈hTERC基因的表达及其临床意义[J].中国妇产科临床杂志,2010,11(2):88-91.
[19]刘爽,李亚里,姜淑芳,等.FISH技术检测宫颈组织TERC基因扩增[J].中国妇产科临床杂志,2012,13(5):334-337.
[20]袁艳龙,何春年,徐明堂,等.应用荧光原位杂交技术在组织标本中检测宫颈上皮病变的端粒酶RNA基因扩增[J].暨南大学学报,2011,40(3):182-186.
[21]段清,马洪达,杨维娜,等.应用荧光原位杂交法检测宫颈脱落细胞中hTERC基因的扩增[J].天津医药,2009,6(37):489-491.
Expression Change and Significance of hTERC Gene by FISH Detection in CervicaI IntraepitheIiaI NeopIasia and Its Adjacent Tissues
/CAO Zhi-xing,LYU Wei,ZHAO Ye,et aI.//MedicaI Innovation of China,2014,11(23):001-006
Objective:To detect the expression of the human telomerase (hTERC) gene of cervical intraepithelial neoplasia (CIN) and its adjacent tissues in cervical biopsy samples, to contrast and analyze the change of positive rate, to try to find the scope of surgical treatment on the CIN gene level.Method:The expression of hTERC gene was detected by FISH from 63 cases cervical biopsy specimen.ResuIt:Positive rate of expression of hTERC gene in high-grade squamous intraepithelial lesion (HSIL), the range from the edge of neoplasia to ≤1 mm, 1 mm<edge of neoplasia≤2 mm, 2 mm<dge of neoplasia≤3 mm, 3 mm<edge of neoplasia≤4 mm were 100%, 92.31%, 87.18%,64.10% and 30.77% respectively. Among them, the difference of HSIL and the range from the edge of neoplasia to ≤2 mm was not statistically significant(P>0.05). But the difference of HSIL and the range from the edge of neoplasia to >2 mm was statistically significant ( P<0.05).Positive rate of expression of hTERC gene in low-grade squamous intraepithelial lesion (LSIL), the range from the edge of neoplasia to ≤ 1 mm, 1 mm<edge of neoplasia≤ 2 mm,2 mm<edge of neoplasia≤ 3 mm, 3 mm<edge of neoplasia≤ 4 mm were 41.67%, 25.00%, 4.17%, 4.17% and 4.17% respectively. Among them, the difference of LSIL and the range from the edge of neoplasia to ≤1 mm was not statistically significant( P>0.05). But the difference of LSIL and the range from the edge of neoplasia to >1 mm was statistically significant (P<0.05).ConcIusion:With the increase of range from the area of neoplasia, the positive rate of hTERC gene decreases obviously. The range from HSIL edge>2 mm and LSIL edge>1 mm may be the scope of surgical treatment on the CIN gene level, respectively(a more precise sense).
10.3969/j.issn.1674-4985.2014.23.001
2014-07-16) (本文编辑:蔡元元)
珠海市科技计划项目(2011B040102003)
①广东省珠海市第二人民医院 广东 珠海 519020
曹志星
【Key words】Fluorescence in situ hybridization; Cervical intraepithelial neoplasia; HTERC gene; Cervical biopsy samples; The scope of surgical treatment
First-author’s address:The Second PeopIe’s HospitaI of Zhuhai,Zhuhai 519020,China
