氧化铁纳米粒子对玉米生理效应影响的研究
2014-03-13吴蝉
吴 蝉
(武汉理工大学化工学院,湖北武汉 430070)
纳米技术是21世纪科学技术的象征。 由于纳米尺度的特殊性,纳米粒子具有许多新的物理化学特性, 如小尺寸效应、大的比表面积、极高的反应活性、量子效应等[1]。近年,随着纳米技术的快速发展,纳米粒子被广泛地应用到生命科学、环境、能源、日常消费品、医药等领域中[2-3]。由于它在这些领域被大量地使用,不可避免地会被释放到环境中,而人们对于纳米粒子对生命体和生态环境的潜在毒性影响仍不得而知。目前,纳米粒子对人类和动物的影响已被研究[4-5],但对于植物很少。植物作为整个生态系统的主要生产者,很有必要评估纳米粒子对植物的影响。
纳米粒子对于植物的影响不仅与纳米粒子的物理化学性质有关,而且与植物种类相关。Lin等[6]研究了多壁碳纳米管、铝纳米粒子、氧化铝纳米粒子、锌纳米粒子、氧化锌纳米粒子5种纳米粒子对6种不同的植物(萝卜、油菜、黑麦草、生菜、玉米、黄瓜)根生长和根萌发的影响。研究表明,就根的萌发率而言,除锌纳米粒子和氧化锌纳米粒子外,其余对根的萌发没有影响。但是,在根的伸长试验中,各种纳米粒子对各种植物的根的伸长率的影响就不同。当锌纳米粒子和氧化锌纳米粒子在浓度为2 000 mg/L时抑制所有的植物生长,但对于萝卜而言其半数致死率(IC50)浓度为50 mg/L,而对于油菜和黑麦草就只需要20 mg/L。然而,大多数的关于纳米粒子对于植物的影响主要是从宏观水平上进行研究的[7],通过观察根的萌发率和根的伸长率等来对其进行评估的,而在分子层面(包括酶、蛋白质、基因等)上,纳米粒子对植物的影响研究仍很少。
为了进一步研究纳米粒子对植物的影响,选取氧化铁纳米粒子和玉米为研究对象,在分子水平上探讨氧化铁纳米粒子对玉米生理效应的影响,通过测定过氧化氢酶(CAT)、过氧化物酶(POD)、超氧化物歧化酶(SOD)所组成的抗氧化酶的活性和丙二醛(MDA)含量来对其进行评估。同时,研究了氧化铁纳米粒子在玉米体内的运输途径。这些结果为研究纳米粒子的暴露对植物生长和食物链的潜在影响提供一定的依据,为进一步评估纳米粒子对植物的影响奠定基础。
1 材料与方法
1.1试验材料氧化铁纳米粒子(nano-Fe2O3)和荧光氧化铁纳米粒子(用异硫氰酸荧光素(FITC)标记了的氧化铁纳米粒子(FITC-conjugated-Fe2O3NPs))由武汉大学化学与分子科学学院提供,其尺寸分别为15、20 nm,如图1、2所示。玉米种子由湖北农业科学院提供。其他试剂均购自武汉申试化工科技有限公司。

图1 氧化铁纳米粒子的透射电镜图

图2 荧光氧化铁纳米粒子的透射电镜图
1.2试验方法
1.2.1种子的处理。玉米种子先用反渗透水进行充分地洗涤,然后每30颗为一组,分别浸泡在浓度为20、50、100 mg/L的氧化铁纳米粒子的水溶液中3 h。在28 ℃下,种子在湿润的滤纸上萌发,当长成幼苗时移栽到不含铁离子的全营养液中进行培养,然后把没有用氧化铁纳米粒子处理的玉米幼苗分别移栽到含铁离子全营养液中进行培养作为对照。当玉米幼苗长到两叶一新阶段时,分别测定叶片中SOD、POD、CAT酶的活性和MDA含量等生理指标。每个生理指标重复测量3次,最终结果用平均值±方差来表示。
1.2.2SOD活性的测定。SOD普遍存在于动植物体内,是一种清除超氧阴离子自由基的酶。测定依据是通过SOD抑制氮蓝四唑(NTB)在光下的还原作用来确定酶活性。SOD粗酶提取液中加入3.5 ml磷酸缓冲液(pH 7.8,0.05 mol/L)、0.5 ml甲硫氨酸(130 mmol/L)、0.5 ml NTB(750 μmol/L)、0.5 ml EDTANa2(100 μmol/L)、0.4 ml蒸馏水。对照组用磷酸缓冲液代替SOD粗酶提取液,其余所加试剂是一样的。当各溶液充分混匀后,将对照组置于暗处,而其他则置于日光灯下照射20 min。最后,SOD活性是由其混合溶液在560 nm波长下吸光度的变化量(△A560/(min·g))来表
示的。
1.2.3POD活性的测定。POD广泛分布于植物的各组织中。在有H2O2存在的条件下,POD能使愈创木酚氧化,生成茶褐色的4-邻甲氧基苯酚,可用分光光度计测定该物质的含量来间接表示POD活性。反应混合液包括50 ml磷酸缓冲液(pH 6.0,100 mmol/L)、28 μl愈创木酚和19 μl H2O2(30%)。向POD粗酶提取液中加入3.0 ml反应混合液和1.0 ml磷酸氢二钾,同样用磷酸缓冲液替代POD粗酶提取液作为对照组。所得混合溶液在470 nm的波长下每隔30 s测吸光度一次。POD活性可以用每分钟吸光度的变化量(△A470/(min·g)来表示。
1.2.4CAT活性的测定。CAT能分解过氧化氢。根据测量吸光率的变化速度即可测出CAT活性。CAT粗酶提取液被加入0.3 ml H2O2(0.1%)和3.0 ml磷酸缓冲液(pH 7.8),同样用磷酸缓冲液替代CAT粗酶提取液,作为对照组。所得混合液在240 nm的波长下每隔30 s测吸光度一次。CAT活性由每分钟吸光度的变化量(△A240/(min·g))来表示。
1.2.5MDA含量的测定。MDA是膜脂过氧化的最终分解产物。它的积累可能对膜和细胞造成一定程度的伤害。向0.4 g叶片中加入2 ml三氯乙酸(10%),碾磨,再加三氯乙酸定容到10 ml,离心,取上层清液。然后,吸取上层清液2 ml(对照组为2 ml蒸馏水),加入2 ml硫代巴比妥酸(0.6%)溶液,混合物于沸水浴上反应15 min,迅速冷却。取上清液,测定532、600和450 nm波长下吸光度,就可以求出MDA含量。
1.2.6玉米根切片的制作。在21 ℃把发育好的玉米幼苗的根浸泡在含2×10-6mg/L荧光氧化铁纳米粒子的溶液中6 d,然后取出玉米的根,用PBS缓冲液洗净,再浸泡在浓度5%多聚甲醛溶液中4 h进行固定,然后用锋利的刀片进行徒手切片,最后把制作好的植物组织切片放到荧光显微镜上观察即可。而对于用于透射电镜中观察的切片,其前期的处理相同,只是把荧光氧化铁纳米粒子换成氧化铁纳米粒子进行培养且浓度保持不变,当被浓度5%多聚甲醛溶液进行固定后,再用浓度1%四氧化锇进行覆染,覆染后再在酒精中进行脱水,最后用丙酮进行包埋,经过这些步骤处理过后的根用超薄切片机切片,再在透射电镜下进行观察。

图3 不同浓度氧化铁纳米粒子所对应的玉米中抗氧化物酶的活性
2 结果与分析
2.1抗氧化物酶的活性CAT、SOD与POD是作为细胞中防御氧化损伤十分重要的3种酶[8]。其中,SOD作为细胞氧化防御体系中的第1道防线,被用作清除细胞中的氧自由基,催化超氧阴离子自由基(O2-)变成O2和H2O2。从图3A可以看出,当氧化铁纳米粒子的浓度为2.0×10-6和5.0×10-6mg/L时,SOD活性都比对照组要高,并且最高时比对照组高30%左右。这说明在氧化铁纳米粒子存在下,玉米体内有大量的O2-存在,使得SOD活性增强。然而,当氧化铁纳米粒子浓度达到1.0×10-5mg/L时,其SOD活性快速下降。这是由于O2-在体内大量积累而产生氧化应激反应,致使其活性降低。此外,CAT与POD作为细胞氧化防御体系中的第2道防线同样起着重要的作用。它们能把生成的H2O2转变成H2O和O2。一般来说,当H2O2在体内积累时,CAT与POD的活性会增加[9]。从图3B可以看出,当化铁纳米粒子的浓度为2.0×10-6mg/L时,CAT活性最高,而随着浓度的增加,其活性急剧下降。图3C可以看出,POD活性刚开始时就比对照低,并且随着浓度的增加,其POD活性快速降低。这可能是由于玉米在高浓度的氧化铁纳米粒子的刺激下发生了氧化应激反应,从而刺激玉米自身的保护机制,导致整个机体都在协同抗击氧化,使得相关的酶自身活性降低。
2.2MDA含量MDA是植物在受到外界胁迫时膜脂过氧化的最终分解产物。它的含量在一定程度上能反映植物膜对外界的抵抗能力。从图4可以看出,用氧化铁纳米粒子处
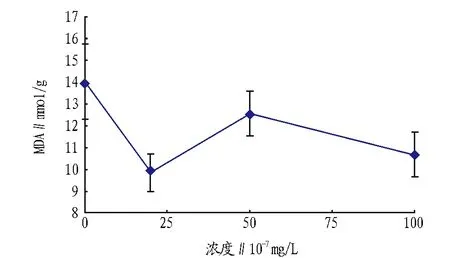
图4 不同浓度氧化铁纳米粒子所对应玉米中丙二醛的含量

注:A.玉米根的表皮在紫外光激发下的荧光切片图;C.玉米根在紫外光激发下的横切荧光切片图;E.玉米根的透射电镜切片图。图B、D和F分别是图A、C和E方框处的扩大图。图5 切片图
理的玉米叶中MDA含量都比不用氧化铁纳米粒子处理的对照组少。这进一步验证了上面的推断。这是由于当玉米在受到外界胁迫而导致氧化损伤时,整个机体的抗氧化预防能力增强,从而减少体内氧自由基的积累,导致膜脂过氧化作用的减少,使得体内的MDA含量降低。
2.3玉米根切片为了研究氧化铁纳米粒子对玉米这些生理效应的影响究竟是由氧化铁纳米粒子本身还是其进入植物体内后转化为离子或其他物质造成的,十分有必要弄明白氧化铁纳米粒子是否能进入植物体内及其在植物体内的运输途径。被荧光分子修饰了的氧化铁纳米粒子在紫外光激发下显青色,而玉米自身则显蓝色。因此,从玉米根的表皮切片图5A和5B可以看出,大量的荧光氧化铁纳米粒子存在于细胞壁的间隙中,而从其根的横切切片图5C、5D分析可得荧光氧化铁纳米粒子在进入玉米根后主要分布在细胞间隙。这表明氧化铁纳米粒子能够进入玉米根里面,同时从上皮层运输到皮质层主要是通过质外体途径[10]。此外,玉米根的透射电镜切片图被用来验证氧化铁纳米粒子能进入玉米体内。从图5F可以看出,黑点的尺寸约20 nm。这和氧化铁纳米粒子的大小基本相同,因此可以判断这些黑点就是氧化铁纳米粒子[11]。由此可知,氧化铁纳米粒子已进入玉米细胞体内,并且存在于细胞质里面。这证明氧化铁纳米粒子能进入玉米细胞体内。
3 小结与讨论
该研究主要介绍了氧化铁纳米粒子对玉米生理效应的影响,通过CAT、SOD与POD所组成的抗氧化酶体系的酶活性和MDA含量的变化来评估。CAT、SOD与POD酶活性以及MDA含量的变化表明,当玉米在受到氧化铁纳米粒子胁迫时,玉米会发生氧化应激反应,但这会激发玉米自身的的保护机制,导致整个机体的抗氧化预防能力增强,使得机体的超氧阴离子自由基含量降低,减少对机体的损害。由此可知,氧化铁纳米粒子对玉米这种植物存在某种程度上的生物适应能力。同时,氧化铁纳米粒子在玉米根内从上皮层运输到皮质层主要通过质外体途径,并且能够进入玉米细胞中。这为进一步评估纳米氧化铁对植物的影响奠定基础。
[1] 张中太,林元华,唐子龙,等.纳米材料及其技术的应用前景[J].材料工程,2000(3):42-48.
[2] 竺柏康,王北福.处理油库污水的改性PVDF超滤膜结构与性能[J].化工学报,2013,64(10):3658-3664.
[3] 张亚臣,吕宝经,赵美华,等.纳米药物载体在临床医学中的应用[J].临床内科杂志,2004,21(7):502-504.
[4] 陈亨宇,付爱玲,赵宝全.应用斑马鱼模型评价纳米粒子毒性机制的研究进展[J].中国药理学与毒理学杂志,2012,26(2):251-254.
[5] 王晶,洪铁,张英鸽.纳米粒子对免疫系统影响的研究进展[J].中国药理学与毒理学杂志,2012,26(2):242-246.
[6] LIN D,XING B.Phytotoxicity of nanoparticles: inhibition of seed germination and root growth[J].Environment Pollution,2007,150(2):243-250.
[7] YANG L,WATTS D J.Particle surface characteristics may play an important role in phytotoxicity of alumina nanoparticles[J].Toxicology Letters,2005,158(2):122-132.
[8] REN H X,LIU L,LIU C,et al.Physiological investigation of magnetic iron oxide nanoparticles towards chinese mung bean[J].Journal of Biomedical Nanotechnology,2011,7(5):677-684.
[9] LI J,CHANG PR,HUANG J,et al.Physiological effects of magnetic iron oxide nanoparticles towards watermelon[J].Journal of Nanoscience and Nanotechnology,2013,13(8):5561-5567.
[10] ZHAO L,PERALTA-VIDEA JR,VARELA-RAMIREZ A,et al.Effect of surface coating and organic matter on the uptake of CeO2NPs by corn plants grown in soil: Insight into the uptake mechanism[J].Journal of Hazardous Materials,2012,225(226):131-138.
[11] YAN S,ZHAO L,LI H,et al.Single-walled carbon nanotubes selectively influence maize root tissue development accompanied by the change in the related gene expression[J].Journal of Hazardous Materials,2013,246(247):110-118.
