内蒙古额济纳盆地硫酸盐沉积物中δ17O异常及其指示意义
2014-03-12周爱国李小倩余婷婷刘运德
于 凯, 周爱国, 李小倩, 余婷婷, 刘运德
中国地质大学(武汉)环境学院, 湖北武汉 430074;中国地质大学(武汉)生物地质与环境地质国家重点实验室, 湖北武汉 430074
同位素分馏是自然界的常见现象, 由物理、生物和化学过程所引起的热力学和动力学同位素分馏通常与质量相关(Urey, 1947; Bigeleisen et al., 1947),称为质量相关分馏。氧同位素间的质量相关分馏被很好地记录在地球矿物中, 硅酸盐矿物和其他含氧矿物的测定结果显示, δ17O和 δ18O存在固定关系,即 δ17O=0.52δ18O(Clayton et al., 1973; Matsuhisa et al., 1978)。描述δ17O和δ18O的质量相关分馏线的直线称为地球分馏线(Terrestrial Fractionation Line,TFL)。通常认为, 地球矿物中的氧同位素组成在37亿年以来均符合质量相关分馏关系(Robert et al.,1992), 因此没有必要测定δ17O值。然而, 近年来氧同位素的质量不相关分馏(即 δ17O值偏离地球分馏线)的陆续发现引起了学者们的关注, 通常用 Δ17O值来表征 δ17O 值的异常, Δ17O=δ17O–0.52δ18O≠0。
硫酸盐是海水中第二丰富的阴离子, 也是地下水中的主要离子之一(杨郧城等, 2008), 普遍存在于自然环境中, 在岩溶(卢耀如等, 2002)和海底沉积物(蒋少涌等, 2005)研究等领域中具有指示意义, 因此,硫酸盐一直是地球科学的研究热点。但是, 传统研究方法的局限性使地表环境硫酸盐的起源问题仍有争议(Cooper et al., 1991; Krouse et al., 1991; Van Stempvoort et al., 1994; Mitchell et al., 1998; Michel et al., 2000), 其大气来源的定量研究也很缺乏。硫酸盐 δ17O异常的发现为解决上述问题开辟了新的途径, 目前学者已陆续在大气和雨水(Δ17O=0.2‰~3‰)(Lee, 1997; Lee et al., 1998)、地表沉积物(Δ17O=0.2‰~4.6‰)(Bao et al., 2000a, b,2001a, b, 2004; Martin et al., 2009)、高山积雪(Δ17O=0.8‰~1.6‰) 和 河 水 (Δ17O=0.2‰~0.9‰)(Johnson et al., 2001)、以及南极冰芯(Δ17O=1.8‰~2.6‰)(Kunasek et al., 2010)等物质的硫酸盐中发现了正的δ17O异常。此外, 在地球表面沉积了 7.5亿年的古海洋蒸发岩和重晶石硫酸盐中也发现了 δ17O 异常, Δ17O 值的变化范围为–0.70‰~0.02‰(Bao et al., 2008)。
硫酸盐 δ17O异常的发现不仅为其大气成因的来源提供了有力的证据, 而且为古环境、古气候以及大气化学过程的研究提供了重要的工具。本文首次报道我国西北干旱地区额济纳盆地地表硫酸盐沉积物中δ17O异常, 揭示硫酸盐 Δ17O值在土壤剖面上的变化特征, 指出硫酸盐δ17O异常在古环境古气候等地球科学相关领域的潜在科学价值, 为揭示干旱环境中硫酸盐的起源、迁移、转化提供重要的科学依据。
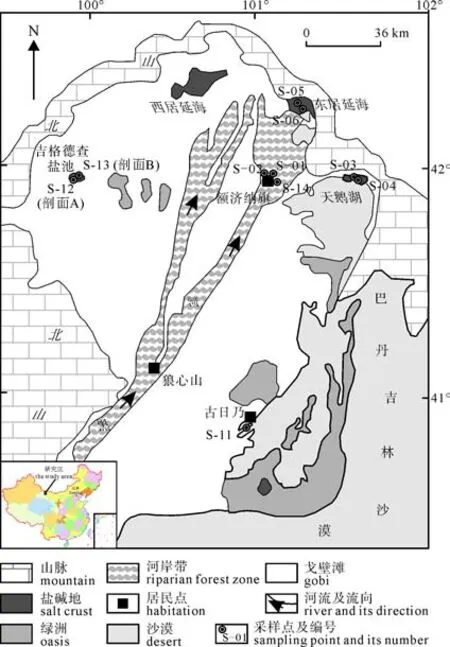
图1 额济纳盆地硫酸盐沉积物取样点分布图Fig. 1 Map showing geographic location of the Ejin Basin and sampling locations
1 样品采集与测试
黑河流域是中国西北地区第二大内陆河流域,发源于祁连山区而最终消失在沙漠中的居延海。额济纳盆地地处黑河流域的最下游, 系指阿拉善以北,阿尔泰山以南, 巴丹吉林沙漠与北山之间的荒漠平原(图 1)。地理坐标为东经 99°25′—102°00′, 北纬40°10′—42°30′, 面积约 3.14 万 km2, 海拔 820~1127 m(张应华等, 2006)。额济纳盆地深居内陆, 属大陆性极端干旱气候区, 具有降水稀少、蒸发强烈、温差大、风大沙多、日照时间长等特点。根据额济纳旗气象站 1957—2001年的气象资料统计, 该地区多年平均降水量仅 38.9 mm, 且降水量多集中在7—9月; 年平均蒸发量为3653 mm, 约为降水量的95.6倍, 5—8月蒸发最强烈。年平均气温8.2℃, 最高为 41.8℃, 最低为–36.4℃, 日温差一般为14~17℃, 最大达 34.2℃。年日照时间 3325.6~3432.4 h, 年均风速4.2 m/s, 最大风速15.0 m/s。该区域除河流沿岸和居延三角洲外, 其余大部分为沙漠、戈壁、盐碱地以及极为稀疏的荒漠草场, 生态环境极为脆弱。
硫酸盐样品的采集主要分布在额济纳盆地的额济纳旗绿洲区、东居延海、天鹅湖、吉格德查盐池及古日乃地区(如图 1所示)。样品类型包括地表盐结层、现代风尘土、湖底沉积物和盐池剖面土壤四类, 共20个, 每份约0.1~0.5 kg。其中, 地表土壤样品为地表 0~3 cm的表层土壤; 现代风尘土样品为额济纳旗居民住宅区屋顶多年沉积的风吹尘土;剖面样品为深1 m的新鲜土壤剖面上分层采集的土壤。
硫酸盐中三氧同位素的测试技术主要有CO2激光氟化法(甘义群等, 2005)和硫酸银(Ag2SO4)热解法(周爱国等, 2008), 本文所采用的是(Ag2SO4)热解法。样品的前处理步骤可概括为: 首先将土壤样品研磨至小于 100目, 用去离子水浸取其中可溶性硫酸盐, 再将浸取溶液分别经阳离子交换树脂和银离子(Ag+)交换树脂分别去除其中的阳离子和氯离子(Cl–), 则交换液中以SO42–为主, 向其中加入适量的分析纯硝酸银(AgNO3)试剂, 通过化学沉淀法将SO42–转化为 Ag2SO4沉淀并进行纯化处理。纯化后的Ag2SO4样品于1050℃高温下真空热解为氧气(O2)和二氧化硫(SO2), O2与SO2进行分离、纯化后在5Å分子筛液氮温度下冷冻收集, 双路进样模式引入Thermo Fisher ScientificTMMAT 253型气体稳定同位素比值质谱仪, m/z=32、33、34法拉第杯接收, 同时测定δ17O和δ18O值。δ17O、δ18O和Δ17O的分析精度分别为0.5‰、0.3‰和0.1‰。硫酸盐样品的前处理和同位素比值的质谱测定均在中国地质大学(武汉)生物地质与环境地质国家重点实验室的同位素实验室中完成。具有δ17O异常的硫酸盐样品进行了重复测定, 保证Δ17O值在允许误差范围内, 并取其平均值作为最后报道结果。
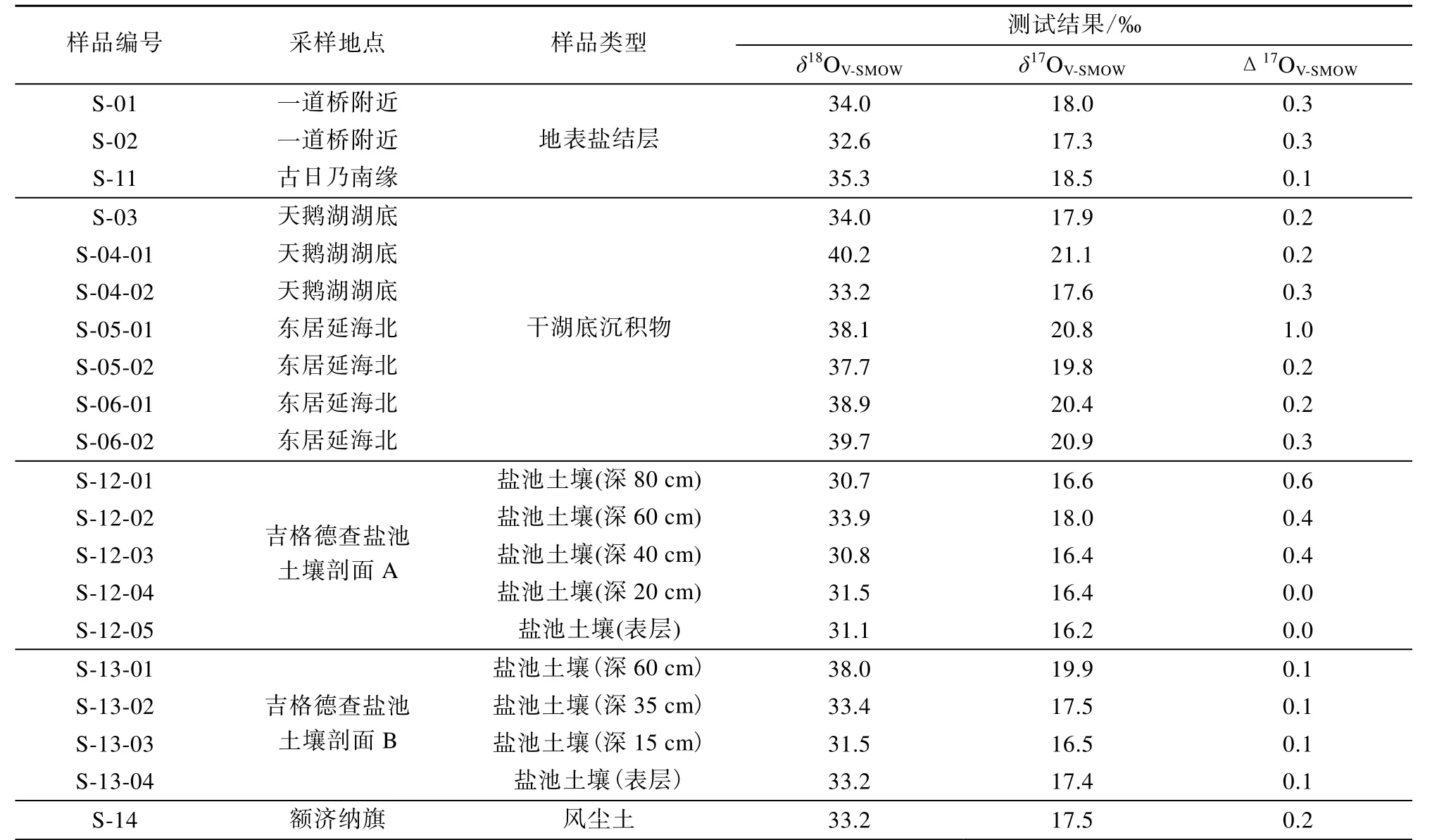
表1 额济纳盆地4种不同硫酸盐沉积物的氧同位素组成和Δ17O值Table 1 Sulfate oxygen isotopic compositions and 17O-excess from surface deposits in the Ejin Basin
2 结果与讨论
额济纳盆地的 20个样品中可溶性硫酸盐的氧同位素测试结果(表 1)表明, 额济纳盆地地表沉积物中的可溶性硫酸盐存在 δ17O 异常, Δ17O 值为0.2‰~1.0‰, 主要分布在额济纳盆地干旱土壤的盐结皮和天鹅湖区的干湖底沉积物中。西戈壁的吉格德查盐池区的土壤剖面 B(见图 1)中并无硫酸盐的δ17O异常, 而在土壤剖面A(见图1)中存在硫酸盐的δ17O异常, 且 Δ17O值随土壤剖面深度的增加呈现出增大的趋势。
2.1 额济纳盆地地表沉积物中可溶性硫酸盐的δ17O异常
如图2所示, 具有δ17O异常的样品点偏离了地球分馏线(TFL), 落在其左上方, Δ17O 值均大于零,多为 0.2‰~0.4‰, 最大为 1.0‰。按照样品类型的不同, 额济纳盆地地表沉积物硫酸盐的δ17O异常可分为 4种: ①现代风尘土: Δ17O=0.2‰; ②地表盐结 皮 : Δ17O=0.3‰; ③ 干 湖 底 沉 积 物 : Δ17O=0.2‰~1.0‰; ④盐池表层以下土壤: Δ17O=0.4‰~0.6‰。额济纳盆地地表沉积物中硫酸盐 δ17O异常的发现再次证实了地球矿物中δ17O异常的存在。
目前发现硫酸盐 δ17O异常的地球矿物普遍存在于干旱的沙漠环境中, 如纳米比沙漠、南极干谷、美国死谷和阿塔卡马沙漠。纳米比沙漠中部石膏硫酸盐的Δ17O值为0.20‰~0.51‰(Bao et al., 2000b),而随后在深入研究采集的 72个土壤和石膏硫酸盐样品的分析结果显示Δ17O值介于0.06‰和1.11‰间,均值为0.39‰±0.21‰(Bao et al., 2001b)。美国西北死谷的沙漠中Δ17O平均值为0.70‰±0.22‰(n=20),最大达1.38‰(Bao et al., 2001a)。而在南极干谷和阿塔卡马沙漠中部的土壤硫酸盐中发现的 Δ17O值更为偏正, 分别为 0.6‰~3.4‰(Bao et al., 2000a)和0.4‰~4.6‰(Bao et al., 2004)。
与此相比, 额济纳盆地地表硫酸盐沉积物中的Δ17O值与纳米比沙漠中部土壤和石膏硫酸盐的Δ17O值范围相近, 但都远小于南极干谷和阿塔卡马沙漠硫酸盐中的 Δ17O值。南极干谷和阿塔卡马沙漠硫酸盐存在着较大的正 Δ17O值, 可能是由于这两个地区的气候极为干旱, 而且都是地球上最为古老的地表环境。额济纳盆地气候干旱, 地表土壤盐渍化程度高、沙化严重, 黑河水系的萎缩和人为活动的影响使天鹅湖大面积干涸, 所采集的样品正是天鹅湖和居延海干涸后暴露在空气中的湖底沉积物。

图2 额济纳盆地地表硫酸盐沉积物的三氧同位素组成Fig. 2 Tri-oxygen isotope compositions in sulfate deposits in the Ejin Basin
2.2 地表沉积物中硫酸盐δ17O异常的起源
已有研究表明海水硫酸盐、蒸发硫酸盐、微生物硫酸盐以及还原过程中生成的硫酸盐等原生硫酸盐均无δ17O异常(Bao et al., 2000b), 这表明热力学和动力学过程中(如蒸发、硫化物被三价铁离子或空气中的 O2氧化及硫酸盐还原等)氧同位素的分馏均遵循质量相关分馏规律。目前唯一发现存在氧同位素异常的地球储库是大气。大气中的痕量气体如O3、H2O2、二氧化碳(CO2)、一氧化碳(CO)和一氧化二氮(N2O)均具有δ17O异常(Brenninkmeijer et al.,2003), 呈现出正的Δ17O值, 如对流层中的O3, Δ17O值范围为20‰~35‰(Johnston et al., 1997), 而平流层中的O3具有更大的Δ17O值(Johnson et al., 2000);雨水中 H2O2的值为 1.2‰~2.4‰(Savarino et al.,1999)。大气中的 O3和 H2O2的氧同位素异常特征(Δ17O>0)是大气层中紫外线引起的光化学反应的产物, 其产生是一个动力学非平衡过程(Anderson et al., 1997; Janssen et al., 2001; Mauersberger et al.,2003; Babikov et al., 2003)。因此, O3和 H2O2具有正的Δ17O值是其内在的特性, 它在伴随着O3和H2O2生成的光化学反应过程中产生, 并在大气交换过程中将 δ17O异常转移到其它痕量气体上(Lyons,2001)。而干旱地区地表沉积物中可溶性硫酸盐的δ17O异常, 是硫酸盐在氧化形成过程中大气氧化物(如O3或H2O2)的 δ17O异常向其氧化产物转移的结果。实验表明, 还原态硫完全被 O3氧化时,Δ17O=0.9‰; 如果完全被 H2O2氧化, Δ17O 值可达8.8‰(McCabe et al., 2006)。
硫酸盐的氧化过程可能有两种方式: (1)还原态含硫矿物(如硫化物)在地表直接被原位氧化形成硫酸盐; (2)还原态硫化物在大气中被氧化形成硫酸盐,而后随大气干/湿沉降到地表环境中。降落到地表的雨水中含有痕量具有δ17O异常的O3和H2O2等气体,可能会使地表的还原态含硫矿物被氧化, 并在此过程中将氧化物中的 δ17O异常信号转移到氧化产物硫酸盐中。然而, 黄铁矿等地表氧化产物的硫酸盐中未发现显著的 δ17O 异常(即 Δ17O≈0)(Bao et al.,2000a)。因此, 地表硫酸盐中的δ17O异常信号更有可能是还原态含硫气体在大气中氧化形成, 而后随大气干/湿沉降到地表并保存下来。大气中的硫源于火山喷发、生物活动以及化石燃料燃烧释放的二氧化硫(SO2)、硫化氢(H2S)和二甲基硫(Dimethyl Sulfide, DMS)等含硫气体。这些还原态的含硫气体最终在大气中被 O3和 H2O2氧化生成硫酸盐, 尽管氧化过程均为符合质量相关分馏的同位素交换过程,但产物硫酸盐在交换过程中获得了氧化剂(O3或H2O2)中的δ17O异常特征而具有正的Δ17O值(Lee et al., 2001)。
硫酸盐的稳定性使其不与大气中的气体发生同位素交换, 使得O3和H2O2中的δ17O异常特征能够被继承并保存在硫酸盐中。硫酸盐属于少数稳定含氧离子之一, 当大气硫酸盐以沉降的形式从大气中分离出来并到达地表之后, 在大多数的地表环境中特别是干旱环境中很难与周围的含氧物质发生同位素交换, 此特性有利于将 Δ17O信号保留在硫酸盐矿物中。
额济纳盆地地表硫酸盐沉积物中正 Δ17O值的发现, 为大气同位素异常能够转移到陆壳矿物中提供了新的证据, 说明大气沉降是该地区地表硫酸盐的重要来源。具有δ17O异常的硫酸盐从大气圈直接沉降到地表环境中, 并在特定的地表环境中累积起来, 其量化研究可以为古环境和古气候研究以及大气化学过程提供线索, 也可以为研究大气圈和地球其他圈层的相互作用提供新的示踪工具。
2.3 硫酸盐沉积后在土壤剖面上的分离效应
在额济纳盆地西戈壁的吉格德查盐池采集了两个土壤剖面的样品。从表1中可看出, 剖面A上可溶性硫酸盐的Δ17O值变化范围为 0‰~0.6‰, 而土壤剖面 B上 Δ17O值均为0.1‰±0.1‰, 并无明显的δ17O异常。剖面上硫酸盐δ17O异常是否随深度变化的决定因素主要有两点: 来源和保留条件。从来源上分析, 硫酸盐δ17O异常来自于大气沉降, 剖面A和B位于同一区域, 故二者差异性来自大气沉降的可能性很小。从保留条件方面分析, 剖面A和B可能受到了不同程度的淋滤作用, 因此, 淋滤作用可能是导致剖面A和B存在差异的主要原因。硫酸盐Δ17O值在土壤剖面A上的变化特征表现出与南极干谷土壤硫酸盐和阿塔卡马沙漠中部的土壤硫酸盐相同的变化趋势(Bao et al., 2000a, 2004), 即硫酸盐Δ17O值随着剖面深度的增加而增大(如图3所示)。但这种剖面变化特征并不具有普遍性, 纳米比沙漠中部地区土壤剖面上的硫酸盐 Δ17O值与深度并无明显关系(Bao et al., 2000b)。
南极干谷土壤硫酸盐中正 Δ17O在土壤剖面上的变化特征, 可能是海洋生物硫成因的硫酸盐优先淋滤并在土壤剖面上累积的结果(Bao et al., 2000a)。然而纳米比沙漠中部地区土壤剖面上的硫酸盐Δ17O值与深度无明显相关变化, 可能是因为该地区周期性的洪水事件、土壤淋滤作用较为强烈或是海洋生物硫成因的硫酸盐份额较小(Bao et al.,2001b)。这种差异表明硫酸盐Δ17O值在土壤剖面上随深度变化的趋势在干旱地区比湿润地区明显。
Bao等(2004)对阿塔卡马沙漠土壤中可溶性硫酸盐进行了连续提取实验, 发现随着提取次数的增加, 可溶性硫酸盐的Δ17O值逐渐减小, 表明具有较高 Δ17O值的次生硫酸盐矿物更易溶于水, 这为沉积后的硫酸盐在土壤剖面上的迁移研究提供了线索。但是, 这种同位素的分离效应是伴有少量降水的干旱环境所特有的, 强烈的淋滤作用或是原生硫酸盐占绝对优势都可能减弱氧同位素的分离效应,使其剖面变化不明显甚至消失。然而, 目前尚未明确具有δ17O异常的硫酸盐的矿物组成, 进一步的研究将确定其是否为(NH4)2SO4、NH4HSO4等易溶性成分, 这将对具有δ17O异常的硫酸盐优先向下运动提供新的认识。
由于大气是硫酸盐中δ17O异常的唯一来源, 如果硫酸盐δ17O异常在土壤剖面或某一特定地层、成层矿物中的分离效应在区域范围内普遍存在, 则可能是沉积物中积累某些具有 δ17O异常物质的结果,它反映的是大气圈和地球其他圈层的相互作用, 可以为古气候、古环境等相关领域的研究提供有价值的信息。

图3 吉格德查盐池土壤剖面上硫酸盐Δ17O值演化趋势Fig. 3 Δ17O values evolution trend along the vertical section of soil in the Jigedechagan salt pond
3 结论
在我国西北干旱区额济纳盆地硫酸盐沉积物中发现δ17O异常, 是继纳米比沙漠、南极干谷和阿塔卡马沙漠土壤中发现地表沉积环境中可溶性硫酸盐的δ17O异常之后的又一发现, 为δ17O异常从大气圈向地表矿物的迁移提供了新的证据, 潜在地示踪了古大气圈中臭氧行为和干旱区硫生物地球化学循环过程, 对地球科学领域的相关研究具有重要的指示意义。
硫酸盐 Δ17O值在土壤剖面上的分离效应揭示的是一种特殊的物理—化学过程, 即在极其干旱的气候条件下不同硫酸盐成分在土壤剖面上被分离开的过程, 这种过程可能正在或已经在火星的风化层中发生, 因此深入探讨其分布特征和机理的研究有待于进一步展开。而在世界范围内调查地表环境中硫酸盐δ17O异常存在的规律性, 如是否存在纬度效应、大陆效应等, 将为研究大气圈和地球圈层的相互作用及其地球科学领域中的前沿问题提供必要的科学理论依据。
甘义群, 周爱国, 刘存富. 2005. 硫酸盐17O和18O同时测试新技术: CO2-激光氟化法[J]. 地球学报, 26(S1): 48-50.
蒋少涌, 杨涛, 葛璐, 凌洪飞, 杨競红, 吴能友, 陈道华, 刘坚.2005. 海洋沉积物孔隙水硫酸盐浓度和碳同位素对天然气水合物的指示[J]. 地球学报, 26(S1): 190-191.
卢耀如, 张凤娥, 阎葆瑞, 郭秀红. 2002. 硫酸盐岩岩溶发育机理与有关地质环境效应[J]. 地球学报, 23(1): 1-6.
杨郧城, 沈照理, 文冬光, 侯光才, 赵振宏, 王冬. 2008. 鄂尔多斯白垩系地下水盆地硫酸盐的水文地球化学特征及来源[J].地球学报, 29(5): 553-562.
张应华, 仵彦卿, 苏建平, 温小虎. 2006. 额济纳盆地地下水补给机理研究[J]. 中国沙漠, 26(1): 96-102.
周爱国, 刘存富, 蔡鹤生, 甘义群, 李小倩, 余婷婷, 刘运德.2008. 硫酸盐中三氧同位素测试制样新技术——Ag2SO4热解法[J]. 地球学报, 29(6): 673-676.
ANDERSON S M, HULSEBUSCH D, MAUERSBERGER K.1997. Surprising rate coefficients for four isotopic variants of O+O2+M[J]. The Journal of Chemical Physics, 107(14):5385-5392.
BABIKOV D, KENDRICK B K, WALKER R B, SCHINKE R,PACK R T. 2003. Quantum origin of an anomalous isotope effect in ozone formation[J]. Chemical Physics Letters, 372:686-691.
BAO H M, CAMPBELL D A, BOCKHELM J G, THIEMENS M H.2000a. Origins of sulphate in Antarctic dry-valley soils as deduced from anomalous17O compositions[J]. Nature,407(6803): 499-502.
BAO H M, LYONS J R, ZHOU C M. 2008. Triple oxygen isotope evidence for elevated CO2levels after a Neoproterozoic glaciations[J]. Nature, 453(7194): 504-506.
BAO H M, JENKINS K A, KHACHATURYAN M, DIAZ G C.2004. Different sulfate sources and their post-depositional migration in Atacama soils[J]. Earth and Planetary Science Letters, 224(3-4): 577-587.
BAO H M, MICHALSKI G M, THIEMENS M H. 2001a. Sulfate oxygen-17 anomalies in desert vanishes[J]. Geochimica et Cosmochimica Acta, 65(13): 2029-2036.
BAO H M, THIEMENS M H, FARQUHAR J, CAMPBELL D A,LEE C C W, HEINE K, LOOPE D B. 2000b. Anomalous17O compositions in massive sulphate deposits on the earth[J].Nature, 406(6792): 176-178.
BAO H M, THIEMENS M H, HEINE K. 2001b. Oxygen-17 excesses of the central Namib gypcretes: spatial distribution[J].Earth and Planetary Science Letters, 192(2): 125-135.
BIGELEISEN J, MAYER M G. 1947. Calculation of equilibrium constants for isotopic exchange reactions[J]. Journal of Chemical Physical, 15: 261-267.
BRENNINKMEIJER C A M, JANSSEN C, KAISER J,ROCKMANN T, RHEE T S, ASSONOV S S. 2003. Isotope effects in the chemistry of atmospheric trace compounds[J].Chemical Reviews, 103(12): 5125-5161.
CLAYTON R N, GROSSMAN L, MAYEDA T K. 1973. A component of primitive nuclear composition in carbonaceous meteorites[J]. Science, 182(4111): 485-488.
COOPER L W, OLSEN C R, SOLOMON D K, SOLOMON D K,LARSEN I L, COOK R B, GREBMEIER J M. 1991. Stable isotopes of oxygen and natural and fallout radionuclides used for tracing runoff during snowmelt in an arctic watershed[J].Water Resource Research, 27(9): 2171-2179.
GAN Yi-qun, ZHOU Ai-guo, LIU Cun-fu. 2005. The CO2-laser fluorination method: a new technique for simultaneous determination of17O and18O in sulfates[J]. Acta Geoscientica Sinica, 26(S1): 48-50(in Chinese with English abstract).
JANSSEN C, GUENTHER J, MAUERSBERGER K,KRANKOWSKY D. 2001. Kinetic origin of the ozone isotope effect: A critical analysis of enrichments and rate coefficients[J]. Physical Chemistry Chemical Physics, 3(21):4718-4721.
JOHNSON D G, JUCKS K W, TRAUB W A, CHANCE K V. 2000.Isotopic composition of stratospheric ozone[J]. Journal of Geophysical Research-Atmospheres, 105 (D7): 9025-9031.
JOHNSON C A, MAST M A, KESTER C L. 2001. Use of17O/16O to trace atmospherically deposited sulfate in surface waters: a case study in alphine watersheds in the Rocky Mountains[J].Geophysical Research Letters, 28(23):4483-4486.
JOHNSTON J C, THIEMENS M H. 1997. The isotopic composition of tropospheric ozone in three environments[J]. Journal of Geophysical Research-Atmospheres, 102(D21): 25395-25404.
JIANG Shao-yong, YANG Tao, GE Lu, LING Hong-fei, YANG Jing-hong, WU Neng-you, CHEN Dao-hua, LIU Jian. 2005.Sulfate concentrations and carbon isotopic compositions as indicators of marine gas hydrates[J]. Acta Geoscientica Sinica,26(S1): 190-191(in Chinese with English abstract).
KROUSE H R, GRINENKO V A. 1991. Stable isotopes: natural and anthropogenic sulphur in the environment, SCOPE 43[M].Chichester, England: John Wiley and Sons.
KUNASEK S A, ALEXANDER B, STEIG E J, SOFEN E D,JACKSON T L, THIEMENS M H, MCCONNELL J R,GLEASON D J, AMOS H M. 2010. Sulfate sources and oxidation chemistry over the past 230 years from sulfur and oxygen isotopes of sulfate in a West Antarctic ice core[J].Journal of Geophysical Research-Atmospheres, 115: D18313.
LEE C C W. 1997. Multiple stable oxygen isotopic studies of atmospheric sulfate aerosols[C]//Anon. AGU Fall Meeting.Washington D C: American Geophysical Union, 78(46): F111.
LEE C C W, SAVARINO J, THIEMENS M H. 1998. Multiple stable oxygen isotopic studies of sulfate and hydrogen peroxide collected from rain water: a new way to investigate in-situ S(IV) oxidation chemistry by dissolved H2O2in aqueous solution[C]. Anon. AGU Fall Meeting. Washington D.C: American Geophysical Union, 79(45): F91.
LEE C C W, SAVARINO J, THIEMENS M H. 2001. Mass independent oxygen isotopic composition of atmospheric sulfate: origin and implications for the present and past atmospheres of Earth ad Mars[J]. Geophysical Research Letters, 28(9): 1783-1786.
LU Yao-ru, ZHANG Feng-e, YAN Bao-rui, GUO Xiu-hong. 2002.Mechanism of Karst Development in Sulphate Rocks and Its Main Geo-environmental Impacts[J]. Acta Geoscientica Sinica, 23(1): 1-6(in Chinese with English abstract).
LYONS J R. 2001. Transfer of mass-independent fractionation in ozone to other oxygen-containing radicals in the atmosphere[J]. Geophysical Research Letters, 28(17):3231-3234.
MARTIN E, BINDEMAN I. 2009. Mass-independent isotopic signatures of volcanic sulfate from three supereruption ash deposits in Lake Tecopa, California[J]. Earth and Planetary Science Letters, 282(1-4): 102-114.
MATSUHISA Y, GOLDSMITH J R, CLAYTON R N. 1978.Mechanisms of hydrothermal crystallization of quartz at 250℃and 15 kbar[J]. Geochim Cosmochim Acta, 42: 173-182.
MAUERSBERGER K, KRANKOWSKY D, JANSSEN C. 2003.Oxygen isotope processes and transfer reactions[J]. Space Science Reviews, 106(1-4): 265-279.
MCCABE J R, SAVARINO J, ALEXANDER B, GONG S L,THIEMENS M H. 2006 Isotopic constraints on non-photochemical sulfate production in the Arctic winter[J].Geophysical Research Letters, 33(L05810).
MICHEL R L, CAMPBELL D, CLOW D, TURK J T. 2000.Timescales for migration of atmospherically derived sulphate through an alpine/subalpine watershed, Loch Vale,Colorado[J]. Water Resource Research, 36(1): 27-36.
MITCHELL M J, KROUSE H R, MAYER B, ALAN C. 1998. Use of stable isotopes in evaluating sulfur biogeochemistry of forest ecosystems[M]. Amsterdam: Elsevier: 489-518.
ROBERT F, REJOU-MICHEL A, JAVOY M. 1992. Oxygen isotopic homogeneity of the Earth: new evidence[J]. Earth and Planetary Science Letters, 108: 1-9.
SAVARINO J, THIEMENS M H. 1999. Analytical procedure to determine both δ18O and δ17O of H2O2in natural water and first measurements[J]. Atmospheric Environment, 33(22):3683-3690.
UREY H C. 1947. The thermodynamic properties of isotopic substances[J]. Journal of the Chemical Society, 47: 562-581.
VAN STEMPVOORT D R, KROUSE H R. 1994. Controls of δ18O in sulfate, review of experimental data and application to specific environments[M]. Washington DC: ACS Publications:446-480.
YANG Yun-cheng, SHEN Zhao-li, WEN Dong-guang, HOU Guang-cai, ZHAO Zhen-hong, WANG Dong. 2008.Hydrochemical characteristics and sources of sulfate in groundwater of the ordos cretaceous groundwater basin[J].Acta Geoscientica Sinica, 29(5): 553-562(in Chinese with English abstract).
ZHANG Ying-hua, WU Yan-qing, SU Jian-ping, WEN Xiao-hu.2006. Mechanism of groundwater replenishment in Ejina Basin[J]. Journal of Desert Research, 26(1): 96-102(in Chinese with English abstract).
ZHOU Ai-guo, LIU Cun-fu, CAI He-sheng, GAN Yi-qun, LI Xiao-qian, YU Ting-ting, LIU Yun-de. 2008. A new sample preparation technology for determining tri-oxygen isotope in sulfate by Ag2SO4pyrolysis[J]. Acta Geoscientica Sinica,29(6): 673-676(in Chinese with English abstract).
