FS H 对体外培养仔猪睾丸支持细胞CyclinA 2表达的影响
2014-03-11张会琼张姣姣王鲜忠张家骅
张会琼,孙 思,张姣姣,王 怡,王鲜忠,张家骅
(西南大学动物科技学院重庆市牧草与草食家畜重点实验室,重庆 北碚400716)
睾丸支持细胞的增殖能力是决定雄性动物生精能力的重要因素,促卵泡素(FSH)是调节睾丸支持细胞增殖最重要的激素。Walker 等[1]和我们前期的研究发现,在睾丸支持细胞中,FSH 与受体结合后,能通过激活cAMP-PKA、Ca2+、ERK 等多条信号通路调节支持细胞的增殖,但具体影响哪些基因的表达还不清楚。细胞中的细胞周期素A(Cyclin A)控制着细胞DNA 合成的起始,其表达量的变化对于细胞周期的进程有着十分重要的影响[2],Cyclin A2 主要表达于各类体细胞[3],是细胞周期素依赖的蛋白激酶1(Cyclin-dependent kinases,Cdk1)及Cdk2 的调节亚基,启动并控制着DNA 的复制[4]。FSH 是否可以通过影响CyclinA2 的表达进而影响睾丸支持细胞的增殖仍不清楚。本试验利用体外培养的仔猪睾丸支持细胞,研究FSH 是否通过cAMP、Ca2+内流和ERK1/2调节CyclinA2表达的机制,为进一步认识FSH调节体外培养仔猪睾丸支持细胞增殖的分子机制奠定基础。
1 材料与方法
1.1 主要试剂和实验材料 DMEM/F-12 Hams、胎牛血清和VI 型胶原酶(Gibco 公司);胰蛋白酶、FSH、Foskolin、U0126 和RP-cAMP(Sigma 公司);Ca2+通道抑制剂Verapamil(ALEXIS),荧光定量PCR 试剂及SYBR GreenⅠ(Invitrogen);RNApreP pure cell 总RNA提取kit 和TIANScript RT Kit(TIANGEN BIOTECH);其余均为国产分析纯,购自北京鼎国昌盛生物技术有限责任公司。仔猪睾丸采自重庆本地2~3 周龄长白仔猪。
1.2 细胞培养 仔猪睾丸支持细胞的分离培养方法按我们前期建立的方法进行[5-6]。
1.3 不同浓度的FSH 对CyclinA2 mRNA 表达的影响 细胞培养至48 h 左右用不同浓度的FSH(0-100 ng/L)处理30 min,收集细胞提取RNA,检测CyclinA2 mRNA 的丰度。
1.4 FSH 作用不同时间对CyclinA2 mRNA 表达的影响 细胞培养至48 h 左右用FSH(50 ng/mL)处理0,5,30,60,90 min,收集细胞提取RNA,检测CyclinA2 mRNA 的丰度。
1.5 cAMP、Ca2+对FSH 诱导CyclinA2 mRNA 的丰度表达的影响 细胞培养至48 h 左右,用FSH(50 ng/mL)、Foskolin(10 μmol/L),RP-cAMP(10 μmol/L)或Ca2+通道抑制剂Verapamil(0.05 mg/mL)处理30 min,RP-cAMP 或Verapamil 在FSH 处理前2 h 加入,收集细胞提取RNA,检测CyclinA2 mRNA 的丰度。
1.6 ERK1/2 对FSH 诱 导CyclinA2 mRNA 表达的影响 细胞培养至48 h左右,用FSH(50 ng/mL)、U0126(10 μmol/L)、FSH+U0126 处理30 min,并作空白对照,U0126 在FSH 处理前2 h 加入,收集细胞提取RNA,检测CyclinA2 mRNA 的丰度。
1.7 荧光定量PCR 将收集的细胞用RNApreP pure cell 总RNA 提取kit 进行总RNA 提取,并通过电泳进行RNA 纯度鉴定。用TIANScript RT Kit 进行逆转录反应,18S rRNA作为内参照进行实时荧光定量PCR分析,每个样品设3 个重复,具体方法按试剂盒的说明书进行。引物信息如表1。

表1 引物序列
1.8 统计分析 每组数据设3 个重复,结果以X±SE表示,用SPSS 16.0 One way ANOVA 和Tukey′s post hoc test 进行统计分析,P<0.05 确定为差异显著,图中不同的字母表示差异显著。
2 结果
2.1 不同浓度的FSH对CyclinA2 mRNA 表达的影响
从图1 可以看出,在0-50 ng/mL 内,随着FSH 浓度的增加,CyclinA2 mRNA 的表达明显增强(P<0.05);当FSH浓度为50 ng/mL,CyclinA2 mRNA的表达量与对照相比增加了8.58 倍,但是当FSH浓度增加到100 ng/mg 时,CyclinA2 mRNA 的表达量与加入FSH 前相比只增加了8.38 倍(P<0.05)。
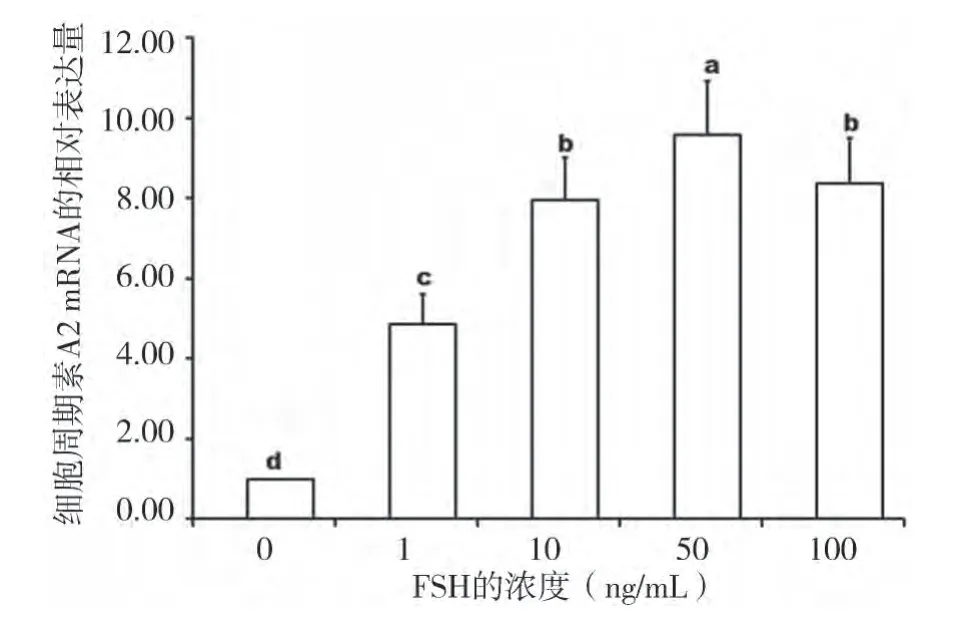
图1 不同浓度的FS H 对C yclinA 2mR NA 表达的影响
2.2 FSH 作用不同时间对CyclinA2 mRNA 的影响
从图2 可以看出,作用15 min 后,CyclinA2 的表达量增加了4.86 倍(P<0.05);30 min 时与对照相比,CyclinA2 的表达量增加了9.03 倍(P<0.05);此后CyclinA2 的表达量有所下降,到90 min 时,CyclinA2的表达量仅为对照的4.38 倍(P<0.05)。
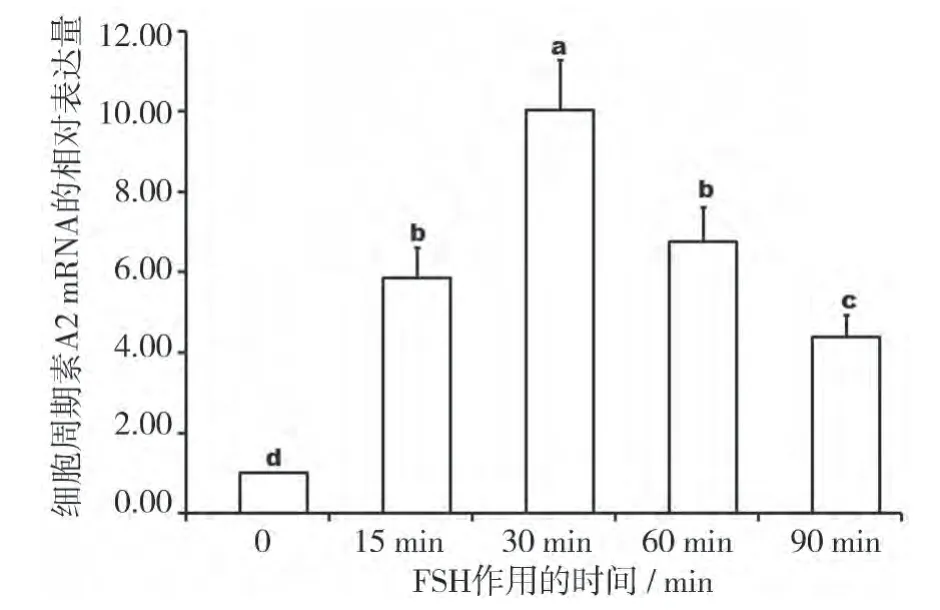
图2 FS H 作用不同时间对C yclinA 2mR NA 的影响
2.3 cAMP、Ca2+在FSH 诱导支持细胞表达CyclinA2 mRNA中的作用 从图3 可以看出,Forskolin 显著促进了CyclinA2的表达,与对照相比增加了8.87倍(P<0.05),但与单独的FSH作用无显著差异(P>0.05)。Rp-cAMP、Verapamil 降低了FSH 诱导的支持细胞的CyclinA2 mRNA 的表达,与仅加入FSH 相比分别降低了27.97%、32.90%(P<0.05),同时加入Rp-cAMP、Verapamil 抑制作用明显增强,CyclinA2 mRNA 的表达量与仅加入FSH 相比下降了61.26%(P<0.05),单独添加Rp-cAMP、Verapamil 对CyclinA2 mRNA 的表达无明显影响(P>0.05)。
2.4 ERK1/2 在FSH 诱导CyclinA2 mRNA 表达中的作用 从图4 可以看出,单独添加ERK1/2 的抑制剂U0126 与空白相比对CyclinA2 的表达无显著差异(P>0.05),当U0126 与FSH 共同作用时显著抑制FSH 诱导的CyclinA2 的表达,与仅有FSH 作用时相比降低了45.09%(P<0.05)。
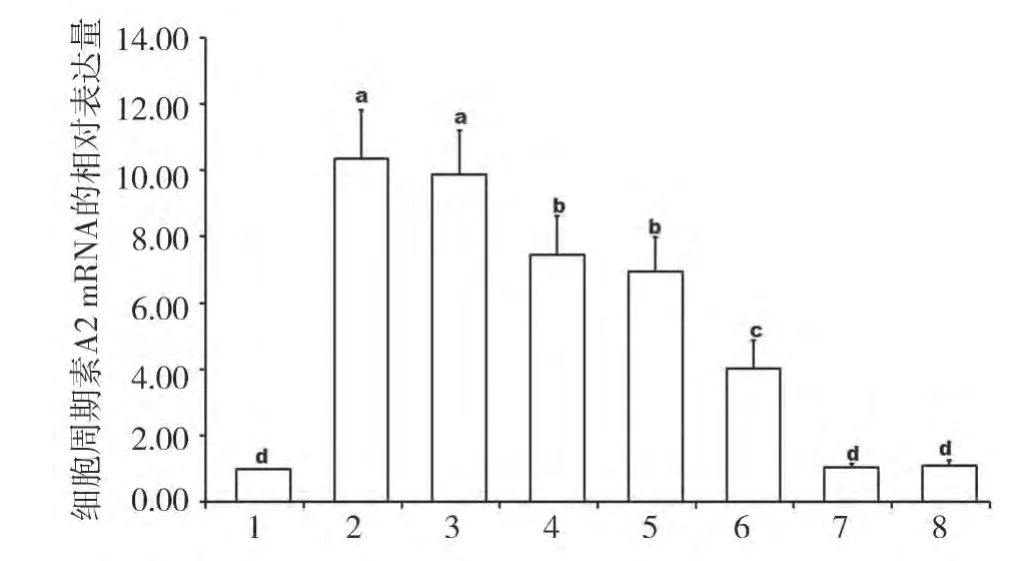
图3 cA M P、C a2+在FS H 诱导支持细胞表达C yclinA 2mR NA 中的作用
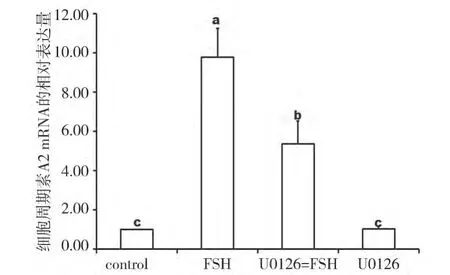
图4 ER K 1/2在FS H 诱导支持细胞表达C yclinA 2mR NA 中的作用
3 讨论与结论
体内试验表明,FSH 能够促进仔猪睾丸支持细胞的增殖[7-8]。本试验发现,FSH 以剂量和时间依赖的方式促进睾丸支持细胞CyclinA2 mRNA 的表达,并且在50 ng/mL、作用30 min 时到达高峰;随着FSH浓度和作用时间进一步增加,其表达量反而呈下降趋势,这可能与FSH 在不同浓度和时间的条件下激活cAMP-ERK1/2 等信号通路,而ERK1/2 在细胞周期中的活性具有一定的周期性有关[6-9],这与FSH 能通过激活cAMP-PKA、Ca2+、ERK 等多条信号通路促进支持细胞的分裂增殖相一致[9]。
本试验中添加cAMP促进剂Forskolin(10 μmol/L)使CyclinA2 mRNA的表达量增加,而加入cAMP 的抑制剂Rp-cAMP 则使CyclinA2 mRNA 的相对表达量下降,这表明FSH 通过影响细胞中cAMP 的水平,进而诱导了CyclinA2 的表达,这与我们前期的研究结果显示细胞内一定浓度的cAMP 能调节Rb 的磷酸化,进而影响细胞的增殖有关相一致[9]。
Ca2+内流在FSH 调节睾丸支持细胞功能中发挥了重要作用[9]。本试验中,在FSH 处理细胞前加入Ca2+通道抑制剂Verapamil 后,CyclinA2 mRNA 的表达量降低,这表明Ca2+可能参与了FSH 调节CyclinA2 mRNA 的表达过程。而同时添加Rp-cAMP 和Verapamil 后,CyclinA2 的表达量降低得更明显,表明cAMP-PKA途径和Ca2+通道途径对FSH调节CyclinA2 mRNA 表达可能具有协同作用,这与我们前期试验发现Rp-cAMP 和Verapamil 在ERK1/2 的激活和细胞增殖方面具有一定协同效应的结果相一致[9]。
试验结果还发现,ERK1/2 的抑制剂U0126 显著抑制了FSH 诱导CyclinA2 的表达,这表明ERK1/2 途径也参与了FSH诱导CyclinA2 的表达。这可能是因为FSH能够引起ERK1/2的磷酸化,而加入U0126后,阻断了ERK1/2的活性,进而抑制Rb的磷酸化所致。我们前期的研究也表明,在仔猪睾丸支持细胞中,FSH主要通过MEK-ERK-RSK级联的途径激活ERK1/2,而且ERK1/2参与了细胞增殖的调节[9]。因此,FSH能够诱导支持细胞产生较低水平的cAMP,cAMP 可以激活细胞内的ERK1/2,活化的ERK1/2 可能影响Rb 磷酸化和后续翻译水平,从而促进了CyclinA2 mRNA 的表达。
[1] Walker W H,Cheng J.FSH and testosterone signaling in Sertoli cells[J].Reproduction,2005,130(1):15-28.
[2] Brown N R,Lowe E D,Petri E,Skamnaki V,Antrobus R,Johnson LN.Cyclin B and cyclin A confer different substrate recognition properties on CDK2 [J].Cell Cycle ,2007,6:1350-1359.
[3] Malumbres M,Barbacid M.Mammalian cyclin-dependent kinases[J].Trends Biochem Sci,2005,30:630-641.
[4] 刘叶.靶向cyclinA2 基因的小干扰RNA 对骨肉瘤细胞增殖的抑制作用[D].杭州:浙江大学,2007.
[5] Wang X Z,Zhao B C,Zhou Y L,et al . 17 beta-Estradiol Regulates Cultured Immature Boar Sertoli Cell Proliferation via the cAMPERK1/2 Pathway and the Estrogen Receptor beta[J].Agricultural Sciences in China,2010,9(8):1201-1210.
[6] Mccoard S A,Lunstra D D,Wise T H,et al . Specific staining of Sertoli cell nuclei and evaluation of Sertoli cell number and proliferative activity in Meishan and White Composite boars during the neonatal period[J].Biol Reprod,2001,64(2):689-695.
[7] Baines H,Nwagwu M O,Hastie G R,et al.Effects of estradiol and FSH on maturation of the testis in the hypogonadal (hpg) mouse[J].Reprod Biol Endocrinol,2008,6:4.
[8] Crepieux P,Marion S,Martinat N,et al.The ERK-dependent signalling is stage-specifically modulated by FSH,during primary Sertoli cell maturation[J].Oncogene,2001,20(34):4696-4709.
[9] 王鲜忠,周玉兰,赵伯川,等.FSH 通过cAMP、Ca2+调节仔猪睾丸支持细胞的增殖[J].畜牧兽医学报,2010,41(10):1240-1245.
