脑缺血后LINGO-1 表达的动态变化及维甲酸对LINGO-1 表达的影响
2014-03-11孟二艳邢宏义
孟二艳,邢宏义
中枢神经系统损伤后再生能力的缺乏是神经永久性损害的主要原因。近年来Nogo 与神经轴突再生抑制的研究成为热点[1]。Nogo 受体复合体包括Nogo 受体1(NgR1)、LINGO-1、以 及p75NTR 或TROY[2]。LINGO-1(LRR and Ig domain-containing Nogo receptor interacting protein)是Nogo 受体复合物种中的一种重要的跨膜蛋白,由614 个氨基酸组成,其N 端含有12 个LRR,C 端有帽子结构域,有一个Ig 区域,一个跨膜区和一个具有信号传导功能的细胞内尾端。在正常中枢神经系统发育中LINGO-1的表达受到调控,体内外实验证实LINGO-1 也负向调节少突胶质细胞分化、髓鞘形成、神经元存活和轴突再生[3]。LINGO-1 的发现对研究神经再生障碍这一难题带来了曙光,近年来日益成为神经损伤后研究的热点。目前国内外对LINGO-1 在脑缺血后神经细胞恢复中的作用的研究报道甚少。本研究观察脑缺血后LINGO-1 表达的动态变化和维甲酸对LINGO-1 表达的影响,旨在探讨LINGO-1 在缺血性脑损伤中的可能作用。
1 材料和方法
1.1 实验动物和分组 成年SD 雄性大鼠,体重180~200 g,由同济医学院动物实验中心提供。直径为0.20 mm 和0.24 mm 的MCAO 线栓购自北京沙东生物技术有限公司。SD 大鼠35 只,用于研究脑缺血后LINGO-1 表达的动态变化,分为7 组,每组5 只,即假手术组、6 h 组、1 d 组、3 d 组、7 d组、14 d 组、21 d 组;SD 大鼠15 只,用于研究维甲酸(RA)对脑缺血后LINGO-1 表达的影响,实验分为3 组,每组5 只,即假手术组、缺血组和RA 治疗组。维甲酸(RA)用二甲基亚砜(DMSO)溶解成浓度为3 mg/ml 的溶液,于脑缺血24 h 后腹腔注射,给药剂量为每只大鼠每天10 mg/kg。假手术组:不做任何处理;缺血组:脑缺血24 h 后每只大鼠每天给予10 mg/kg 的溶剂DMSO 腹腔注射;RA 治疗组:脑缺血24 h 后每只大鼠每天给予10 mg/kg 的RA腹腔注射。观察脑缺血后第14 天维甲酸(RA)对脑缺血后LINGO-1 表达的影响。
1.2 大鼠脑缺血模型(MCAO)制备 所有SD雄性大鼠均在术前禁食8 h,禁水4 h。10%水合氯醛3 ml/kg 腹腔注射麻醉动物。常规消毒后切开颈部正中皮肤,钝性分离皮下组织后,分离出颈总动脉、颈内动脉和颈外动脉,结扎颈总动脉近心端,在颈总动脉分叉下方4 mm 处做血管切口,插入直径为0.20 mm 或0.24 mm 的顶端涂有多聚-L-赖氨酸的线栓,从颈内动脉入颅方向继续插入线栓至黑色标记相距颈总动脉分叉处约2 mm,此时共插入线栓长度为20~21 mm,其前端阻塞大脑中动脉开口处,结扎固定线栓。依次缝合各层组织和皮肤,碘酒消毒后剪去滞留在外面的栓线制成永久性闭塞模型。假手术组动物插线深度10 mm,其余操作均同手术组。
1.3 LINGO-1 蛋白免疫印迹技术(Western blots)脑组织在0.01 mol pH 7.2 的PBS 中匀浆,离心,按比例加入1X 裂解液,置于冰上20 min,并不断搅拌,12000 g 于4 ℃离心8 min,上清液用5 倍缓冲液稀释,煮沸10 min,用于SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)。制备分离胶和浓缩胶,上样。电泳:开始为80 V,当跑过浓缩胶后,将电压加大到180 V,继续电泳至溴酚蓝跑到凝胶底部。将凝胶上的蛋白转移到PVDF 膜,以实验室用5%的脱脂奶粉封闭膜,加入用5%脱脂牛奶按1000∶1 稀释的第一抗体(兔抗LINGO-1 多克隆抗体),4 ℃孵育过夜。洗膜后加入以5%脱脂牛奶稀释的HRP 标记的驴抗兔二抗(4000∶1),37 ℃摇床孵育2 h,漂洗后在增强的化学发光(enhanced chemoluminescence,ECL)溶液中显色,用Chemi Doc XPS 系统扫描,用Image Lab 3.0 图像分析软件测量LINGO-1 蛋白和β-actin 蛋白各显色条带的平均光密度值。
1.4 统计分析 所有实验数据均用Graphpad 5.0 统计软件进行整理并分析,数据用均值±标准差(±s)表示,各组间差异的比较用单因素方差分析,P<0.05 表示差异有统计学意义。
2 结果
2.1 脑缺血后LINGO-1 蛋白表达的变化规律LINGO-1 蛋白的表达在假手术组为0.287±0.017,脑缺血后6 h 显著上升至0.537±0.090(P<0.05),3 d时略回调至0.486±0.107,其后LINGO-1 蛋白表达逐渐升高,在14 d 达到高峰(1.538±0.083)(见图1)。
2.2 维甲酸(RA)抑制脑缺血后LINGO-1 的表达 本研究发现脑缺血后LINGO-1 蛋白的表达与假手术组相比均明显升高,且在脑缺血第14 天时其表达到高峰。故选择第14 天为时间观察点,分析维甲酸对LINGO-1 表达的抑制作用(见图2)。结果表明维甲酸能够抑制脑缺血后LINGO-1 蛋白的表达。
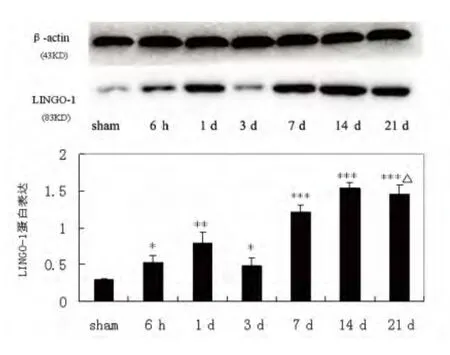
图1 LINGO-1 蛋白在MCAO 后不同时间点的表达
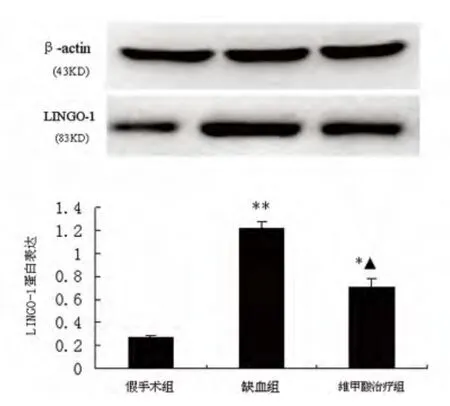
图2 维甲酸抑制脑缺血后LINGO-1 的表达
3 讨论
脑缺血是CNS 损伤后导致神经功能障碍的常见疾病,中枢神经系统损伤后,神经元轴突不能够有效再生与轴突生长抑制因子有关,例如髓鞘相关抑制因子(MAIFs)与Nogo 受体复合物结合,激活RhoA,进而激活下游的RhoA 激酶(Rho-kinase,ROCK),活化的ROCK 使细胞骨架动力学改变引起神经元内的生长锥溃变,从而抑制轴突再生[1]。有研究表明,Nogo 受体复合物是CNS 髓磷脂中各种轴突生长抑制性蛋白发挥作用的集中点[4]。LINGO-1是传递髓鞘抑制信号的Nogo 受体复合物中的重要一员[5],为脑内专有蛋白,高度表达于脑内神经元和少突胶质细胞,并在少突胶质细胞前体细胞(OPC)中呈高水平表达,与NgR 共分布,在脊髓中低水平表达,但不存在于机体其它组织。正常中枢神经系统发育中LINGO-1 表达受到调控,且在人或鼠的神经病理模型中其表达上调。然而,脑缺血后LINGO-1 蛋白表达是否上调仍不是很清楚。本研究显示脑缺血后LINGO-1 表达于6 h 开始增加,1 d 时继续增加,3 d 时却明显减少,但7 d 时LINGO-1 表达又逐渐增加,14 d 时达高峰,21 d 时不再增加。简言之,在脑梗死周边区,LINGO-1 表达先短暂升高,然后下降,再在高水平稳定表达,在此过程中出现两次表达高峰。前一个表达高峰的出现可能是缺血性脑损伤后神经元的应激反应。LINGO-1 在3 d时明显减少可能由于梗死使脑组织缺血,缺氧引起不同程度神经元和少突胶质细胞变性、坏死,髓鞘脱失,轴索断裂导致各种蛋白的合成和运输功能均降低。LINGO-1 表达的第2 个高峰可能是因为随着侧枝循环的形成和缺血再灌注,梗死周边区仅具有功能改变的神经元和少突胶质细胞恢复,使LINGO-1表达又逐渐升高并稳定在较高水平。推测脑缺血早期LINGO-1 表达即开始增加,特别是LINGO-1 在7 d后长期高水平维持可能是脑缺血后神经再生障碍的原因之一,LINGO-1 可能在脑缺血早期即发挥抑制轴突再生作用。
有研究表明,Nogo 受体复合物是CNS 髓磷脂中各种轴突生长抑制性蛋白发挥作用的集中点。大鼠大脑中动脉闭塞后,NgR 拮抗剂可使轴突再生增加[6]。同时体内外实验证实LINGO-1 负向调节少突胶质细胞分化,髓鞘形成,神经元存活和轴突再生[3]。维生素A 酸(维甲酸,retinoic acid,RA)是食物中维生素A 消化降解产物,脂溶性维生素A 衍生物,能通过血脑屏障,是核受体维甲酸受体(RAR)的配体。Puttagunta 等[7,8]的体内外研究首次证实了RA-RARβ 通路与NgR 复合体通路在神经突延长和再生方面的直接关系。RA 和RARβ 结合后再与LINGO-1 启动子上的维甲酸反应成分(RARE)结合,抑制LINGO-1 基因转录,减少RhoA 激活,促进神经突生长。研究已证实了脊髓损伤后用RA 治疗可抑制LINGO-1 的表达,促进神经突生长和功能恢复,这些研究为中枢神经损伤提供了新的治疗靶点。本研究表明,在脑缺血后14 d,RA 组与CI 组相比,RA 组LINGO-1 蛋白的表达降低,提示RA 抑制了LINGO-1 蛋白的表达。有研究表明,抑制LINGO-1的表达或抑制RhoA 激活可促进脊髓损伤后轴突发芽和神经功能恢复[9]。LINGO-1 拮抗剂可促进轴突发芽,改善神经功能恢复,减少RhoA 激活,增加少突胶质细胞和神经元的存活[10],这些都为RA 在脑缺血中的应用提供了依据。
[1]He Z,and Koprivica V.The Nogo signaling pathway for regeneration block[J].Annu Rev Neurosci,2004,27:341-368.
[2]Park JB,Yiu G,Kaneko S,et al.A TNF receptor family member,TROY,is a coreceptor with Nogo receptor in mediating the inhibitory activity of myelin inhibitors[J].Neuron,2005,45:345-351.
[3]Mi S,Sandrock A,Miller RH.LINGO-1 and its role in CNS repair[J].Int J Biochem Cell Biol,2008,40:1971-1978.
[4]McGee AW,Strittmater SM.The Nogo receptor:focusing myelin inhibition of axon regeneration[J].Trend Neurosci,2003,26(4):193-198.
[5]McGee AW,Yang Y,Fischer QS,et al.Experience-driven plasticity of visual cortex limited by myelin and Nogo receptor[J].Science,2005,309(5744):2222-2226.
[6]Lee JK,Kim JE,Sivula M,et al.Nogo receptor antagonist promotes functional recovery by enhancing axonal plasticity[J].J Neurosci,2004,24(27):6209-6217.
[7]Puttagunta R,Schmandke A,Floriddia E,et al.RA-RAR-beta counteracts myelin-dependent inhibition of neurite outgrowth via Lingo-1 repression[J].J Cell Biol,2011,193:1147-1156.
[8]Puttagunta R,Giovanni SD.Retinoic acid signaling in axonal regeneration[J].J Front Mol Neurosci,2012,4:1-9.
[9]Fournier AE,Takizawa BT,Strittmatter SM.Rho kinase inhibition enhances axonal regeneration in the injured CNS[J].J Neurosci,2003,23:1416-1423.
[10]Ji B,Li M,Wu WT,et al.LINGO-1 antagonist promotes functional recovery and axonal sprouting after spinal cord injury[J].Mol Cell Neurosci,2006,33:311-320.
