大鼠局灶性脑缺血预处理后IRE1 表达的变化
2014-03-11胡跃强胡玉英秦红玲
胡跃强,唐 农,吴 林,胡玉英,梁 妮,秦红玲
脑缺血预处理(brain ischemic preconditioning,BIP)是近年发现的重要内源性神经保护机制,可使脑组织对以后较长时间的缺血性损伤产生明显的耐受。然而,有关BIP 的神经保护作用机制远未阐明。最近有研究发现内质网应激(endoplasmic reticulum stress,ERS)在此环节中发挥了关键作用。作为内质网膜上具有感受腔内未折叠蛋白堆积的跨膜蛋白-肌醇需求激酶(inositol requiring enzyme 1,IRE1),在一定条件下通过寡聚体化而激活,在决定细胞最终生存或死亡上起着至关重要的作用[1]。本研究意在通过检测局灶性BIP 后IRE1 mRNA 及蛋白在脑内的表达变化及神经细胞凋亡情况,以进一步研究BIP 的神经保护机制,并为脑缺血的治疗提供新靶点。
1 材料和方法
1.1 动物分组及处理 健康雄性SD 大鼠120 只(广西医科大学实验动物中心提供,合格证号:SCXK 桂2009-0002,SPF 级),体重(250±20)g。随机将大鼠分为3 组:假手术组(sham-operation,SO)、大脑中动脉缺血组(MCAO)、脑缺血预处理组(BIP)。每组按照再缺血后12 h、1 d、2 d、3 d 4 个时间点平均分为4 个亚组(n=10)。分别作如下处理:SO 组:以假手术代替预缺血及缺血再灌注;MCAO 组:以假手术代替预缺血,其余步骤同BIP组;BIP 组:MCAO10 min 后抽出栓线,完成预缺血,3 d后再次行MCAO 2 h,再灌注后12 h、1 d、2 d、3 d处死大鼠。
1.2 动物模型及标本制备 参照Longa 的线栓法进行造模。采用大脑中动脉二次线栓法[2]制备大鼠脑缺血预处理模型,结扎大鼠左颈外动脉远端和颈总动脉近端,将前端用火焰烧圆的尼龙线从颈总动脉残端插入,进线约18~20 mm,MCAO 后10 min 抽出线栓,完成预缺血,3 d 后再次行MCAO 2 h。再灌注后在规定时间点处死动物取脑。以顶叶大脑皮质缺血半暗带区为主要取材与观察部位[3]。
1.3 主要试剂 兔抗大鼠IRE1 多克隆抗体,美国Santa Cruz 公司;偶联有辣根过氧化物(HRP)的羊抗兔IgG 二抗,博士德公司;内参GAPDH,康成生物公司。总RNA 提取试剂盒,TIANGEN 公司;PCR 反应试剂盒及逆转录试剂盒,TaKaRa 公司;引物及内参均由大连宝生物有限公司提供。
1.4 缺血半暗带脑皮质IRE1 mRNA 表达测定 (1)大脑组织总RNA 提取:参考Trizol 试剂盒说明书提取总mRNA;(2)引物合成:荧光定量RTPCR 所用的IRE1 和GAPDH 引物序列如下:IRE1,上游5’-GACGGACAGAATACACCATCAC-3’,下游5’-CCACCACAGGAGAGGCATAG-3’,产物长度213 bp;GAPDH,上游5’-GACAACTTTGGCATCGTGGA-3’,下游5’-ATGCAGGGATGATGTTCTG G-3’,产物长度133 bp;(3)比较两基因扩增效率:选取cDNA样品模板进行5 倍梯度稀释,IRE1 与GAPDH 分别进行real-time PCR 反应,得出荧光曲线,基因表达的相对定量基于比较CT(threshold cycle)值法;(4)反应体系及条件:两种基因同管扩增,反应体系均为10 μl,其中SYBR Premix Ex Taq Ⅱ(2×)5 μl,cDNA 模板1.0 μl、两种基因上下游引物(10 pmol)各0.4 μl、探针(10 pmol)各0.4 μl,加无RNA 酶的水至3.2 μl。在DNA Engine Opticon TM 2 连续荧光检测系统(MJ Research 公司)中进行扩增反应。反应条件为:94 ℃预变性30 s,95 ℃5 s,60.2 ℃20 s,60.0 ℃20 s,40 个循环,4 ℃保存。每例样品及阴性对照均设3 个平行复孔,取均;(5)反应结束后仪器自动显示IRE1 与GADPH 的实时荧光曲线,通过cDNA 浓度梯度的log 值对ΔCT 值(ΔCT 表示目的基因与内参基因CT 值之差)作图,所得直线斜率为0.0098(斜率绝对值<0.1),说明目标基因和内参基因GADPH 扩增效率相同,采用比较CT 值法计算IRE1 mRNA 相对定量表达。ΔCT 值与mRNA 表达量成反比,即ΔCT 值越小,表明mRNA 表达量越多。
1.5 缺血半暗带脑皮质内IRE1 蛋白表达测定 大鼠迅速断头取脑,冰上分离缺血侧顶叶大脑皮质约100 mg,冰上研磨组织后加预冷的蛋白裂解液,继续碾磨至液态,然后4 ℃,12000 r/min 离心30 min,留上清液,取20 μl 用BCA 法进行蛋白定量测定,所剩上清液按4∶1 的比例加变性5×上样缓冲液,100 ℃水浴10 min。取蛋白样品(60 μg)采用10%SDS-PAGE 垂直电泳进行分离,然后转至PVDF膜上进行免疫反应。5%脱脂奶粉室温封闭2 h,然后依次加入兔抗IRE1 抗体(1∶1000),37 ℃孵育2 h,4 ℃过夜;偶联有辣根过氧化物(HRP)的羊抗兔IgG(1∶2000)室温孵育2 h,Beyo ECL Plus 超敏发光液中X-感光盒内曝光。以上反应均在塑料袋内进行,其间用PBS 充分洗涤。将胶片进行扫描或拍照,采用Alpha Ease FC 软件进行图像分析,获取各组Western blot 条带的平均吸光度(A)值,内参为GAPDH,目的蛋白与内参光密度比值即为目的蛋白的相对值。
1.6 神经细胞凋亡率检测 采用Annexin V/PI 双染色法。大鼠迅速断头取脑,分离缺血半暗带脑组织100 mg,1.25g/L-1胰蛋白酶消化后制备单细胞悬液,70%乙醇4 ℃过夜固定样品,次日离心弃乙醇收集细胞,加入50 mg/L-1RNase,37 ℃孵育30 min,用Annexin V FITC/PI 双染标记细胞,利用美国贝克曼-库尔特FC 500 流式细胞仪检测细胞凋亡率(按试剂盒中说明书操作)。
2 结果
2.1 IRE1 mRNA 表达变化 实时荧光定量PCR 显示:SO 组有少量IRE1 mRNA 表达;MCAO 组大鼠脑缺血再灌注12 h IRE1 mRNA 表达明显上升,24 h 表达达高峰(P<0.01),随再灌注时间延长其表达逐渐下降,但仍保持较高表达水平(P<0.01);BIP 组缺血各时间点其表达水平较MCAO 组均明显升高(P<0.05,P<0.01)(见表1)。
2.2 IRE1 蛋白表达的变化 Western blot 显示:SO 组有少量IRE1 蛋白表达;MCAO 组12 h 缺血半暗带IRE1 蛋白表达开始显著增加,24 h 达高峰,随再灌注时间延长其表达逐渐下降(P<0.01),但仍保持较高表达水平(P<0.01);BIP 组缺血各时间点其表达水平较MCAO 组均显著升高(P<0.05,P<0.01)(见表2、图1)。
2.3 神经细胞凋亡率变化 流式细胞术表明:SO 组未见明显的凋亡峰,其细胞凋亡百分率很低。脑缺血再灌注12 h 后,MCAO 组缺血半暗带细胞凋亡发生率较SO 组显著增加,1 d 时达到高峰(P<0.01),以后时间点逐渐下降,但仍高于SO 组(P<0.01);BIP 组各个时间点神经元凋亡发生率较MCAO 组明显降低(P<0.01,P<0.05)。这提示BIP 可能具有减轻脑缺血再灌注后神经元凋亡的作用(见表3)。
表1 大鼠顶叶皮质IRE1 mRNA 表达的ΔCT 比较(±s,n=5)

表1 大鼠顶叶皮质IRE1 mRNA 表达的ΔCT 比较(±s,n=5)
与SO 组比较#P<0.01;与MCAO 组同时间点比较* P<0.05,**P<0.01
表2 大鼠顶叶皮质IRE1 蛋白表达的光密度值比较(±s,n=5)

表2 大鼠顶叶皮质IRE1 蛋白表达的光密度值比较(±s,n=5)
与SO 组比较#P<0.01;与MCAO 组同时间点比较* P<0.05,**P<0.01
表3 各组大鼠神经细胞凋亡率比较(±s,%)
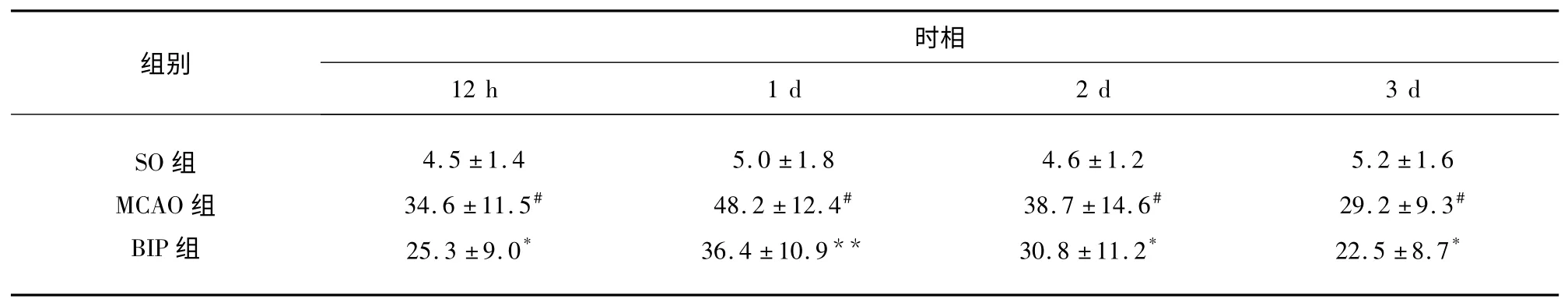
表3 各组大鼠神经细胞凋亡率比较(±s,%)
与SO 组比#P<0.01;与MCAO 组同时间点比* P<0.05,**P<0.01
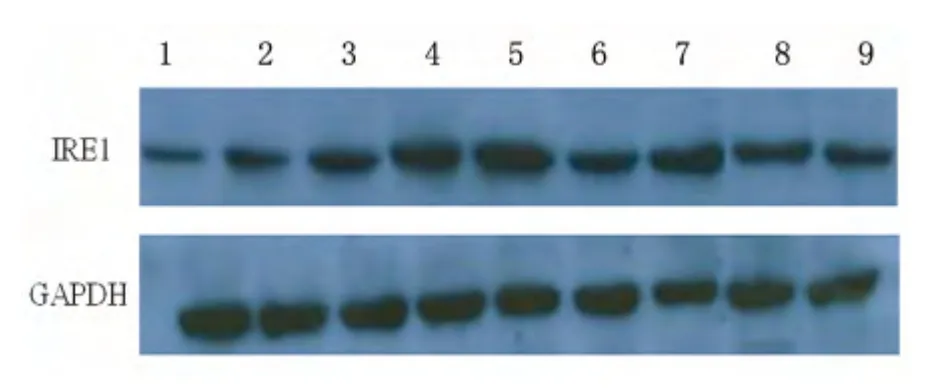
图1 IRE1 蛋白的表达(Western blot),1~9 道分别代表SO 组,MCAO12 h、BIP12 h、MCAO1 d、BIP 1 d、MCAO 2 d、BIP 2 d、BIP 3 d 和MCAO 3 d 组
3 讨论
BIP 是指对脑组织采用机械刺激,如一次或多次短暂性脑缺血再灌注后,诱导脑组织产生内源性保护机制,使其对以后较长时间的缺血性损伤产生显著的耐受,这种现象又称为脑缺血耐受。1990 年,Kitagawa 等[4]首先在沙土鼠脑缺血模型上观察到缺血预处理的保护现象,即一次或多次短暂非致死性脑缺血再灌注能够诱导该缺血组织对以后较长时间的致死性缺血损伤产生显著的耐受性,一般认为是脑的一种对缺血的适应性机制。此外,Moncayo 等[5]对临床上有或无短暂性脑缺血发作(TIA)的患者进行回顾性研究时发现,具有TIA 发作史者卒中的损害程度较小,预后较好,这支持TIA 引起缺血耐受。可见探讨BIP 的脑保护机制具有重要的科学意义,并将为其临床应用提供新的思路。
迄今为止,有关BIP 的神经保护作用机制远未阐明。研究表明耐受是涉及递质、受体、通道、基因表达、蛋白质合成的多环节调控的复杂生物学过程。最近有研究发现[6]:BIP 可激发适当的ERS,通过UPR 暂时抑制蛋白合成,上调内质网伴侣蛋白、折叠酶等,从而增强了细胞在后继缺血过程中处理误折叠蛋白的能力,减少误折叠蛋白在ER 腔内的聚集,减少细胞凋亡的发生,减轻组织损伤。ERS 激活UPR 是引起凋亡的重要因素,存在明显UPR 的神经元后来出现凋亡,但机制尚未完全阐明。现已知哺乳动物的UPR 信号转导形成了3 条互相联系的通路即IRE1、PERK 和ATF6 通路,其中IRE1 通路在ERS反应过程中具有承上启下的作用,一系列研究证实这个通路在ER 稳态、代谢和免疫应答调节中的新作用[7]。IRE1 是I 型跨膜蛋白,具有丝/苏蛋白激酶和位点特异的核酸内切酶活性,当内质网中误折叠蛋白出现时,促使葡萄糖调节蛋白78(GRP78)与IRE1解离,IRE1 寡聚磷酸化并激活。IRE1 活化后,可以特异地剪接XBP-1 mRNA,合成XBP1 蛋白[8],并使其与IRE1 特定位点结合[9],导致GRP78 上调,从而引导蛋白质正确折叠。体内外研究揭示缺血或缺氧所致的IRE1 通路活化所致的蛋白质合成抑制在短时间内与细胞的自我保护、促进细胞存活有关,长时间的蛋白质合成抑制则可通过一些致凋亡基因如Gadd153 等的表达诱导细胞凋亡[10]。
本实验通过建立预缺血模型以模拟临床TIA 情况。研究发现,脑缺血120 min 再灌12 h 缺血侧顶叶皮质IRE1mRNA 及其蛋白表达开始上升,24 h 表达达高峰,随再灌注时间延长其表达逐渐下降,再灌注72 h 仍可见其高表达,提示大鼠缺血再灌注损伤后存在其活化,这与相关研究报道相一致[9,11]。结合神经细胞凋亡率在I/R 后1 d 时达到高峰,提示I/R 后IRE1 表达上调参与了细胞凋亡。而BIP 干预后其活化程度均有明显的上升,提示BIP 可能通过影响ERS 后IRE1 基因的表达而抑制细胞凋亡,从而保护神经细胞,以使细胞适应应激而存活。这些结果可能为I/R 损伤的治疗提供新靶点和新思路。其机制有待于进一步研究。
[1]Oikawa D,KinataY,Kohno K.Self-association and BiP dissociation are not sufficient for activation of the ER stress sensor Ire1[J].J Cell Sci,2007,120(9):1681-1688.
[2]郝玉曼,罗祖明,周 东.局灶预缺血诱导脑缺血耐受的动物模型[J].中风与神经疾病杂志,2003,20(3):129-130.
[3]Zhao H,Shimohata T,Wang JQ,et al.Akt contributes to neuroprotection by hypothermia against cerebral ischemia in rats[J].Neurosci,2005,25:9794-9806.
[4]Kitagawa K,Matsumoto M,Tagaya M,et al.“Ischemic tolerance”phenomenon found in the brain[J].Brain Res,1990,528:21-24.
[5]Moncayo J,de Freitas GR,Bogousslavsky J,et al.Do transient ischemic attacks have a neuroprotective effect[J].Neurology,2000,54:2089-2094.
[6]DeGracia DJ,Montie HL.Cerebral ischemia and the unfolded protein response[J].J Neurochem,2004,91:1-8.
[7]Randal JK,Siyan C.Inositol-requiring 1/X-box-binding protein 1 is a regulatory hub that links endoplasmic reticulum homeostasis with innate immunity and metabolism[J].EMBO Mol Med,2010,2:189-192.
[8]Credle JJ,Finer-Moore JS,Papa FR,et al.On the mechanism of sensing unfolded protein in the endoplasmic reticulum[J].Proc Natl Acad Sci USA,2005,102(52):18773-18784.
[9]Gharibani PM,Modi J,Pan C,et al.The mechanism of taurine protection against endoplasmic reticulum stress in an animal stroke model of cerebral artery occlusion and stroke-related conditions in primary neuronal cell culture[J].Adv Exp Med Biol,2013,776:241-258.
[10]Shibata M,Hattori H,Sasaki T,et al.Activation of caspase-12 by endoplasmic reticulum stress induced by transient middle cerebral artery occlusion in mice[J].Neuroscience,2003,118:491-499.
[11]Kumar R,Krause GS,Yoshida H,et al.Dysfunction of the unfolded protein response during global brain isehemia and reperfusion[J].J Cereb Blood Flow Metab,2003,23:462-471.
