反相高效液相色谱法测定麻仁丸中苦杏仁苷和芍药苷的含量
2014-03-10刘立新柳兵吴都医药牛尾巴大药房湖北鄂州436054
刘立新,柳兵 (吴都医药牛尾巴大药房,湖北 鄂州436054)
谈发明 (宜昌市中医院,湖北 宜昌443003)
麻仁丸由火麻仁、大黄、芦荟、白芍、枳实、苦杏仁等中药组成,具有泻热通肠、凉血解毒、逐瘀通经之功效[1]。苦杏仁苷是苦杏仁的主要有效成分,苦杏仁苷在经酶作用分解形成氢氰酸的同时,也产生苯甲醛,后者可抑制胃蛋白酶的活性,从而影响消化功能[2]。芍药性微寒、味苦酸,有养血柔肝、缓中止痛、敛阴收汗的功能,芍药苷是芍药的主要有效成分之一[3]。笔者参照有关文献,采用反相高效液相色谱法 (reversed phase high-performance liquid chromatography,RP-HPLC),建立麻仁丸中苦杏仁苷和芍药苷的含量测定方法,为麻仁丸的质量控制和评价提供一定的科学依据。
1 仪器与试剂
Dionex-P680液相色谱仪,UVD170U检测器,四元低压梯度泵,HKZJZ2830171BAF戴安变色龙高效液相数据处理系统,美国戴安公司;5200H型超声波清洗器,上海科导超声仪器有限公司;SZ-97自动三重纯水蒸馏器,上海亚荣生化仪器厂;AT-201电子分析天 (d=0.01mg,瑞士);麻仁丸 (按2010版药典自制);苦杏仁苷对照品,供含量测定用,中国药品生物检定所,批号:110820-201305;芍药苷对照品,供含量测定用,中国药品生物检定所,批号:736-200320;乙腈为色谱纯;水为重蒸馏水 (自制);甲酸等其他试剂均为分析纯。
2 方法与结果
2.1 溶液的配制
2.1.1 对照品溶液的制备 取经五氧化二磷减压干燥器中干燥36h的苦杏仁苷对照品和芍药苷对照品适量,分别精密称定,加甲醇制成每1ml含苦杏仁苷和芍药苷各100μg的溶液。
2.1.2 麻仁丸供试品溶液的制备 参照文献 [4-5]。
2.1.3 阴性对照溶液的制备 按麻仁丸处方比例和工艺,制备不含苦杏仁和白芍的阴性样品。按供试品溶液制备方法制得阴性对照溶液。
2.2 色谱条件
色谱柱:Aglient TC-C18柱 (4.6mm×250mm,5μm);流动相:乙腈-0.1% (11:89);流速:1.0ml/min;柱温:30℃;检测波长:221nm[6-7]。
2.3 系统适用性试验
取对照品溶液、供试品溶液、阴性对照溶液各10μl进样,按照上述色谱条件测定,记录色谱图。结果:理论板数按苦杏仁苷峰计算不低于7000,按芍药苷峰计算不低于10000,苦杏仁苷和芍药苷峰与其它杂质峰分离度均大于1.5,峰形对称,阴性无干扰。对照品溶液、供试品溶液、阴性对照溶液在此色谱条件下的色谱图见图1~3。
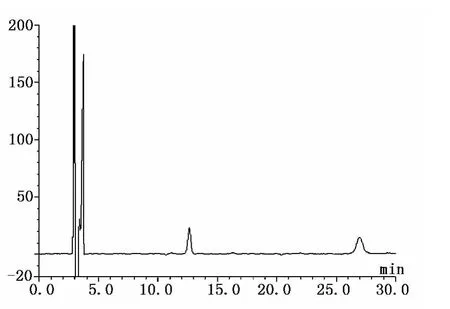
图1 对照品溶液色谱图
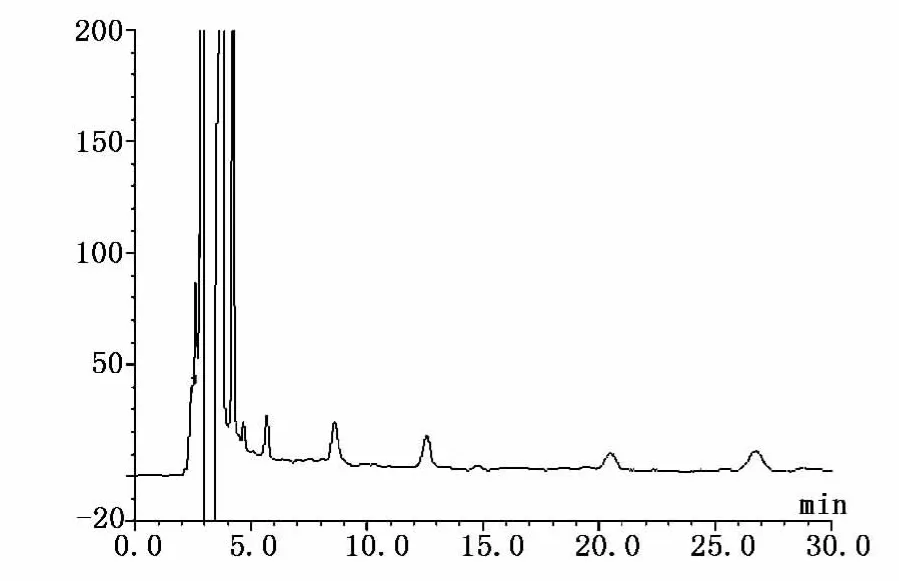
图2 供试品溶液色谱图

图3 阴性对照溶液色谱图
2.4 线性关系考察
制备浓度为200μg/ml的苦杏仁苷和200μg/ml的芍药苷的混合对照品溶液,精密吸取上述对照品溶液1、2、4、6、8、10ml分别置于10ml容量瓶中,加入甲醇定容,摇匀。分别精密吸取上述对照品溶液10μl,各进样2次,按上述色谱条件测定。以峰面积平均值为纵坐标 (Y),以进样量为横坐标(X)绘制标准曲线。结果表明,苦杏仁苷在0.2~2.0μg范围内线性关系良好,回归方程为Y=0.1955X+6.7365,r=0.9996;芍药苷在0.2~2.0μg范围内线性关系良好,回归方程Y=0.1256X+7.5868,r=0.9993。
2.5 精密度试验
精密吸取苦杏仁苷、芍药苷对照品溶液10μl,连续进样6次,按上述色谱条件测定,结果苦杏仁苷的峰面积RSD为0.31%,芍药苷的峰面积RSD为0.45%。表明精密度良好。
2.6 稳定性试验
取同一供试品溶液,按上述色谱条件,分别于0、2、4、8、12、24h测定峰面积。苦杏仁苷的峰面积RSD为0.60%,芍药苷的峰面积RSD为0.98%,试验结果表明,供试品溶液在24h内稳定性良好。
2.7 重复性试验
按照含量测定的方法,对同一样品测定5次,结果苦杏仁苷和芍药苷含量平均值分别为2.2387mg/g、2.2278mg/g,RSD分别为1.3%、1.1%。
2.8 加样回收试验
取已知含量的麻仁丸样品 (苦杏仁苷含量为2.2387mg/g、芍药苷含量为2.2278mg/g)6份,每份约0.7g,精密称定,分别置具塞锥形瓶中,分别精密加入对照品溶液15ml,精密加甲醇35ml,按2.1.2项下供试品溶液制备方法制备,分别按上述色谱条件测定。结果见表1、2,表明本法苦杏仁苷和芍药苷回收率为分别为99.36%、99.16%,RSD分别为1.3%、2.0%。

表1 苦杏仁苷加样回收试验结果
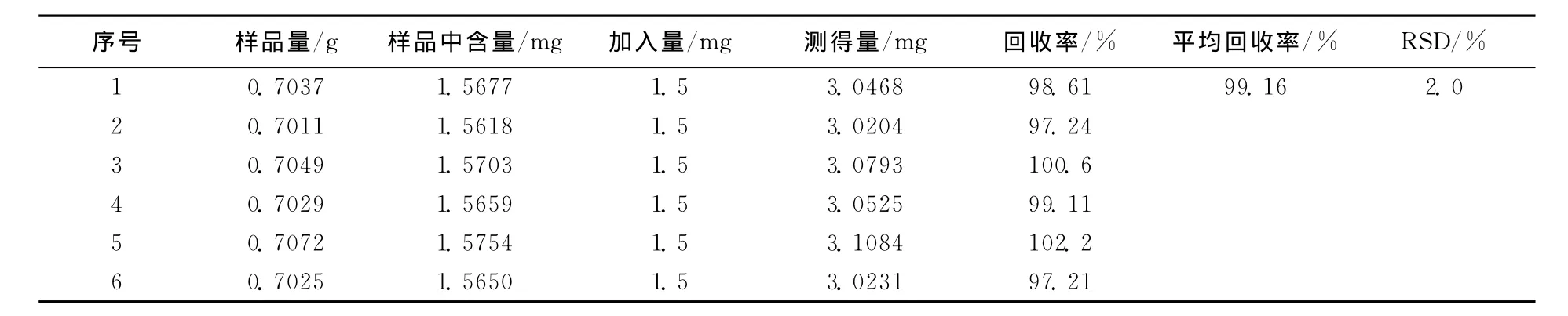
表2 芍药苷加样回收试验结果
2.9 含量测定
按上述含量测定方法,对3批麻仁丸的含量进行测定,外标法计算样品中苦杏仁苷和芍药苷的含量,结果见表3。

表3 麻仁丸中苦杏仁苷和芍药苷的含量测定结果
3 讨论
本试验用RP-HPLC法,流动相为乙腈-0.1%甲酸 (11∶89),可使苦杏仁苷和芍药苷有良好的分离度。选择测定波长时,苦杏仁苷最大吸收波长208nm,而芍药苷为230nm,我们选定217、219、211、213nm4个波长进行比较,经试验确定221nm时苦杏仁苷和芍药苷的检测灵敏度比较好。此方法简便、准确、重现性好、精密度高,阴性无干扰,可作为麻仁丸中苦杏仁苷和芍药苷含量测定的方法。
[1]刘晋华,蔡大伟,屈梅,等 .复方麻仁丸质量标准的研究 [J].中国药师,2004,7(10):778-780.
[2]邢国秀,李楠,杨美燕,等 .天然苦杏仁昔的研究进展 [J].中成药,2003,25(12):1007-l009.
[3]胡南,许惠玉,陈志伟,等 .芍药苷的药理学研究进展 [J].齐齐哈尔医学院学报,2007,28(9):1093-1095.
[4]夏其乐,王涛,陆胜民,等 .苦杏仁苷的分析、提取纯化及药理作用研究进展 [J].食品科学,2013,7(16):1-9.
[5]李坤平,李康,孔繁晟,等 .正交设计研究白芍总苷的超声提取工艺 [J].食物与生物技术学报,2009,28(4):201-504.
[6]闫正国,杨垒.HPLC测定十味扶正胶囊中芍药苷的含量 [J].中国现代医药,2007,9(5):24-26.
[7]左力.HPLC法测定补脾益肠丸中苦杏仁苷含量 [J].辽宁中医药大学学报,2013,15(7):78-79.
