下肢动脉粥样硬化磁共振管壁成像技术与应用进展
2014-03-10朱珠,李澄,赵锡海
下肢动脉粥样硬化磁共振管壁成像技术与应用进展
朱 珠1(综述) 李 澄1赵锡海2(审校)
下肢动脉粥样硬化是发病率和致残率均较高的疾病之一,是仅次于冠心病及脑卒中的第三大粥样硬化性血管性疾病事件。Fowkes等[1]统计,在2000~2010年,下肢动脉粥样硬化的患病人数增加了将近1/4,目前全球范围内下肢动脉粥样硬化患者已超过2亿人,并且随着人口老龄化进程的加快,患病人数将会持续增加。下肢动脉粥样硬化的流行趋势并不只限于发达国家,在低收入及中等收入国家的发病率要高于发达国家。此外,下肢动脉粥样硬化的发病率在男女性之间并无显著差异[1]。
下肢动脉粥样硬化是系统性粥样硬化疾病的局部表现,其发病常受遗传、饮食、生活习惯及外界环境等多种因素的影响。吸烟、糖尿病、高血压及高胆固醇血症是下肢动脉粥样硬化的主要危险因素,其中以糖尿病和吸烟的危险性最大[2,3]。10%~20%的下肢动脉粥样硬化患者会出现典型的间歇性跛行,而50%以上的患者仅表现为不典型的腿部症状[4],严重者会因缺血性肢体截肢而致残。下肢动脉粥样硬化不但会直接影响下肢组织的功能状态,而且是冠心病和脑卒中的有效预测指标[5,6]。
目前,临床上主要采用踝-肱指数(ankle-brachial index,ABI)或多种测量管腔狭窄程度的影像学手段来评价下肢动脉粥样硬化病变的严重程度。然而在粥样硬化病变发生及发展过程中,动脉血管存在正性重构效应,因此单纯测量管腔狭窄常会低估粥样硬化病变的严重程度。ABI的正常值范围为1.0~1.4,ABI<0.9则提示存在下肢动脉粥样硬化[7]。然而,ABI在评价下肢动脉粥样硬化严重程度方面的准确性和可靠性尚有一定的争议。目前临床常采用X线血管造影、超声、CT血管成像或MR血管成像等影像学手段测量下肢动脉管腔狭窄程度,并以此来评价下肢动脉粥样硬化的严重性。尽管CT血管成像和超声能够显示动脉管壁,但在准确识别易损斑块特征方面能力有限[8,9]。
大量MRI与组织病理学对照研究证实,高分辨率MR管壁成像能够准确地识别和定量分析颈动脉易损斑块的特征[10,11]。近年来,有学者应用该技术研究下肢动脉粥样硬化患者下肢动脉粥样硬化斑块的特征,本文将从下肢动脉斑块的组织学特征、MR管壁成像技术及其应用的现状和最新进展进行综述。
1 下肢动脉粥样硬化斑块的组织病理学特征
尽管动脉粥样硬化是一个系统性疾病,但由于全身各个血管床的结构形态及血流动力学特征存在一定的差异,因此,粥样硬化斑块的组织病理学特征在各个血管床的表现可能有所不同。Gisbertz等[12]研究发现,在224例下肢动脉粥样硬化患者的内膜剥脱术后斑块标本中,脂质核(占总斑块面积>10%)、斑块内出血或血栓、中等程度或严重钙化的发生率分别为28.6%、71.9%、68.3%。与此相似,Derksen等[13]对276例下肢动脉粥样硬化患者的下肢动脉斑块标本进行组织病理学研究,结果发现斑块内出血或血栓的发生率为63%。
2 下肢动脉管壁MR成像技术进展
MR动脉管壁成像的核心是血流抑制(黑血)技术。由于复杂的血流状况以及管腔管壁对比度不足,传统的亮血成像容易错误估计粥样硬化斑块的负荷。MR黑血技术是通过有效地抑制血流信号来提高管腔与动脉管壁的信号对比,这对于准确划分管腔与管壁的边界十分关键,更有利于粥样硬化斑块形态与成分的评估。应用于下肢动脉管壁成像的MR技术及其特点总结见表1。
MR黑血技术最早应用于颈动脉管壁成像,其中应用最广泛的是流入抑制技术(infow suppression,IS)[14,15]和双反转恢复技术(double inversion recovery,DIR)[16,17]。IS的技术特点为通过预先饱和成像层面外的血液,当被饱和的血液流入成像层面时进行成像,从而达到血流抑制的效果。DIR技术是通过非选择反转脉冲和层选反转脉冲将成像层面外的血液信号翻转,而保持成像层面内组织的信号不受影响,在合适的反转时间后(即流入成像层面的血液信号恢复到零点)进行图像采集,从而达到抑制血流信号的效果。然而,DIR技术血流抑制的效果受到血液T1值变化的影响,导致在造影增强黑血成像时血流抑制效果变差。基于这一问题,Yarnykh等[18]于2002年提出了四反转恢复技术(quadruple inversion recovery,QIR),该技术通过交错激发的4个层选与非层选反转脉冲保证了血液T1值大范围变动时的血流抑制效果,使造影增强前后都能获得高质量的黑血管壁图像。此外,由于DIR是单层二维血流抑制方法,在进行多层黑血管壁成像时扫描效率较低。为提高DIR的成像效率,Yarnykh等[19]于2003年提出了多层双反转恢复技术(multislice DIR,MDIR)。MDIR的技术特点为通过优化层块选择性反转脉冲与层面选择性反转脉冲,使DIR血流抑制技术和多层成像技术相融合,大大提高了多层黑血管壁成像的效率,在加速8倍的情况下仍能保证满意的图像质量。

表1 应用于下肢动脉管壁成像的MR技术及其特点
上述血流抑制技术均应用于二维成像序列,并采用多对比度成像方式(T1WI、T2WI、PWD、TOF)对粥样硬化斑块成分特征进行定性定量分析(图1)。然而由于二维MRI具有扫描时间长(多对比度成像>30 min)、覆盖范围小(颈动脉分叉为中心上下32 mm)、层面间分辨率低(2 mm)等缺点,临床难以推广应用。近年来三维MRI以其成像速度快、扫描范围大、空间分辨率高等优势,在动脉管壁成像方面受到了广泛关注。
在进行三维管壁成像时,由于传统的血流抑制技术受血流速度影响大,导致血流抑制范围有限,尤其对慢血流、湍流等复杂血流状况抑制效果不佳,因此并不能满足大范围三维成像的需求。以流动敏感扩散梯度准备脉冲为基础,Koktzoglou等[20]提出了驱动平衡傅里叶变换(driven equilibrium Fourier transform,DEFT)扩散梯度准备序列,并应用于胸主动脉和颈动脉三维黑血成像。Wang等[21]于2007年在分析了DEFT扩散梯度准备序列血流抑制原理之后,建议将其命名为MSDE(motion-sensitized driven-equilibrium)。MSDE通过施加非选择性的翻转角度为90°-180°-90°的射频脉冲以及对称分布在180°两侧的梯度,以实现最大化一阶梯度矩同时保证零阶梯度矩为0,使运动的血流相位散相,从而达到血流信号抑制的效果,而此时静态组织相位能够回聚从而信号得到保留。但MSDE容易受到涡电流以及B1场不均匀性的影响。为此,Wang等[22]于2010年提出了iMSDE(improved MSDE)方法来部分解决上述原因引起的血流抑制不佳等问题。Balu等[23]于2011年提出了基于iMSDE准备脉冲的成像序列3D-MERGE,并将其应用于颈动脉管壁成像,实现了快速三维各向同性黑血管壁成像,覆盖范围:60 mm;分辨率:0.7 mm×0.7 mm×0.7 mm;扫描时间:2 min。随后,Chiu等[24]将3D-MERGE序列用于下肢动脉黑血管壁成像(图2),通过移床式、多层块成像,在7 min之内获得了高质量的动脉管壁图像,其纵向覆盖范围约50 cm(自股总动脉至腘动脉),空间分辨率达1 mm×1 mm ×1 mm(各向同性)。
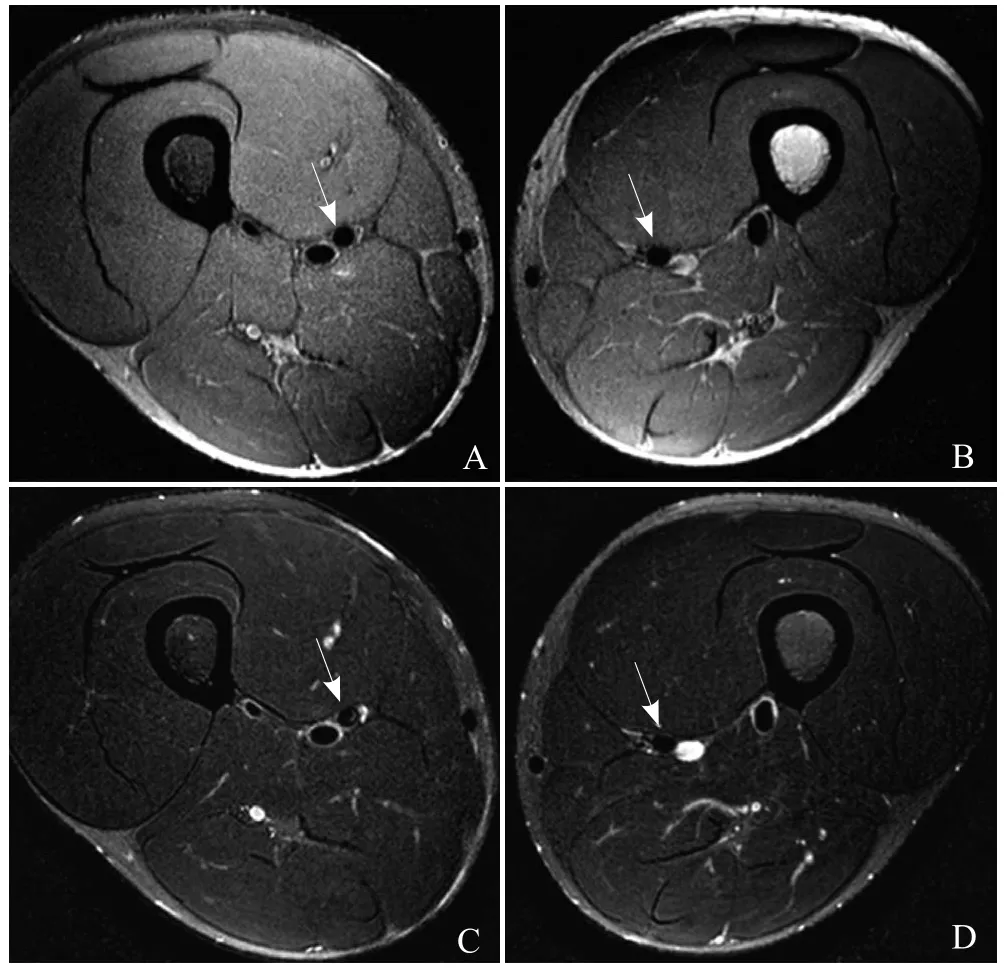
图1 健康受试者的股动脉二维MRI多对比度横轴位成像。扫描参数:T1WI(A、B):TSE QIR,TR 800 ms,TE 10 ms,视野350 mm ×139 mm,层面内分辨率为0.6 mm,层厚3 mm;T2WI(C、D):TSE MDIR,TR 2500 ms,TE 50 ms,视野350 mm×139 mm,层面内分辨率为0.6 mm,层厚3 mm。双侧股动脉收肌管段管壁显示清晰(箭)
近来有学者将SPACE序列应用于下肢动脉管壁成像[25,26]。该序列最早由Mugler等[27]于2000年提出,并主要应用于大脑成像。SPACE序列的技术特点为:①使用变角度汇聚脉冲能够降低射频能量吸收率,并且克服了传统TSE序列回波链不能太长的问题;②频率编码梯度的一阶梯度矩不为0,可以进行血流抑制。Zhang等[25]于2009年将SPACE序列运用于下肢动脉管壁成像,在11 min内获得了从股动脉分叉至股浅动脉(38 cm)、各向同性高分辨率(0.72 mm×0.72 mm×0.72 mm)的动脉管壁图像,与传统2D-TSE成像相比,其成像效率明显提高。SPACE是在西门子磁共振平台上开发的成像序列,该序列在飞利浦磁共振平台的名称为VISTA(图3)。

图2 健康受试者的双侧股动脉3D-MERGE大范围成像(曲面重组),管腔血流抑制充分,动脉管壁显示清晰。成像参数为:TR 9.1 ms,TE 4.2 ms,视野250 mm×400 mm×60 mm,空间分辨率为0.8 mm×0.8 mm×0.8 mm,扫描层块(slab)数为2

图3 健康受试者的双侧股动脉3D T2W VISTA大范围成像(曲面重组),动脉管壁显示清晰。成像参数:TR 1600 ms,TE 151 ms,视野380 mm×344 mm×65 mm,空间分辨率为1.0 mm×1.0 mm×1.0mm,扫描层块(slab)数为1
Xie等[28]于2010年以相位敏感反转恢复(phase-sensitive inversion-recovery,PSIR)技术为基础提出了T2-PSIR序列,并将其应用于下肢三维黑血管壁成像。PSIR技术最先应用于心肌延迟强化成像,因该技术不受反转时间的影响,从而最大程度实现了正常及梗死心肌的信号对比。在T2-PSIR序列中,研究者通过采集额外的参考数据进行背景相位估计和相位敏感重建,使流动的血液呈现负信号,并通过T2准备脉冲进一步提高血液和周围组织的信号对比。Wang等[29]提出了以PSIR为血流抑制技术基础的成像序列SNAP(simultaneous noncontrast angiography and intraplaque hemorrhage imaging),用以同时进行非增强血管成像和黑血管壁成像,并将其应用于颈动脉易损斑块的评价。该技术在下肢动脉管壁成像方面可能具有一定的应用前景。
3 下肢动脉管壁MR成像的应用进展
3.1 评价下肢动脉斑块成分及其形态学特征 对于MR管壁成像应用研究,多数集中在下肢动脉粥样硬化斑块的负荷、成分、偏心性、重构效应及其与临床危险因素的相关性方面。MR管壁成像与组织病理学对照研究发现,在判断下肢动脉斑块基于成分特征建立的美国心脏协会分型方面,MR管壁成像与病理学具有高度的一致性[30,31]。
粥样硬化斑块的偏心性分布特征与心脑血管事件密切相关。Ohara等[32]研究引起严重狭窄(狭窄程度>70%)的颈动脉斑块的偏心性特征与临床症状的相关性,结果发现颈动脉偏心性斑块的患者发生同侧缺血性脑血管症状的风险明显高于向心性斑块。Ambrose等[33]的回顾性研究发现偏心性斑块较向心性斑块的患者更易发生不稳定型心绞痛。Li等[34]在下肢动脉血管床应用MR管壁成像观察偏心性斑块与斑块成分及形态的相关性,结果发现:①在所有存在粥样硬化斑块的血管层面中,有63.9%的层面表现为偏心性斑块;②偏心性斑块有相对大的斑块负荷、更多的脂质成分及钙化;③斑块偏心性与管壁面积呈明显的相关性,在既定的管腔面积下,斑块偏心指数增加0.1,管壁面积增加9.3%。
下肢动脉斑块负荷与年龄、糖尿病等心脑血管危险因素及下肢功能状态关系密切。Bianda等[35]将MR管壁成像用于研究颈动脉及下肢动脉斑块的自然进程,通过2年的随访观察,结果发现颈动脉及下肢动脉斑块负荷随着年龄的增长均有增加,但在颈动脉管壁趋向负性重构,而在下肢动脉更多表现为正性重构。此外,Bourque等[36]应用MR管壁成像研究糖尿病合并冠心病对下肢动脉病变的影响,结果发现糖尿病合并冠心病患者的下肢动脉斑块负荷明显高于非糖尿病患者(平均管壁厚度1.28 mm对1.16 mm,P<0.01)。McDermott等[37]研究下肢动脉粥样硬化患者斑块负荷、管腔大小与下肢功能的关系,发现斑块负荷增加、管腔变小的患者其6 min步行试验到达距离缩短,正常及最快步行速度明显减慢。
3.2 评价下肢动脉粥样硬化再血管化治疗效果 目前,血管成形术及支架植入是治疗下肢动脉狭窄最常用的方法。经皮腔内血管成形术(percutaneous transluminal angioplasty,PTA)容易出现术后再狭窄,而PTA治疗对血管壁的影响及血管内放射疗法对抗再狭窄的机制尚不清楚。Wyttenbach等[38]将MR管壁成像用于评价PTA手术对下肢动脉管壁结构的影响,发现手术后斑块局部会发生累及范围较深的破裂,并且血管壁出现广泛的重构现象,PTA术后管腔面积的减少部分是由负性重构效应所致;此外,该学者证实在PTA术后应用血管内放射疗法可以阻止或延缓负性重构的进程,但放射治疗也会同时阻止破裂血管表面的愈合,不利于稳定破裂斑块[38,39]。目前血管内支架的主要材料是镍钛合金,与不锈钢材质相比,其兼容性更好。Adams等[40]应用MR管壁成像技术评价目前15种常用的下肢动脉支架的MR兼容性以及支架术后动脉管腔、管壁的变化情况,结果发现不锈钢材质的支架伪影较重,管腔及管壁显示模糊并会发生明显变形,而MR可以满意地显示镍钛合金支架局部的动脉管腔和管壁结构,可以用于监测支架植入术后支架内再狭窄。
3.3 监测下肢动脉粥样硬化药物治疗效果 组织病理学研究证实,他汀类药物可以降低颈动脉及股动脉斑块内出血的发生率[13]。他汀类药物及依泽替米贝均可以降低低密度脂蛋白胆固醇,但依泽替米贝对动脉粥样硬化的作用仍然存在争议。West等[41]在一项随机双盲药物试验中,应用MR斑块成像测量67例下肢动脉粥样硬化患者下肢动脉粥样硬化斑块体积在服用降脂药前后2年内的变化情况,结果发现,单独服用他汀类药物或同时服用他汀类药物和依泽替米贝均可以阻止下肢动脉斑块的进展。然而当患者服用他汀类药物一段时间后加服依泽替米贝,下肢动脉粥样硬化斑块仍然在进展,尽管低密度脂蛋白胆固醇的水平进一步降低,因此,依泽替米贝对下肢动脉粥样硬化斑块的作用可能依赖于他汀类药物服用的时间。
4 总结
下肢动脉粥样硬化的发病率和致残率较高,不仅对下肢功能造成影响,而且是心血管疾病及脑卒中的有效预测因子。多数学者应用二维MR管壁成像技术评价下肢动脉粥样硬化斑块的成分及形态、药物疗效和再血管化治疗效果等。由于下肢动脉的解剖学特点为走形距离较长、管径较小,因此应用二维MR管壁成像技术评价下肢动脉粥样硬化存在明显的局限性。随着MR成像技术的迅猛发展,三维图像采集模式日趋成熟,近来已有学者将其用于下肢动脉管壁成像。与二维成像相比,三维MR管壁成像具有成像速度快、纵向覆盖范围大、分辨率高等特点,在下肢动脉粥样硬化成像方面具有一定的应用前景。由于动脉管壁MR成像的核心是血流抑制技术,因此研究开发适合于三维MR管壁成像的血流抑制技术是下肢动脉粥样硬化管壁成像技术的研究方向之一。此外,由于近来针对下肢动脉管壁成像的研究主要集中在斑块负荷的定量分析方面,因此有必要进一步研究下肢动脉粥样硬化患者的粥样硬化斑块成分特征(尤其是易损斑块)及其对临床治疗的指导意义。
[1] Fowkes FG, Rudan D, Rudan I, et al. Comparison of global estimates of prevalence and risk factors for peripheral artery disease in 2000 and 2010: a systematic review and analysis. Lancet, 2013, 382(991): 1329-1340.
[2] Writing Group Members, Lloyd-Jones D, Adams RJ, et al. Heart disease and stroke statistics--2010 update: a report from the American Heart Association. Circulation, 2010, 121(7): e46-e215.
[3] Hirsch AT, Duval S. The global pandemic of peripheral artery disease. Lancet, 2013, 382(991): 1312-1314.
[4] Hirsch AT, Criqui MH, Treat-Jacobson D, et al. Peripheral arterial disease detection, awareness, and treatment in primary care. JAMA, 2001, 286(11): 1317-1324.
[5] Satiroglu O, Kocaman SA, Karadag Z, et al. Relationship of the angiographic extent of peripheral arterial disease with coronary artery involvement. J Pak Med Assoc, 2012, 62(7): 644-649.
[6] Marsico F, Ruggiero D, Parente A, et al. Prevalence and severity of asymptomatic coronary and carotid artery disease in patients with lower limbs arterial disease. Atherosclerosis, 2013, 228(2): 386-389.
[7] Lin JS, Olson CM, Johnson ES, et al. The ankle-brachial index for peripheral artery disease screening and cardiovascular disease prediction among asymptomatic adults: a systematic evidence review for the U.S. Preventive Services Task Force. Ann Intern Med, 2013, 159(5): 333-341.
[8] Hausleiter J, Meyer T, Hadamitzky M, et al. Prevalence of noncalcifed coronary plaques by 64-slice computed tomography in patients with an intermediate risk for signifcant coronary artery disease. J Am Coll Cardiol, 2006, 48(2): 312-318.
[9] Fosse E, Johnsen SH, Stensland-Bugge E, et al. Repeated visual and computer-assisted carotid plaque characterization in a longitudinal population-based ultrasound study: the Tromsø study. Ultrasound Med Biol, 2006, 32(1): 3-11.
[10] Puppini G, Furlan F, Cirota N, et al. Characterisation of carotid atherosclerotic plaque: comparison between magnetic resonance imaging and histology. Radiol Med, 2006, 111(7): 921-930.
[11] Cai JM, Hatsukami TS, Ferguson MS, et al. In vivo quantitative measurement of intact fbrous cap and lipid-rich necrotic core size in atherosclerotic carotid plaque: comparison of high-resolution, contrast-enhanced magnetic resonance imaging and histology. Circulation, 2005, 112(22): 3437-3444.
[12] Gisbertz SS, Derksen WJ, De Kleijn DP, et al. The effect of alcohol on atherosclerotic plaque composition and cardiovascular events in patients with arterial occlusive disease. J Vasc Surg, 2011, 54(1): 123-131.
[13] Derksen WJ, Peeters W, Tersteeg C, et al. Age and coumarin-type anticoagulation are associated with the occurrence of intraplaque hemorrhage, while statins are associated less with intraplaquehemorrhage: a large histopathological study in carotid and femoral plaques. Atherosclerosis, 2011, 214(1): 139-143.
[14] Edelman RR, Mattle HP, Wallner B, et al. Extracranial carotid arteries: evaluation with "black blood" MR angiography. Radiology, 1990, 177(1): 45-50.
[15] Steinman DA, Rutt BK. On the nature and reduction of plaquemimicking flow artifacts in black blood MRI of the carotid bifurcation. Magn Reson Med, 1998, 39(4): 635-641.
[16] Edelman RR, Chien D, Kim D. Fast selective black blood MR imaging. Radiology, 1991, 181(3): 655-660.
[17] Simonetti OP, Finn JP, White RD, et al. "black blood" T2-weighted inversion-recovery MR imaging of the heart. Radiology, 1996, 199(1): 49-57.
[18] Yarnykh VL, Yuan Chun. T1-insensitive flow suppression using quadruple inversion-recovery. Magn Reson Med, 2002, 48(5): 899-905. [19] Yarnykh VL, Yuan Chun. Multislice double inversion-recovery black-blood imaging with simultaneous slice reinversion. J Magn Reson Imaging, 2003, 17(4): 478-483.
[20] Koktzoglou I, Li DB. Diffusion-prepared segmented steady-state free precession: application to 3D black-blood cardiovascular magnetic resonance of the thoracic aorta and carotid artery walls. J Cardiovasc Magn Reson, 2007, 9(1): 33-42.
[21] Wang JN, Yarnykh VL, Hatsukami T, et al. Improved suppression of plaque-mimicking artifacts in black-blood carotid atherosclerosis imaging using a multislice motion-sensitized driven-equilibrium (MSDE) turbo spin-echo (TSE) sequence. Magn Reson Med, 2007, 58(5): 973-981.
[22] Wang JN, Yarnykh VL, Yuan C. Enhanced image quality in black-blood MRI using the improved motion-sensitized drivenequilibrium (iMSDE) sequence. J Magn Reson Imaging, 2010, 31(5): 1256-1263.
[23] Balu N, Yarnykh VL, Chu BC, et al. Carotid plaque assessment using fast 3D isotropic resolution black-blood MRI. Magn Reson Med, 2011, 65(3): 627-637.
[24] Chiu B, Sun J, Zhao XH, et al. Fast plaque burden assessment of the femoral artery using 3D black-blood MRI and automated segmentation. Med Phys, 2011, 38(10): 5370-5384.
[25] Zhang ZL, Fan ZY, Carroll TJ, et al. Three-dimensional T2-weighted MRI of the human femoral arterial vessel wall at 3.0 Tesla. Invest Radiol, 2009, 44(9): 619-626.
[26] Mihai G, Chung YC, Merchant A, et al. T1-weighted-SPACE dark blood whole body magnetic resonance angiography (DB-WBMRA): initial experience. J Magn Reson Imaging, 2010, 31(2): 502-509.
[27] Mugler JP, Bao S, Mulkern RV, et al. Optimized single-slab threedimensional spin-echo MR imaging of the brain. Radiology, 2000, 216(3): 891-899.
[28] Xie JS, BM, Fan ZY, et al. 3D fow-independent peripheral vessel wall imaging using T(2)-prepared phase-sensitive inversionrecovery steady-state free precession. J Magn Reson Imaging, 2010, 32(2): 399-408.
[29] Wang JN, Börnert P, Zhao HL, et al. Simultaneous noncontrast angiography and intraplaque hemorrhage (SNAP) imaging for carotid atherosclerotic disease evaluation. Magn Reson Med, 2013, 69(2): 337-345.
[30] Gao TL, He XF, Yu W, et al. Atherosclerotic plaque pathohistology and classification with high-resolution MRI. Neurol Res, 2011, 33(3): 325-330.
[31] Koops A, Ittrich H, Petri S, et al. Multicontrast-weighted magnetic resonance imaging of atherosclerotic plaques at 3.0 and 1.5 Tesla: ex-vivo comparison with histopathologic correlation. Eur Radiol, 2007, 17(1): 279-286.
[32] Ohara T, Toyoda K, Otsubo R, et al. Eccentric stenosis of the carotid artery associated with ipsilateral cerebrovascular events. Am J Neuroradiol, 2008, 29(6): 1200-1203.
[33] Ambrose JA, Winters SL, Stern A, et al. Angiographic morphology and the pathogenesis of unstable angina pectoris. J Am Coll Cardiol, 1985, 5(3): 609-616.
[34] Li F, Mcdermott MM, Li D, et al. The association of lesion eccentricity with plaque morphology and components in the superfcial femoral artery: a high-spatial-resolution, multi-contrast weighted CMR study. J Cardiovasc Magn Reson, 2010, 12: 37.
[35] Bianda N, Di Valentino M, Périat D, et al. Progression of human carotid and femoral atherosclerosis: a prospective follow-up study by magnetic resonance vessel wall imaging. Eur Heart J, 2012, 33(2): 230-237.
[36] Bourque JM, Schietinger BJ, Kennedy JL, et al. Usefulness of cardiovascular magnetic resonance imaging of the superficial femoral artery for screening patients with diabetes mellitus for atherosclerosis. Am J Cardiol, 2012, 110(1): 50-56.
[37] McDermott MM, Liu K, Carroll TJ, et al. Superfcial femoral artery plaque and functional performance in peripheral arterial disease: walking and leg circulation study (WALCS III). JACC Cardiovasc Imaging, 2011, 4(7): 730-739.
[38] Wyttenbach R, Gallino A, Alerci M, et al. Effects of percutaneous transluminal angioplasty and endovascular brachytherapy on vascular remodeling of human femoropopliteal artery by noninvasive magnetic resonance imaging. Circulation, 2004, 110(9): 1156-1161.
[39] Wyttenbach R, Corti R, Alerci M, et al. Effects of percutaneous transluminal angioplasty and endovascular brachytherapy on vascular remodeling of human femoropopliteal artery: 2 years follow-up by noninvasive magnetic resonance imaging. Eur J Vasc Endovasc Surg, 2007, 34(4): 416-423.
[40] Adams GJ, Baltazar U, Karmonik C, et al. Comparison of 15 different stents in superfcial femoral arteries by high resolution MRI ex vivo and in vivo. J Magn Reson Imaging, 2005, 22(1): 125-135.
[41] West AM, Anderson JD, Meyer CH, et al. The effect of ezetimibe on peripheral arterial atherosclerosis depends upon statin use at baseline. Atherosclerosis, 2011, 218(1): 156-162.
动脉粥样硬化;股动脉;磁共振成像;综述
2014-03-11 【修回日期】2014-09-25
(本文编辑 张春辉)
R543.5
1.江苏省扬州市第一人民医院 江苏扬州 225001;2.清华大学生物医学影像研究中心 北京 100084
李 澄 E-mail: yzlicheng@vip.sina.com
10.3969/j.issn.1005-5185.2014.12.021
