浅谈“铁三角”在中学化学解题中的应用
2014-03-09文炜明
文炜明
(甘肃省平凉师范学校,甘肃 平凉 744000)
浅谈“铁三角”在中学化学解题中的应用
文炜明
(甘肃省平凉师范学校,甘肃 平凉 744000)
根据铁在元素周期表中的位置和原子结构,铁有可变的化合价,能形成+2和+3两种正化合价,这样Fe、Fe3+、Fe2+三者之间就形成了一个三角关系,简称“铁三角”。本文就“铁三角”涉及的主要题型及解题思路做一列举阐释。
铁三角;化学解题;中学;应用
铁是中学化学教材中唯一被系统介绍的过渡金属元素,根据铁在元素周期表中的位置和原子结构,铁有可变的化合价,能形成+2和+3两种正化合价,这样Fe、Fe3+、Fe2+三者之间就形成了一个三角关系,简称“铁三角”。根据考纲要求“以Fe(Ⅱ)、Fe(Ⅲ)的相互转化为例,理解变价金属元素的氧化还原性”,如何正确判断铁与哪些物质反应能生成+2价化合物,跟哪些物质反应能生成+3价铁的化合物,以及Fe2+和Fe3+通过哪些物质可以相互转化则是这一部分内容的重点。本文就“铁三角”涉及的主要题型及解题思路做一列举阐释。
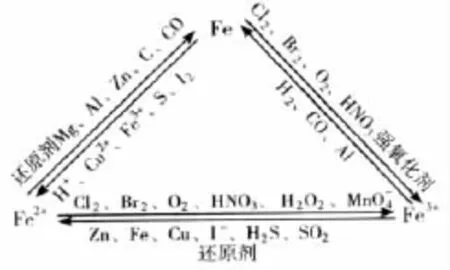
一、离子共存
由于Fe2+处在中间价态,化合价既可以升高,也可以降低,因此Fe2+具有氧化性,主要表现还原性,与等强氧化性物质不能共存;Fe3+具有较强的氧化性,与等还原性离子不能共存,同时Fe3+是典型的弱碱阳离子,与等离子在溶液中发生双水解相互促进反应不能共存与SCN-发生络合反应不能共存。
例2、在FeCl3和CuCl2的混合液中,加入一定量的Fe粉。(1)当完全反应后,溶液中一定有的阳离子是什么?(2)如果反应后有固体剩余,则溶液中一定无什么?一定有什么?(3)如果反应后剩余的固体只有Cu,则溶液一定无什么?一定有什么?可能有什么?(4)如果反应后剩余的固体为Fe和Cu,则溶液中一定无什么?一定有什么?
解析:主要反应方程式:2FeCl3+Fe====3FeCl2;2FeCl3+Cu==== 2FeCl2+CuCl2;Fe+CuCl2=FeCl2+Cu,因此,当有固体剩余,固体首先是Cu,则溶液中一定没有Fe3+,一定有Fe2+。如果固体全部是Cu,则溶液中还可能有Cu2+,如果固体还有Fe,则一定没有Cu2+。
答案:(1)Fe2+(2)Fe3+,Fe2+(3)Fe3+,Fe3+,Cu2+(4)Fe3+和Cu2+,Fe2+
二、Fe2+与Fe3+的鉴别
(1)直接观察颜色:Fe2+的溶液呈浅绿色,Fe3+的溶液呈棕黄色。
(2)利用显色反应:应用KSCN溶液,溶液呈血红色的是Fe3+,否则为Fe2+。
(3)利用铁化合物沉淀的颜色:加入OH-溶液,产生红褐色沉淀的是Fe3+,产生白色沉淀迅速变为灰绿色,最后变为红褐色的是Fe2+。
例3.某同学设计下列方法对A盐的水溶液进行鉴定:

由此得出的以下结论中,不正确的是( )
A.D溶液中存在Fe(SCN)3B.滤液中有Fe3+
C.B为AgBr浅黄色沉淀 D.A一定为无氧酸盐FeBr2
解析:根据B、D现象可确定A是由Fe3+和Br-或由Fe2+和Br-组成的盐。
答案:D
三、计算和推断
铁元素在不同条件下表现出不同的化合价,因此围绕可变化合价设置的推断题及铁其它物质反应生成Fe2+还是Fe3+的化合物是这一部分的常见题型。
例4.(2005全国高考理综Ⅲ,26)A、B两种固体,都由甲、乙两种元素组成。在A、B中,甲、乙两种元素的原子个数比分别为1:1和1:2。高温煅烧A、B时,产物都是C(固体)和D(气体),由D可制得E(酸)。E和另一种酸组成的混合酸跟甲苯反应可生成三硝基甲苯。C与E的稀溶液反应得到溶液F,往F溶液中加入氢氧化钠溶液,有红褐色沉淀生成,该沉淀经灼烧后转变成C。往F溶液中加入甲元素的单质得到溶液G。试根据以上信息填写下列空白:
(1)A的化学式(分子式)是什么?
(2)B煅烧生成C和D的化学方程式是什么?甲元素的单质与F溶液反应的离子方程式是什么?
(3)往G溶液中加入NaOH溶液发生的现象是什么?
解析:此题为综合性较强的推断题,我们可从向F溶液中加入NaOH溶液有红褐色沉淀生成推出F溶液中有Fe3+,又知该沉淀灼烧后转变为C,则C为Fe2O3;E和另一种酸组成的混合物跟甲苯反应可生成三硝基甲苯,则知E为H2SO4或HNO3,再根据前面A、B都是由甲、乙两种元素组成的,且甲、乙两种元素的原子个数比为1:1和1:2,知E为H2SO4,A为FeS,B为FeS2;向F溶液中加入甲元素单质得溶液G,则G为FeSO4。由此题目便可迎刃而解。
答案:
(1)FeS
(2)4FeS2+11O2高温2Fe2O3+8SO2;2Fe3++Fe====3Fe2+
(3)生成的沉淀由白色变为灰绿色最终变为红褐色。
G63
A
1005-5312(2014)17-0237-01
