贝伐珠单抗联合化疗二线及以上治疗晚期非鳞型非小细胞肺癌的临床观察
2014-03-09胡庆庆史美祺于韶荣王丽夏国豪郭仁宏王友群
胡庆庆,史美祺,于韶荣,王丽,夏国豪,郭仁宏,王友群**
(1. 中国药科大学临床药学研究室,江苏 南京210009;2. 江苏省肿瘤医院肿瘤内科,江苏 南京 210009)
·临床药学· CLINICAL PHARMACY
贝伐珠单抗联合化疗二线及以上治疗晚期非鳞型非小细胞肺癌的临床观察
胡庆庆1,史美祺2*,于韶荣2,王丽2,夏国豪2,郭仁宏2,王友群1**
(1. 中国药科大学临床药学研究室,江苏 南京210009;2. 江苏省肿瘤医院肿瘤内科,江苏 南京 210009)

目的:考察贝伐珠单抗联合化疗二线及以上治疗晚期非鳞型非小细胞肺癌的疗效和安全性。方法:28例经病理组织学或细胞学证实的晚期非鳞型非小细胞肺癌患者接受贝伐珠单抗联合化疗的二线及以上治疗,其间,贝伐珠单抗所用剂量为7.5 mg • kg-1,在化疗第1 d静滴给予;化疗方案包括培美曲塞加或不加铂类、白蛋白结合型紫杉醇加或不加铂类及替吉奥以及吉西他滨/紫杉醇/多西紫杉醇加或不加铂类。各治疗方案每3周为1个周期,持续4个周期,然后维持治疗,直至受试者不能耐受或疾病进展。按RECIST 1.1版评价疗效,按NCI-CTC 4.0版评价不良反应。结果:28例受试者中,无完全缓解病例,部分缓解11例(39.3%),稳定16例(57.1%),进展1例(3.6%);客观缓解率为39.3% (11/28),疾病控制率为96.4%(27/28);中位无进展生存期为5个月,中位总生存期为10个月。亚组数据分析可见,贝伐珠单抗联合化疗各方案亚组中,培美曲塞方案受试者的中位无进展生存期为6个月,疗效最好,较其他各方案亚组有统计学差异(P=0.028)。安全性数据分析显示,与贝伐珠单抗相关的主要不良反应有Ⅰ~Ⅲ度高血压以及Ⅰ/Ⅱ度蛋白尿/出血/发热。结论:贝伐珠单抗联合化疗用于二线及以上治疗晚期非鳞型非小细胞肺癌的疗效较单纯化疗有一定改善,且毒副反应可耐受,对经济上可以接受的患者值得推荐使用。
非鳞型非小细胞肺癌;贝伐珠单抗;联合化疗
1 资料与方法
1.1 临床资料
选取江苏省肿瘤医院2011年11月—2014年1月间收治的经病理组织学或细胞学证实为Ⅳ期NSCLC的患者28例,其中男性21例,女性7例,中位年龄58岁(39~71岁)。在接受贝伐珠单抗联合化疗之前,这些病例均未曾使用过贝伐珠单抗;有脑转移8例,但均为曾局部治疗过、且脑转移症状稳定者;有经CT检查证实的可测量病灶,美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~2分[3],预计生存期大于3个月,血常规和心电图正常,肝肾功能小于或等于正常值1.5倍。接受贝伐珠单抗联合化疗之时,这些病例中属二线治疗和三线及以上治疗的各14例。所有受试者在接受贝伐珠单抗联合化疗之前均签署治疗同意书,一般资料见表1。

表1 28例受试者的一般临床资料Table 1 General clinical data of 28 subjects
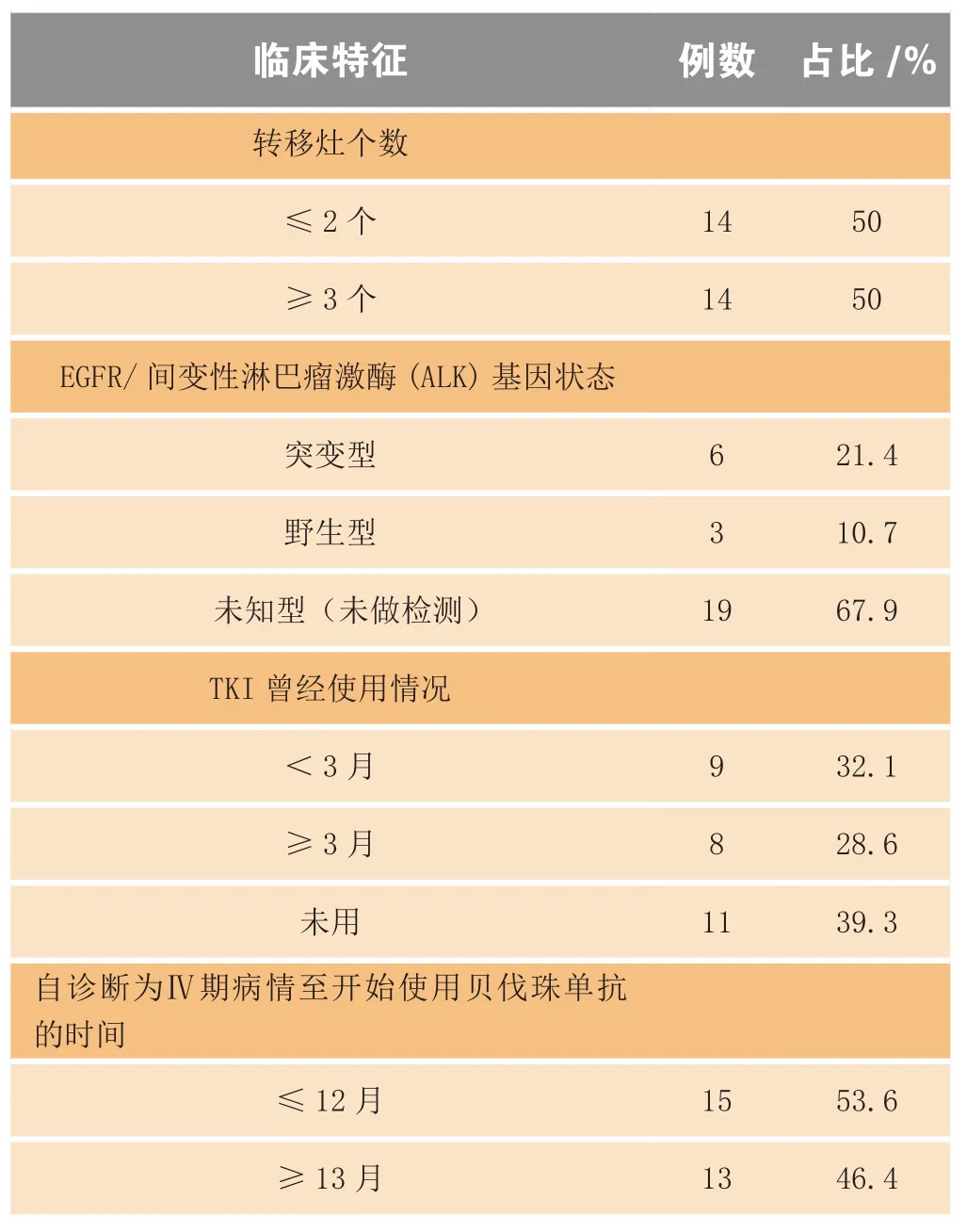
续表1
1.2 治疗方法
贝伐珠单抗给药剂量和方法:7.5 mg·kg-1,静滴, 第1 d,和化疗联合使用。
化疗方案:培美曲塞方案,包括单独培美曲塞、培美曲塞+顺铂和培美曲塞+卡铂;白蛋白结合型紫杉醇方案,包括单独白蛋白紫杉醇、白蛋白紫杉醇+顺铂、白蛋白紫杉醇+卡铂和白蛋白紫杉醇+替吉奥;吉西他滨方案,包括单独吉西他滨和吉西他滨+卡铂;多西他赛方案,包括单独多西他赛和多西他赛+卡铂;紫杉醇方案,即紫杉醇+卡铂。给药剂量和方法:培美曲塞,500 mg·m-2,静滴,第1 d;白蛋白结合型紫杉醇,125 mg·m-2,静滴,第1、8 d;吉西他滨,1 000 mg·m-2,静滴,第1、8 d;多西他赛,60 mg·m-2,静滴,第1 d;紫杉醇,175 mg·m-2,静滴,第1 d;替吉奥,剂量依据体表面积而定,体表面积小于1.25 m2时为80 mg·d-1,1.25~1.5 m2时为100 mg·d-1,大于或等于1.5 m2时为120 mg·d-1,每日剂量均分为2次给药,第1~14 d;顺铂,60 mg·m-2,静滴,第1 d或分成3 d给药;卡铂,AUC 4~5,静滴,第1 d。
以上治疗方案每3周为1个周期,2 个周期后进行一次疗效评估,若有效,继续使用原方案2个周期,然后给予单药化疗加贝伐珠单抗或单用化疗或单用贝伐珠单抗维持治疗,直至受试者不能耐受或疾病进展。
1. 3 评价标准
近期疗效按实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1版评价,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展( PD),以CR+ PR计算客观缓解率(ORR),以CR+ PR+SD计算疾病控制率( DCR);不良反应按美国癌症研究所制定的常见毒性判定标准(NCI-CTC)4.0版评价,分为0~4级;无进展生存期 ( PFS) 是自治疗开始至肿瘤进展或死亡的时间。
1.4 EGFR和ALK基因检测方法
EGFR基因检测采用直接测序和扩增阻滞突变系统(amplification refractory mutation system,ARMS)法,ALK基因检测采用免疫组化(immunohistochemistry, IHC)和荧光原位杂交(fluorescence in situhybridization,FISH)法。
1. 5 统计学分析
应用 SPSS 13. 0 软件对数据进行统计学处理,组间比较采用χ2检验,生存分析用Kaplan-Meier法,以P<0. 05为差异有统计学意义。
2 结果
2.1 近期疗效评价
受试的28例NSCLC患者均可评价疗效,共化疗168个周期,中位周期数为5.5个(1~16个);共使用贝伐珠单抗周期数146个,中位使用贝伐珠单抗周期数 5个(1~16个);其中,PR为11例(39.3%),SD为16例(57.1%),PD为1例(3.6%),ORR为39.3% (11/28),DCR为96.4%(27/28)。各亚组受试者的疗效评价见表2。

表2 亚组疗效分析Table 2 Subgroup analyses of efficacy

续表2
从表2可见,有EGFR/ALK基因突变或TKI使用超过或等于3个月的亚组受试者其ORR均高于其他EGFR/ALK基因未突变或未知突变以及TKI使用少于 3月或未用的亚组受试者,尽管无统计学差异(P=0.827和P=0.114)。
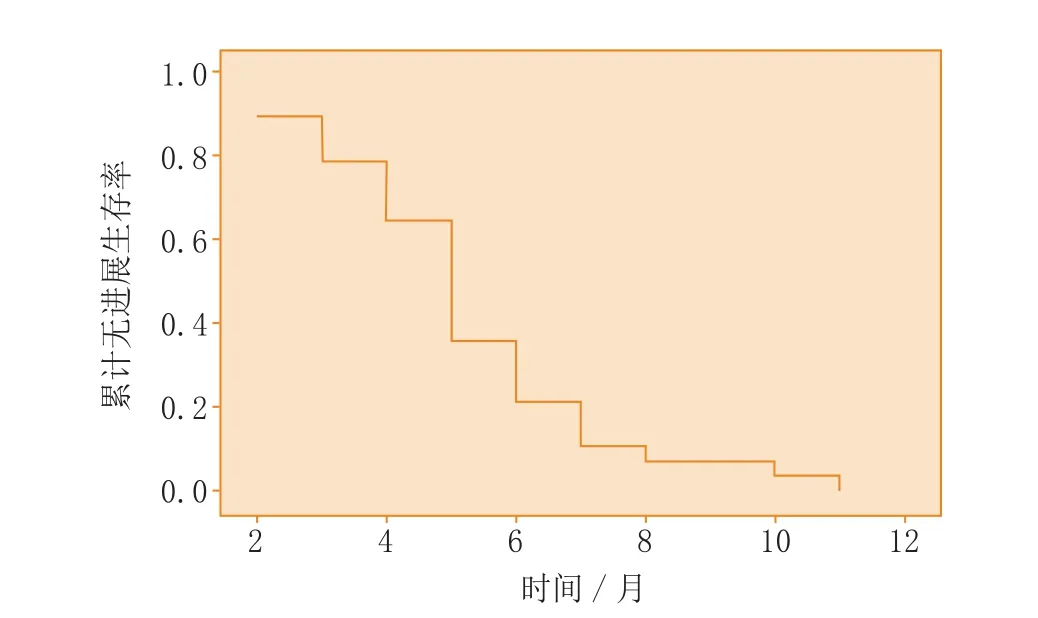
图1 受试者不同时段的累计无进展生存率Figure 1 Cumulative progression-free survivals in the subjects at different time
2.2 生存期评价
从开始治疗时起,即采用门诊、电话方式进行随访,直至2014年5月31日。28例受试者的中位PFS为5个月(2~11月,95% CI:4.379~5.621),中位总生存期(OS)为10个月(7~29月,95% CI:7.93~12.07)(见图1、2)。各亚组受试者的生存期数据见表3。
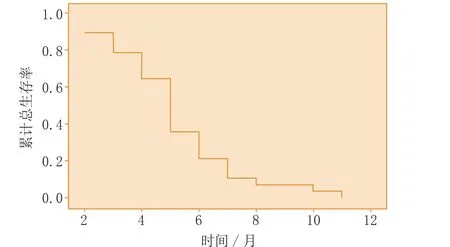
图2 受试者不同时段的累计总生存率Figure 2 Cumulative overall survivals in the subjects at different time
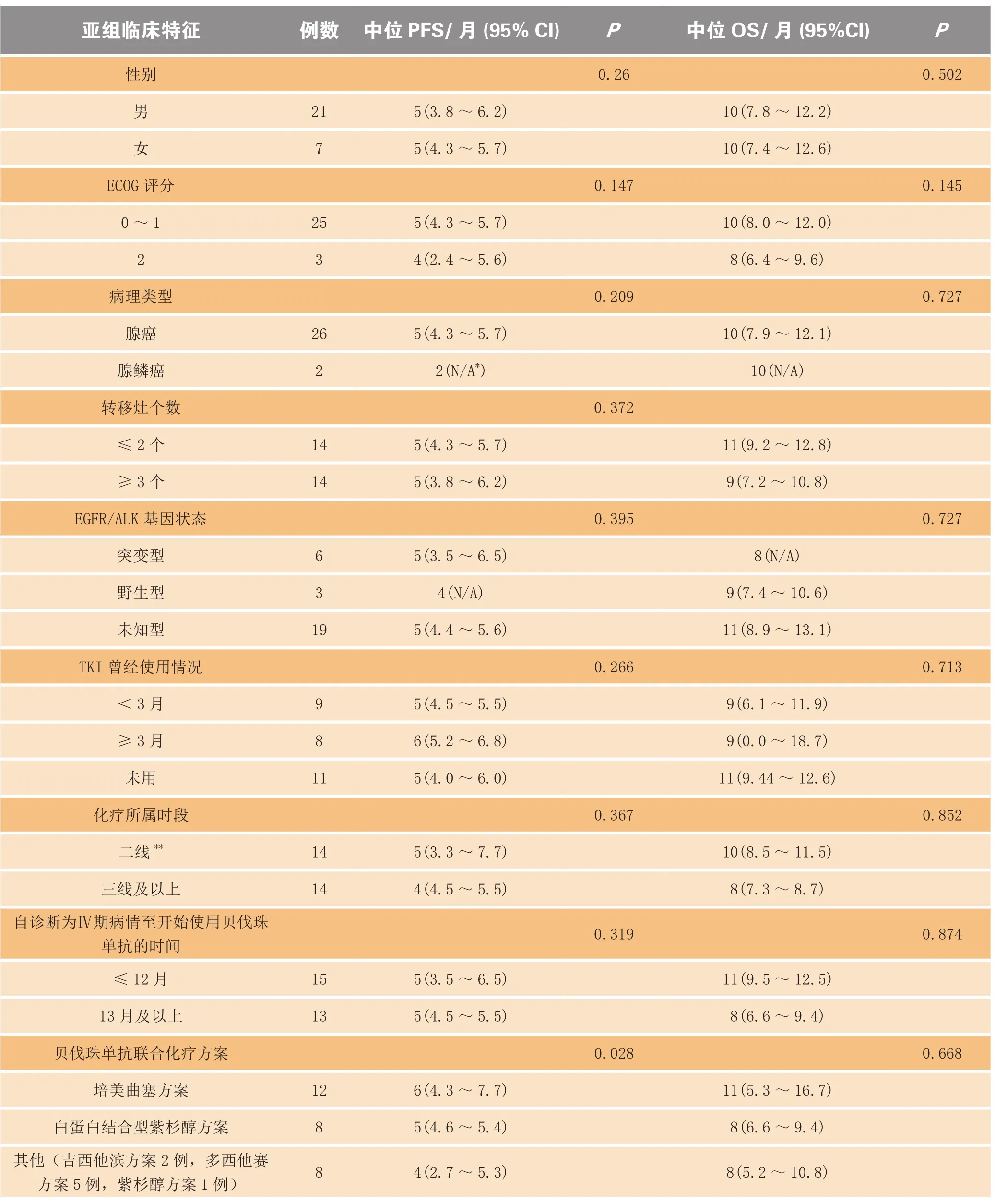
表3 亚组生存期分析Table 3 Subgroup analyses of survival
从表3可见,贝伐珠单抗联合化疗各方案亚组中,培美曲塞方案受试者的中位PFS为6个月,疗效最好,较其他各方案亚组有统计学差异(P=0.028)。究其原因,可能与在二线和/或维持治疗时有更多的受试者接受培美曲塞与贝伐珠单抗联合使用有关。
2.3 安全性评价
贝伐珠单抗联合化疗的主要不良反应为骨髓抑制、消化道反应、神经毒性和脱发,还包括高血压、蛋白尿和出血等。其中,发生率超过10%的与贝伐珠单抗相关的不良反应有:Ⅰ/Ⅱ度高血压(28.6%,8/28), Ⅲ度高血压(7.14%,2/28);Ⅰ/Ⅱ度蛋白尿(10.7%,3/28);Ⅰ/Ⅱ度出血(10.7%,3/28),主要为鼻出血(2例)及咯血(1例);Ⅰ/Ⅱ度发热(10.7%,3/28)(见表4)。

表4 贝伐珠单抗联合化疗的不良反应Table 4 Adverse reactions induced by bevacizumab combined with chemotherapy
3 讨论
贝伐珠单抗是一种重组人源化IgG1抗体,可通过与血管内皮生长因子(vascular endothelial growth factor,VEGF)结合而抑制VEGF与其受体(vascular endothelial growth factor receptor,VEGFR)间的相互作用,从而抑制肿瘤血管的生成,切断肿瘤细胞的营养供应,达到控制肿瘤的目的,其与化疗联用能提高化疗疗效。目前,美国和欧洲均已批准其联合化疗用于晚期非鳞型NSCLC患者的治疗,并且美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)及多个临床指南均推荐此联用疗法为晚期非鳞型NSCLC的一线标准治疗方案,推荐级别为Ⅰ级证据[4-5]。而且到目前为止,针对贝伐珠单抗的各项大型临床研究亦均在一线治疗中进行,其用于二线及以上治疗的研究数据鲜有大样本报道,我国也尚未正式批准其用于晚期NSCLC治疗的适应证。Maki等[6]报道的贝伐珠单抗联合化疗用于二线及以上治疗的小样本试验结果显示,贝伐珠单抗联合紫杉醇/卡铂方案用于以往治疗过的17例晚期NSCLC患者后,所获ORR为17.6%,DCR为70.6%,中位PFS 为4.7月,结论认为,该联用方案用于二线或以上治疗,疗效明确,毒性可耐受。Hiest等[7]在一项小样本Ⅱ期临床试验中,将贝伐珠单抗联合培美曲赛+奥沙利铂用于二线及以上治疗复治进展期NSCLC患者,结果显示,受试者的PR为 27%, SD为44%, PD为29%, 中位PFS为5. 8 个月( 95% CI: 4. 1 ~ 7. 8 个月) , 中位OS为12. 5 个月( 95% CI:7. 3~ 17 个月),毒性反应可以耐受。 Adjei等[8]也报告了另一项Ⅱ期临床研究结果,贝伐珠单抗联合培美曲赛用于二线治疗晚期NSCLC患者后,受试者的中位PFS为4. 0 个月, 中位OS为8. 6 个月,结论认为,贝伐珠单抗联合化疗用于治疗复治晚期NSCLC,是一种有前途的治疗方案,而且对脑转移的病例也是安全的。国内苗茜等[9]则报道了针对晚期NSCLC患者多程化疗后贝伐珠单抗再联合化疗的疗效分析,结果显示,32例受试病例可评价疗效,总体CR有 1例,PR有4例,SD有19例,PD有8例,ORR为15. 6%(5 /32),DCR为75. 0% ( 24 /32),中位PFS为3.9个月;与贝伐珠单抗相关的毒性反应以高血压、蛋白尿和肝功能损害的发生率为较高,且多为Ⅰ/Ⅱ度,Ⅲ/Ⅳ度少见。
本文对28例晚期非鳞型NSCLC患者实施贝伐珠单抗联合化疗,其中属二线和二线以上治疗的患者各占50%,总体ORR以及中位PFS和OS略优于文献报道,这可能与本文中半数受试者属二线治疗,并采用非重度化疗且大多为培美曲塞联合化疗方案有关。以往单纯二线化疗用于NSCLC患者的临床试验结果显示,ORR一般在10%左右,中位PFS不到3个月,OS约8个月[1-2]。而本文及文献数据显示,与单纯化疗相比,化疗联合贝伐珠单抗用于二线治疗NSCLC患者所获疗效均有不同程度的提高,且总体耐受性良好,毒副作用并未明显增加,如本文中受试的8例脑转移患者也未发生脑出血等不良反应。此外,本文的亚组分析表明,有EGFR/ALK基因突变或使用TKI治疗达3个月或以上的受试者其ORR有所提高,但无统计学差异,这可能与样本量太少有关。同样,周彩存教授在2013年世界肺癌大会上也报道,在我国进行的旨在评价贝伐珠单抗联合紫杉醇/卡铂一线治疗晚期NSCLC患者疗效和安全性的Ⅲ期注册临床研究(BEYOND研究)亚组分析中发现,有EGFR基因突变的23例受试者其疗效更好,中位PFS达12.4月[10]。这些现象是否能预示有EGFR/ALK突变的NSCLC患者对贝伐珠单抗的治疗更敏感,值得进一步研究。而且,本文的亚组分析显示,与其他联用方案相比,贝伐珠单抗联合培美曲塞方案受试者其中位PFS显著延长(P=0.028),这意味着此联用方案可能是晚期NSCLC患者治疗的最佳选择。不过,依据该亚组数据分析,贝伐珠单抗联合培美曲塞方案的疗效较好,也可能与其受试者中更多属二线治疗有关,因为,无论文献报道还是临床经验均告诉我们:化疗药物的使用越早效果越好,越迟效果会变差且毒性加大。另外,维持治疗时常将培美曲塞与贝伐珠单抗联合使用,这对患者PFS的延长也可能起一定的积极作用。
总之,结合本文的实验研究和既往的研究报道,笔者以为,对于初始治疗时化疗未联合贝伐珠单抗的非鳞型NSCLC患者,对于身体状况允许的部分患者,将贝伐珠单抗联合化疗用于其二线及以上治疗,是相对安全的,且可提高治疗的ORR和PFS。然而,将贝伐珠单抗联合化疗作为标准的二线及以上治疗用于晚期非鳞型NSCLC患者,仍需大样本前瞻性随机对照的Ⅲ期临床试验的进一步验证。
[1]Shepherd F A, Dancey J, Ramlau R, et al. Prospective randomized trial of docetaxel versus best supportive care in patients with non-small cell lung cancer previously treated with plat-inum-based chemotherapy[J]. J Clin Oncol,2000,18(10):2095-2103.
[2]Hanna N, Shepherd F A, Fosella F V, et al. Randomized phase III trial of pemetrexed versus docetaxel in patients with non-small cell lung cancer previously treated with chemotherapy[J]. J Clin Oncol,2004,22(9):1589-1597.
[3]Buccheri G, Ferrigno D, Tamburini M. Karnofsky and ECOG performance status scoring in lung cancer: a prospective, longitudinal study of 536 patients from a single institution[J]. Eur J Cancer,1996,32A(7):1135-1141.
[4]Sandler A, Gray R, Perry M C, et al. Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer[J]. N Engl J Med,2006,355(24):2542-2550.
[5]Barlesi F, Scherpereel A, Rittmeyer A, et al. Randomized phase III trial of maintenance bevacizumab with or without pemetrexed after firstline induction with bevacizumab, cisplatin, and pemetrexed in advanced nonsquamous non–small-cell lung cancer: AVAPERL (MO22089)[J]. J Clin Oncol,2013,31(24):3004-3011.
[6]Maki S, Igawa S, Otani S, et al. Efficacy of chemotherapy with carboplatin-paclitaxel plus bevacizumab for previously treated patients with advanced non-small cell carcinoma[J]. Gan To Kagaku Ryoho,2012,39(13):2509-2512.
[7]Heist R S, Fidias P, Huberman M, et al. A phase II study of oxaliplatin, pemetrexed, and bevacizumab in previously treated advanced non-small cell lung cancer[J]. J Thorac Oncol,2008,3(10):1153-1158.
[8]Adjei A A, Mandrekar S J, Dy G K, et al. Phase II trial of pemetrexed plus bevacizumab for second-line therapy of patients with advanced non-small-cell lung cancer: NCCTG and SWOG study N0426[J]. J Clin Oncol,2010,28(4):614-619.
[9]苗茜,黄诚,徐振武,等.晚期NSCLC多程治疗后应用贝伐单抗的疗效及安全性分析[J].海峡药学,2013,25(12):142-143.
[10]Zhou C, Chen G, Liu X, et al. BEYOND: a randomized, double-blind, placebo-controlled, multicentre, phase III study of first-line carboplatin/ paclitaxel (CP) plus bevacizumab (BV) or placebo (PL) in Chinese patients with advanced or recurrent non-squamous non-small cell lung cancer (NSCLC)[J]. J Thorac Oncol,2013,8(Suppl 2): S293.
Clinical Observation on Bevacizumab Combined with Chemotherapy as Second- or Later-line Treatment for Advanced Non-squamous Non Small Cell Lung Cancer
HU Qingqing1, SHI Meiqi2, YU Shaorong2, WANG Li2, XIA Guohao2, GUO Renhong2, WANG Youqun1
( 1. Clinical Pharmacy Teaching and Research Section, China Pharmaceutical University, Nanjing 210009, China; 2. Department of Oncology, Jiangsu Cancer Hospital, Nanjing 210009, China)
Objective: To investigate the efficacy and safety of bevacizumab combined with chemotherapy as second- or later-line treatment for advanced non-squamous non small cell lung cancer(NSCLC). Methods: A total of 28 advanced non-squamous NSCLC patients confirmed by histopathology or cytology received bevacizumab combined with chemotherapy as second- or later-line treatment. On day 1, all patients received 7.5 mg • kg-1bevacizumab by intravenous infusion combined with chemotherapy including pemetrexed with or without platinum, nab-paclitaxel with or without platinum or S-1 and gemcitabine/paclitaxel/docetaexed with or without platinum. The treatment course was repeated every three weeks, lasting four cycles. Then the maintenance treatment was continued, until the subjects cannot tolerate the combined therapy or disease progression. The efficacy was estimated by RICIST 1.1 standard and adverse reactions were estimated by NCI CTC 4.0 standard. Results: In the 28 patients, there was no case with complete response;11 cases(39.3%) had partial response,16 cases(57.1%) had stable disease and 1 case(3.6%) had progressive disease; the objective response rate was 39.7%(11/28) and the disease control rate was 96.4%(27/28); the median progression-free survival (PFS) was 5 months and the median overall survival(OS) was 10 months. Further sub group analysis showed that the median PFS from the subjects receiving bevacizumab combined pemetrexed with or without platinum regimen was 6 months , which was more effective than other combined chemotherapy regimens with statistically significant difference(P=0.028). Safety analysis showed that the major bevacizumab-related adverse reactions were I-III degree of hypertension and I/II degree of proteinuria/bleeding/fever. Conclusion: Only one case had III degree hypertension, the rest of patients had I/II degree of hypertension, proteinuria, and bleeding with good toleration from the bevacizumab-related toxicities. Conclusion: Bevacizumab combined with chemotherapy exhibits higher activity than that of chemotherapy alone in second- or later-line treatment for advanced non-squamous NSCLC and has acceptable toxicity. It should be recommended, especially for those patients with better economic condition.
non-squamous non-small cell lung cancer; bevacizumab; combined chemotherapy贝伐珠单抗联合细胞毒化疗已成为晚期非鳞型非小细胞肺癌(NSCLC)一线标准化疗方案,但因诸多因素,如最常见的经济原因,往往在初始治疗时并未将贝伐珠单抗纳入临床一线使用,而后期因疾病进展,患者希望得到更有效且副作用小的治疗方案,方会考虑联合使用贝伐珠单抗。对表皮生长因子受体(epidermal growth factor receptor,EGFR)基因未突变或已经对EGFR酪胺酸激酶抑制剂(tyrosine kinase inhibitors,TKI)产生耐药的患者,二线及以上治疗常常采用单药化疗,但其无论是近期疗效或是在延长无疾病进展时间方面都非常有限,均不能令病人及医务人员满意[1-2]。笔者收集了江苏省肿瘤医院自2011年11月至2014年1月采用贝伐珠单抗联合化疗对晚期非鳞型NSCLC患者进行探索性二线及以上治疗的案例,现分析报道如下。
R734.2;R979.19
B
1001-5094(2014)11-0848-07
接受日期:2014-10-17;
*通讯作者:史美祺,主任医师; 研究方向:心血管药理及临床药学; Tel:025-83283568; E-mail: shimeiqi1963@163.com
**通讯作者:王友群,副教授; 研究方向:肿瘤内科; Tel:025-83271070; E-mail: wyqfbox@163.com
