萝卜硫素对饥饿诱导人脐静脉内皮细胞凋亡的抑制作用
2014-03-09郑来双马玉莲河南省医药采购服务中心郑州450000
郑来双,马玉莲(河南省医药采购服务中心,郑州 450000)
血管内皮细胞(Vascular endothelial cell,VEC)遍布全身,是覆盖于整个心血管系统表面的一层扁平细胞,为维持血液循环系统的健康发挥着至关重要的作用[1]。在正常情况下,VEC 与血液直接接触,处于营养充足状态。而在缺血饥饿状态下,VEC 会快速走向凋亡[2]。VEC 凋亡会直接威胁机体平衡,导致动脉粥样硬化、败血症休克等[3]。如何防治VEC凋亡,已成为近年来研究的热点[4-5]。
萝卜硫素(Sulforaphane)是迄今为止蔬菜中发现的抗癌活性最强的一类异硫代氰酸盐[6],并具有抗氧化功能[7]。有文献报道,萝卜硫素可以有效地抑制氧化低密度脂蛋白引起的内皮细胞损伤[8],以及脂多糖诱导的内皮细胞的炎症反应[9]。但是,萝卜硫素对饥饿诱导VEC 凋亡的影响则少见报道。为此,笔者初步探究萝卜硫素抑制饥饿诱导的人脐静脉内皮细胞(HUVECs)凋亡的作用,以期为临床应用提供参考。
1 材料
1.1 仪器
CO2培养箱(美国Thermo Fishier 公司);X35型倒置显微镜(日本Olympus公司);Elx800型酶标仪(美国Bio Tek公司)。
1.2 药品与试剂
M199完全培养基(美国Invitrogen公司);重组牛碱性成纤维细胞生长因子(bFGF,珠海东大生物制药有限公司);胎牛血清(美国Hyclone公司);萝卜硫素、二甲亚砜(DMSO)、磺酰罗丹明B(SRB)、Hoechst 33258、吖啶橙(美国Sigma公司);RIPA裂解液(上海碧云天生物技术有限公司);微管相关蛋白轻链3(LC3)抗体(美国Cell signaling technology 公司);GAPDH 抗体、辣根过氧化物酶(HRP)标记的二抗(美国Santa Cruz 公司);PVDF膜、超敏化学发光底物(美国Millipore公司)。
1.3 细胞
HUVECs购于中国科学院上海细胞库。
2 方法
2.1 细胞培养与分组
HUVECs在M199完全培养基中常规培养,完全培养基中含有10%胎牛血清、2μmol/ml的bFGF。培养条件为饱和湿度下37℃、5%CO2。HUVECs随机均分为4组,即正常对照(完全培养液)组、模型(模型培养液)组与萝卜硫素高、低浓度(10、5μmol/L)组。
2.2 显微镜观察细胞形态
将HUVECs种植到24孔板中,处理完毕后,利用显微镜拍照并分析细胞形态变化。
2.3 SRB 法检测细胞存活率
将HUVECs种植到96孔板中,空白组仅细胞培养液(不含细胞);正常对照组、模型组与萝卜硫素高、低浓度组给药同“2.2”项下方法。加药处理6、12、24h 后,弃去旧培养液,每孔加入100µl 10%三氯乙酸(TCA),4℃下固定1h;去离子水轻轻冲洗5次,室温下自然晾干;每孔加入50µl 0.4%的SRB,室温染色5min(平板震荡);弃染液,1%乙酸洗5次,风干;每孔加100µl 10mmol/L Trisbase 液,在平板震荡器上震荡5min。将空白组调零,用酶标仪于540nm 波长处检测各样品的光密度(OD),计算细胞存活率。细胞存活率=(给药组OD/模型组OD)×100%。正常对照组存活率设置为100%。
2.4 Hoechst 33258染色法检测细胞凋亡程度[10]
分组与给药同“2.1”项下方法。将HUVECs 种植到24孔板中,药物处理完毕后利用Hoechst 33258染色法对细胞进行活细胞染色。弃24孔板中细胞培养液,用PBS轻轻冲洗细胞1次;每孔加入0.5ml Hoechst 33258染液(10μg/ml),包上铝泊放入CO2培养箱中孵育15min;弃24孔板中染液,用PBS轻轻冲洗细胞2次;在显微镜下观察、拍照,紫外光激发,发射光为蓝色。Hoechst 33258染色显示细胞核片段化的细胞为凋亡细胞。
2.5 吖啶橙染色检测细胞自噬水平(酸性膜泡积累)变化[11]
分组与给药同“2.1”项下方法。将HUVECs 种植到24孔板中,化合物处理24h 后吸弃各孔中培养液,PBS 冲洗细胞2次;每孔中加入3滴吖啶橙染液(0.1mg/ml),染色1min;用PBS冲洗细胞2次;吸干PBS,再加入2滴新1×PBS(保持孔底湿润),显微镜下观察;用蓝色荧光激发,绿色为细胞核,红色即为酸性膜泡,拍照记录。吖啶橙染色显示的酸性膜泡积累情况是检测细胞自噬水平的重要指标。
2.6 Western blot法检测细胞自噬水平(自噬标志蛋白LC3蛋白表达)变化[11]
分组与给药同“2.1”项下方法。将HUVECs 种植到10cm培养皿中,药物处理24h 后利用RIPA 裂解液收集全蛋白,20µl 上样量进行电泳,按常规转膜,封闭后加一抗(1∶2000,V/V)4℃过夜,PBS漂洗3遍加二抗(1∶5000,V/V)室温1h,ECL显色,拍照记录。LC3-Ⅱ与LC3-Ⅰ的比值与自噬水平正相关。
2.7 统计学方法
至少取3次独立试验的结果,进行One-way ANOVA 检验。P<0.05为差异有统计学意义。
3 结果
3.1 萝卜硫素对模型细胞形态的影响
与正常对照组比较,模型组HUVECs出现细胞边缘发亮,脱离皿底的现象随着时间延长而愈加明显;同时,高、低浓度萝卜硫素可以有效地抑制这种现象。萝卜硫素对模型细胞形态的影响见图1。
3.2 萝卜硫素对模型细胞存活率的影响
与正常对照组比较,培养12、24h 时,模型组HUVECs 存活率降低,差异有统计学意义(P<0.01或P<0.05);与模型组比较,培养12、24h时,萝卜硫素高、低浓度组HUVECs存活率升高,差异有统计学意义(P<0.01或P<0.05)。萝卜硫素对模型细胞存活率的影响见表1。
3.3 萝卜硫素对模型细胞凋亡程度的影响
与正常对照组比较,培养12、24h 时,模型组HUVECs 细胞核皱缩现象增多;同时,高、低浓度萝卜硫素可以明显抑制细胞核皱缩现象。萝卜硫素对模型细胞凋亡程度的影响见图2、表2。
3.4 萝卜硫素对模型细胞自噬水平(酸性膜泡积累)的影响
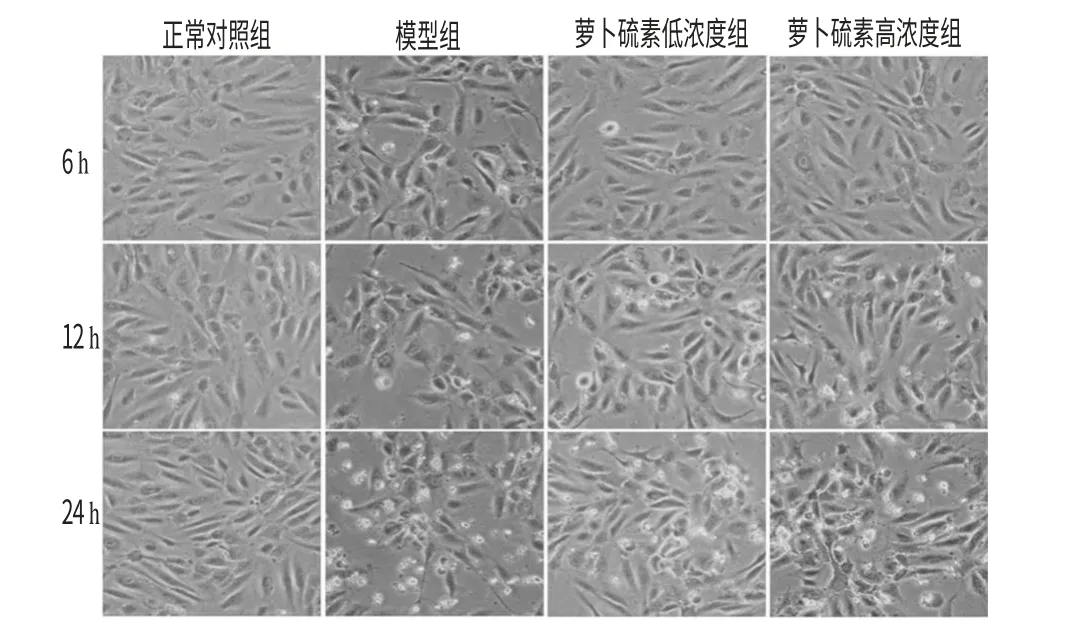
图1 萝卜硫素对模型细胞形态学的影响Fig 1 Effects of sulforaphen on the morphology of model cell

表1 萝卜硫素对模型细胞存活率的影响(n=6)Tab 1 Effects of sulforaphen on survival rate of model cell(n=6)
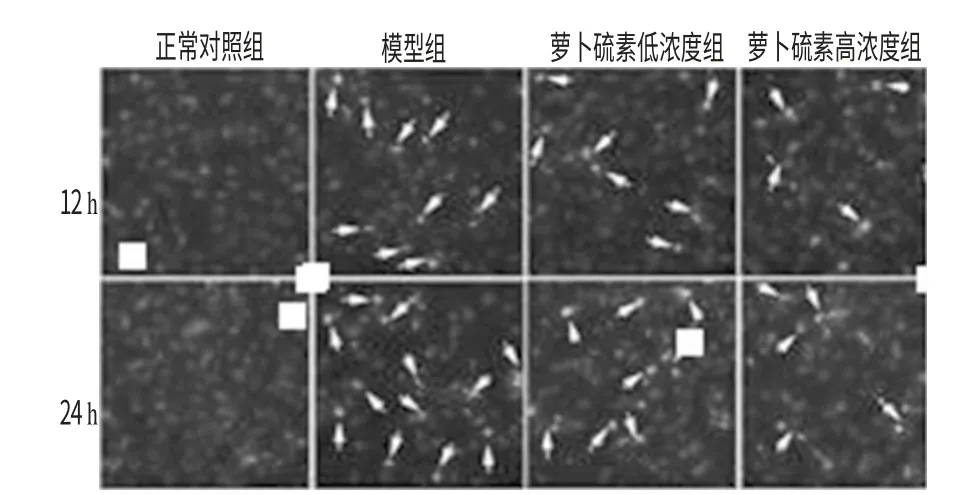
图2 萝卜硫素对模型细胞凋亡程度的影响(Heochst 33258染色)Fig 2 Effects of sulforaphen on the apoptosis of model cell(Heochst 33258staining)

表2 萝卜硫素对模型细胞凋亡程度的影响(n=6)Tab 2 Effects of sulforaphen on the apoptosis of model cell(n=6)
与正常对照组比较,模型组HUVECs 中酸性膜泡明显增多;同时,高、低浓度萝卜硫素可以进一步促进细胞中酸性膜泡的积累。结果表明,萝卜硫素可能引起HUVECs 自噬。萝卜硫素对模型细胞自噬水平的影响见图3。

图3 萝卜硫素对模型细胞自噬水平的影响(吖啶橙染色)Fig 3 Effects of sulforaphen on model cell autophagy(acridine orange staining)
3.5 萝卜硫素对模型细胞LC3蛋白表达的影响
与正常对照组比较,模型组HUVECs中LC3-Ⅰ、LC3-Ⅱ蛋白表达增强,差异有统计学意义(P<0.05);与模型组比较,萝卜硫素高、低浓度组HUVECs中LC3-Ⅱ蛋白表达进一步增强,差异具有统计学意义(P<0.01或P<0.05),且萝卜硫素高浓度组HU-VECs中LC3-Ⅰ表达进一步增强,差异有统计学意义(P<0.05)。结果表明,在饥饿条件下,萝卜硫素可以有效地诱导HUVEC自噬。萝卜硫素对模型细胞LC3蛋白表达的影响见表3。

表3 萝卜硫素对模型细胞LC3表达的影响(n=6)Tab 3 Effects of ulforaphen on the expression of LC3in model cell(n=6)
4 讨论
由于近年来对VEC 生物学功能认识的不断深入,发现其在多种人类疾病发病机制中起重要作用。有研究表明,VEC凋亡导致血管内皮层防止脂质沉积的屏障作用减弱,加速粥样斑块的形成[12],又可以启动凝血机制在病变局部形成血栓,加重血管管腔狭窄[13]。因此,抑制VEC 凋亡具有重要的临床意义。有研究表明,自噬可以抑制氧胁迫、代谢压力以及炎性因子诱导的VEC 凋亡。因此,通过调节自噬的水平抑制VEC的凋亡可以作为保护内皮的一种新思路。
作为一种植物抗癌物质,萝卜硫素能够刺激人或动物细胞产生仅对身体有益的Ⅱ型酶,同时抑制Ⅰ型酶的产生,使细胞形成对抗外来致癌物浸蚀的膜,达到抗癌效果[13]。有关萝卜硫素的临床报道很多,但是在VEC 保护方面的作用还知之甚少。在本研究中,笔者发现萝卜硫素可以有效地抑制由饥饿引起的HUVECs 存活率降低和凋亡,此外还可以诱导HUVECs自噬。由此推断,萝卜硫素可能通过诱导HUVEC自噬,抑制饥饿引起的细胞凋亡,进而提高其存活率。然而,萝卜硫素调控HUVECs自噬的具体机制仍需进一步的研究。
综上,本研究初步探讨了萝卜硫素在VEC 保护中的潜在价值,为萝卜硫素的临床应用以及VEC 自噬分子机制的研究提供了一个新的切入点。
[1]Esper RJ,Nordaby RA,Vilariño JO,et al.Endothelial dysfunction:a comprehensive appraisal[J].Cardiovasc Diabetol,2006(23):5.
[2]Russell FD,Hamilton KD.Nutrient deprivation increases vulnerability of endothelial cells to proinflammatory insults[J].Free Radic Biol Med,2014(67):408.
[3]Sima AV,Stancu CS,Simionescu M.Vascular endothelium in atherosclerosis[J].Cell Tissue Res,2009,335(1):191.
[4]Mudau M,Genis A,Lochner A,et al.Endothelial dysfunction:the early predictor of atherosclerosis[J].Cardiovasc J Afr,2012,23(4):222.
[5]Jain MV,Paczulla AM,Klonisch T,et al.Interconnections between apoptotic,autophagic and necrotic pathways:implications for cancer therapy development[J].J Cell Mol Med,2013,17(1):12.
[6]张品南,马绍英,杨海荣,等.西兰花种子及其愈伤组织中萝卜硫素含量比较[J].天然产物研究与开发,2013(25):796.
[7]吴华彰,费鸿君,黄银久,等.萝卜硫素的体外抗氧化和抑菌活性[J].中国老年学杂志,2012,32(4):70.
[8]Huang CS,Lin AH,Liu CT,et al.Isothiocyanates protect against oxidized LDL-induced endothelial dysfunction by upregulating Nrf2-dependent antioxidation and suppressing NFκB activation[J].Mol Nutr Food Res,2013,57(11):1918.
[9]Shan Y,Zhao R,Geng W,et al.Protective effect of sulforaphane on human vascular endothelial cells against lipopolysaccharide-induced inflammatory damage[J].Cardiovasc Toxicol,2010,10(2):139.
[10]Liu X,Zhao J,Xu J,et al.Protective effects of a benzoxazine derivative against oxidized LDL-induced apoptosis and the increases of integrin beta4,ROS,NF-kappaB and P53in human umbilical vein endothelial cells[J].Bioorg Med Chem Lett,2009,19(10):2896.
[11]Ding XL,Zhang HY,Qi L,et al.Synthesis of novel pyrazole carboxamide derivatives and discovery of modulators for apoptosis or autophagy in A549lung cancer cells[J].Bioorg Med Chem Lett,2009,19(18):5325.
[12]Sima AV,Stancu CS,Simionescu M.Vascular endothelium in atherosclerosis[J].Cell Tissue Res,2009,335(1):191.
[13]Rajendran P,Rengarajan T,Thangavel J,et al.The vascular endothelium and human diseases[J].Int J Biol Sci,2013,9(10):1057.
