海参中主要生物活性成分研究进展
2014-03-08郭盈莹徐飞飞刘宝月寇自农朱靖博
郭盈莹,丁 燕,2,*,徐飞飞,刘宝月,寇自农,朱靖博,2,*
(1.大连工业大学食品学院,辽宁 大连 116034;2.大连工业大学植物资源化学与应用研究所,辽宁 大连 1160 34;3.大连工业大学实验仪器中心,辽宁 大连 116034)
海参中主要生物活性成分研究进展
郭盈莹1,丁 燕1,2,*,徐飞飞1,刘宝月1,寇自农2,3,朱靖博1,2,*
(1.大连工业大学食品学院,辽宁 大连 116034;2.大连工业大学植物资源化学与应用研究所,辽宁 大连 1160 34;3.大连工业大学实验仪器中心,辽宁 大连 116034)
海参作为传统珍贵的食品及名贵的海洋生物,其保健价值由古至今一直为人们所称道。本文对近20年来国内外研究中发现的海参主要活性成分:多糖、海参皂苷、脑苷脂、神经 节苷脂的分子结构进行总结,并对其抗肿瘤、抗癌、提高免疫活性、抗菌等生物活性 进行综述,为海参资源的合理开发利用提供科学依据。
海参;分子结构;生物活性
海参(sea cucumber,Holothurian)属棘皮动物门(Echinodermata)海参纲(Holothuroidea)生物,全世界共有1 200多种,几乎全部生活于海洋,以印度-西太平洋区种类最多,食用海参大多分布在热带珊瑚礁内[1]。
海参以其极高的营养价值,在我国中医发展过程中占有一席之地。早在400年前的明代,《食物本草》中就记录海参具有主补元气、滋益五脏六腑虚损的养生功能[2]。清代《本草纲目拾遗》将海参列为补益药物,有“海参性温补,足敌人参,故名海参”,“补肾经,益精髓,消痰涎,摄小便,生血壮阳,治疗溃疡生殖”的记载[3]。《随息居饮食谱》中称其“滋阴、补血、健阳、润燥、调经、养胎、利产。产后、病后衰老,宜同火腿或猪羊肉煨食之”[4]。
近年来,随着人们保健意识的提高,海参的营养保健价值越来越受到关注。大量研究发现,海参中含有多糖、海参皂苷、脑苷脂、神经节苷脂等多种生物活性物质,而进一步的研究证明其具有提高免疫活性、抗肿瘤、抗癌、抗真菌等生理药理活性。本文将重点对海参中活性物质的结构和其所具有的生物活性进行归纳,为进一步研究海参中天然成分的活性以及开发具有特定功能的新型药物或保健食品提供依据。
1 海参多糖
海参多糖是海参体壁的重要功能成分,其含量最高可占干海参总有机物的31%。海参的多糖含量及组成等是衡量海参营养价值的重要化学指标。现代药理学研究表明:海参多糖有多种药理活性,包括抗肿瘤、免疫调节、抗凝血与抗血栓形成、降血脂等作用。
1.1 化学结构
海参体壁的多糖主要分为海参硫酸软骨素、海参岩藻聚糖硫酸酯两大类。海参硫酸软骨素(sea cucumberchondroitin sulfate,SC-CHS)是一种带岩藻糖支链的酸性黏多糖,主要由D-N-乙酰氨基半乳糖、D-葡萄糖醛酸、L-岩藻糖组成的分支杂多糖,是海参多糖的重要成分。海参岩藻聚糖硫酸酯(sea cucumber fucan,SC-FUC)是由L-岩藻糖所构成的直链多糖。两种海参多糖的结构均为海参所特有,二者的糖基组成不同,糖链上都有部分羟基发生硫酸酯化。海参多糖存在着硫酸化程度的不一致性、显微结构和分子质量的不均匀性、残基数量的多变性等特点,使海参多糖纯化和结构分析具有复杂性[5]。
到目前为止,对海参多糖的单糖组成进行了初步研究,但由于其结构复杂性和组成多样性,研究还不够深入,只集中在对其生物活性方面的研究。
1.2 生物活性
1.2.1 抗肿瘤
近年来,有关海参多糖抗肿瘤的研究取得了积极进展。苏秀榕等[6]对刺参(Stichopus japonicus Selenka)粗多糖抗肝癌腹水型肿瘤细胞进行了动物抑瘤实验,刺参粗多糖具有明显的抗肿瘤活性,其抑瘤率为73.56%。吴萍茹等[7]对二色桌片参的精蛋白Ⅰ(glycoprotein of Mensamaria intercedens-Ⅰ,GPMI-Ⅰ)及其经蛋白酶水解得到的含糖量较高的糖蛋白Ⅱ(glycoprotein of Mensamaria intercedens-Ⅱ,GPMI-Ⅱ)进行了抗肿瘤活性研究。GPMI-Ⅱ明显抑制小鼠S180肿瘤细胞的生长,而GPMI-Ⅰ的抑制作用不明显,GPMI-Ⅰ可增加荷瘤小鼠脾脏质量,但GPMI-Ⅱ无此作用,推测GPMI-Ⅱ具有显著的抑瘤活性。王静凤等[8]连续向小鼠腹腔注射SC-FUC 26 d后,SC-FUC剂量组小鼠的肺转移灶数量显著减少,血清唾液酸含量、γ-谷氨酰转肽酶活力显著降低,肺组织中羟脯氨酸、氨基己糖、糖醛酸的含量显著下降,说明SC-FUC能显著抑制肿瘤细胞在小鼠体内的转移和生长。Collin[9]应用鸡胚尿囊膜模型实验发现海参硫酸基多糖具有明显抑制新生血管形成 的活性,可以达到阳性对照药(氢化可的松)的效果,强于鲨鱼的6-硫酸软骨素的作用,质量浓度为100 g/mL时有效抑制率达到63%。王振立等[10]研究表明:刺参酸性黏多糖能明显抑制小鼠S180细胞及乳腺癌细胞DNA的合成,同时对荷瘤小鼠正常肝细胞DNA的合成具有促进作用。Moon等[11]从刺参中提取糖蛋白(glycoprotein,GP)和硫酸软骨素(chondroitin sulfate,CS),研究其对几种药物致突变作用的影响,发现5% GP对黄曲霉素B1和3,2-二甲基-4-氨基二酚的抑制率为84%~98%,其中红海参GP为98%、95%,5% CS的抑制率为79%~85%;GP对于单功能烷 化剂甲基硝基亚硝基胍、硝基喹啉的抑制率为55%~78%,CS为58%~70%;5% GP对于HT-29人结肠腺癌细胞、AZ-521人胃癌细胞生长抑制率分别为89%~95%、82%~92%。Lory等[12]提取花刺参多糖,对鼻咽癌患者调节T细胞亚群中的T4、T8细胞进行研究,证实花刺参多糖对二者均有明显的诱导和激活作用,细胞数量分别增加44.1%、29.1%,且T4细胞增加较T8细胞高。杨玉红等[13]利用化学法建立HGC-27胃癌细胞体外缺氧培养模型,发现SC-FUC具有显著抑制HGC-27细胞增殖的活性(72、96 h的IC50值分别为170、100 g/mL);可降低肿瘤细胞同基质、血管内皮细胞间的黏附率,并抑制HGC-27细胞的侵袭和迁移能力,其72 h的侵袭率、迁移率分别降低了59.73%、67.96%;能显著抑制体外内皮细胞小管形成能力,并减少体内鸡胚尿囊膜实验新生血管数目,进而SC-FUC具有显著抑制缺氧诱导的HGC-27胃癌细胞转移的能力。
1.2.2 免疫调节
海参多糖能增强机体的细胞免疫力,可改善机体免疫功能低下的状况。黄益丽等[14]通过对二色桌片参进行双酶水解、乙醇沉淀,从干参体内分离得到二色桌片参多糖-1,其在体外有助于小鼠脾淋巴细胞增殖,使小鼠脾淋巴细胞分泌白细胞介素-2速度加快;在体内能显著使迟发型超敏反应加快,提高脾指数、胸腺指数,具有显著的免疫增强作用。
1.2.3 抗凝血与抗血栓形成
Nagase等[15]将海参黏多糖降解后观察其防冶凝血酶诱导的兔血栓形成的能力,发现其抗凝血因子Xa的活性不依赖于AT-Ⅲ肝素辅助因子Ⅱ。王学峰等[16]对玉足 海参胶囊的临床观察表明它具有抗凝,降低血液黏度的作用。李志广等[17]以细菌 脂多糖(lipopolysaccharide,LPS)诱导人静脉内皮细胞,发现糖胺聚糖(glycosaminoglycan,GAG)能降低受刺激细胞的促凝活性和组织因子的表达及其mRNA的转录,同时增强凝血酶抗原的表达及其mRNA的转录,可能为其抗血栓机理之一。沈卫章等[18]对玉足海参GAG进行抗血栓形成研究,发现玉足 海参GAG以浓度和时间依赖的方式促进内皮细胞组织因子通道抑制剂的合成、表达和分泌,低质量浓度的玉足海参GAG(0.1、0.5 mg/L)延长了血凝块的溶解时间,而高质量浓度GAG(5、10 mg/L)能够缩短血凝块的溶解时间。王学锋等[19]利用细胞培养的方法将细菌LPS与内皮细胞进行培养,认为海参糖胺聚糖通过抑制内皮细胞组织因子表达,促进凝血酶调节蛋白表达,降低内皮细胞纤溶酶原激活物抑制剂-1(plasminogen activator inhibitor-1,PAI-l)合成、分泌及PAI-l mRNA转录,发挥抗血栓作用。Chen Shiguo等[20]从海参中分离得到硫酸化的脱氧半乳聚糖fucan-Ib以及岩藻糖基化的硫酸软骨素fCS-Ib,通过活化促凝血酶原激酶、凝血酶,以及凝血因子Ⅱa和Xa的体外抑制实验来测定凝血活性。在体外实验中fucan-Ib表现出良好的抗凝血和抗血栓形成的活性,其抗凝血活性主要是通过增强抗凝血酶对凝血酶和Xa的作用实现,而fCS-Ib主要是通过肝素辅因子Ⅱ实现。
1.2.4 降血脂
Liu等[21]对海参中黏多糖降血脂作用的研究表明:当喂食大鼠含有1%胆固醇和20 mg/kg以下的海参葡萄糖胺聚糖时,总胆固醇、低密度脂蛋白-胆固醇、动脉粥样硬化指数均明显降低,同时高密度脂蛋白显著增加;同样,GAG也阻碍了肝中胆固醇、甘油三酯、磷脂的增加。因此,海参GAG有可能被用于降低动脉粥样硬化和高脂蛋白血症风险预防方面。Liu Xin等[22]由蛋白酶水解法从刺参中得到多糖AJP进行体内抗氧化活性和体内抗高血脂研究,AJP具有强大的自由基清除活性和还原能力,经过AJP治疗的大鼠血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)和低密度脂蛋白显著降低,高密度脂蛋白显著增加。这些结果表明,AJP可能是治疗高脂血症的一个潜在的天然抗氧化剂。
2 海参皂苷
海参皂苷为海参所特有的一类三萜皂苷,是海参的主要次生代谢产物,也是其进行防御的化学物质基础。20世纪40年代中期,Nigrelli[23]和Yamanouchi[24]等分别从阿氏辐肛参和荡 皮海参的体壁中分离到海参毒素holotoxin,被证实为海参皂苷。之后,大量学者开始对海参皂苷进行研究,并取得了长足进展,仅近20年就发现海参皂苷结构100多个。现代药理活性研究表明海参皂苷具有提高免疫力、抗肿瘤、抗菌、抗癌等多种生物活性。
2.1 化学结构
海参皂苷结构复杂,其多样性主 要体现在苷元环上的取代基团种类、取代部位以及与之相连糖链的单糖类型、数量、连接顺序的不同。根据苷元的结构常把海参皂苷分为海参烷型和非海参烷型两大类,区别在于海参烷型皂苷的苷元具有18(20)内酯环,而非海参烷型皂苷无内酯环或其内酯环位于16(18)位。
2.1.1 海参烷型
近20年来有100多种新的海参皂苷被发现,其中大部分为海参烷型,苷元主要集中于3种类型。



图1 第一类海参烷型皂苷分子结构图Fig.1 Structures of the first category of holostane saponins
如图1所示,第一类海参烷型海参皂苷苷元上除18位存在有不同碳链外,仅在16位上有取代基,包括Eupentacta fraudatrix中CucumariosidesHolothuria Axiloga中Axilogpside G[26],Pentacta quadrangulasis中Philinopgenin A、B[27],Mensamaria intercedens中Intercedenol A、B[28],Pseudocolochirus violaceus中Violaceuside A、B[29],Synallactes nozawai中Synallactosides A1、A2、B1、B2、C[30],Pseudostichopus trachus中Pseudostichoposide B[31],Stichopus parvimensis中Parvimosides A、B[32],Pentacta quadrangulari中Philinopside A[33],Cucumar ia okhotensis中Okhotoside A1-1、A2-1[34],Cucumaria frondosa Gunnerus中Frondoside A6[35],Pentacta quadrangularis中Pentactasides B、C[26],Mensamaria interoedens中IntercedensidesA、B、C[36], Australostichopus mollis中Mollisosides A、B1、Stichopus variegatus中Variegatuside A、B[38],Staurocucuis liouvillei中Liouvillosides A、B[39],Staurocucumis liouviellei中Liouvillosides A1、A2、A3、B1、,Pentacta australis中ds-Penaustroside C、D[42],Cucumaria echinata中Disialo-,Trisialo-gangliosides C、D[43],Colochirus anceps中Colochiroside A[44],Staurocucumis liouvillei中 Liouvillosides A4、Cucumaria okhotensis中Okhotosides
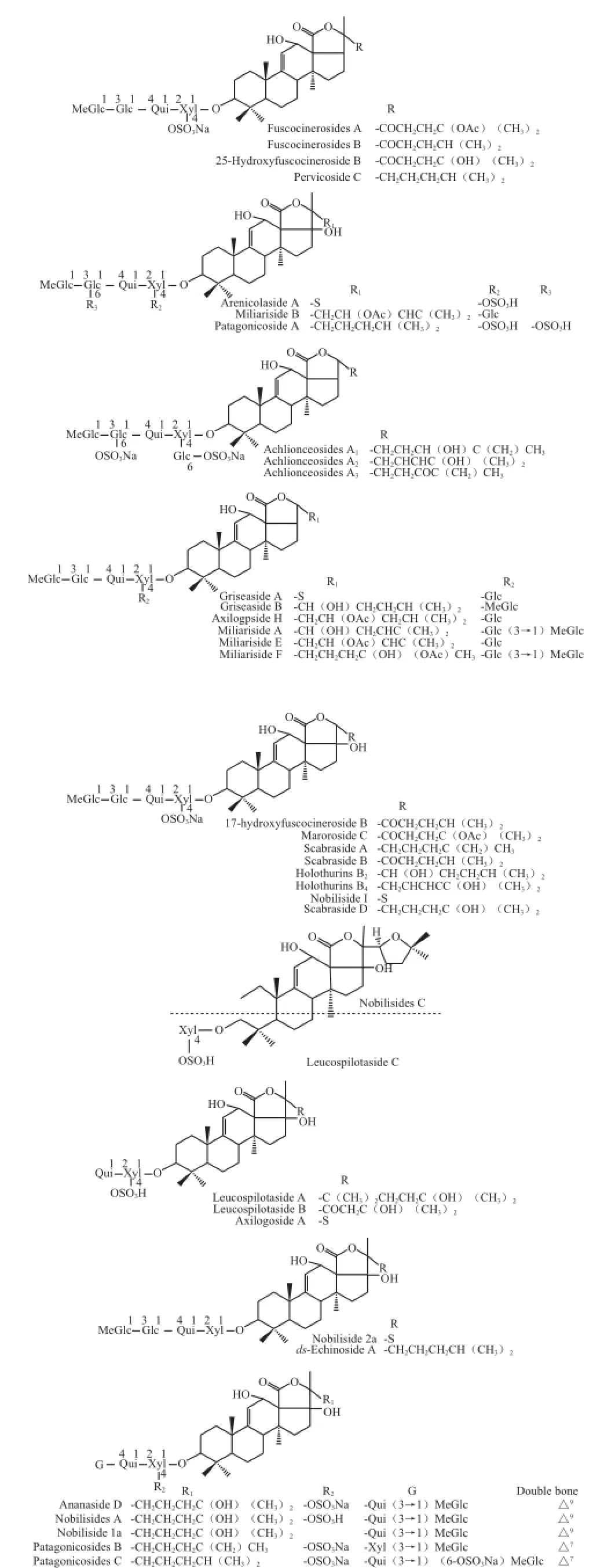
图2 第二类海参烷型皂苷分子结构图Fig.2 Structures of the second category of holostane saponins
如图2所示,第二类海参烷型皂苷12位上有羟基存在,部分分子的17位上连有羟基,Holothuria impatiens中的17-Dehydroxyholothurin A[46],Psolus patagonicus中的Patagonicosides B、C[47],Holothuria中的Holothurins B2、B3、B4[48],Holothuria fuscocinerea中的Fuscocinerosides A、B、C[49],Bohadschia marmorata Jaeger中的17-Hydroxyfuscocineroside B、25-Hydroxyfuscocineroside B[50],Holothuria fuscocinerea中的Pervicoside C[51],Holothuria aren icola Semper中的Arenicolaside A[52],Actinopyga miliaris中的Miliariside A、B、E、F[26],Psolus patagonicus中的Patagonicoside A[53],Achlionice violaecuspidata中的Achlioniceosides A1、A2、A3[54],Holothuria grisea Selenka中的Griseaside A、B[55],Holothuria axiloga中的Axilogpside H[26],Bohadschia marmorata Jaeger中的Marmoroside C[56],Holothuria scabra中的Scabraside A、B[57],Holothuria nobilis中的Nobiliside I[58],Apostichopus japonicus中的Scabraside D[59],Holothuria leucospilota中的Leucospilotaside A、B、C[60-62],Holothuria nobilis中的Nobilisides1a、2a、A、C[63-64]、Holothuria(Microthele)Axiloga中的Axilogoside A[65],Pearsonothuria graeffei中的ds-Echinoside A[66],Thelenota ananas Jaeger中的Ananaside D[67]都属于此类结构。
从Mensamaria interoedens中分离得到Intercedensides C[36],Holothuria scabra Jaeger中得到Scabraside A[68],Holothuria nobilis中得到Nobilisides B[64],以及Actinopyga miliaris中得到的Miliariside D[26]都属于第三类海参烷型皂苷,它们17位上存在羟基,Scabraside A和Miliariside D的12位上有羟基取代,Intercedensides C、Scabraside A、Miliariside D的16位上有乙酰氧基存在,具体结构见图3。

图3 第三类海参烷型皂苷分子结构Fig.3 Structures of the third category of holostane saponins
2.1.2 非海参烷型
近年来发现的非海参烷型皂苷较少,根据苷元结构可以划分为3种类型。第一类苷元中有16(18)-内脂环,仅有3个新皂苷Cucumarioside G2[69]、Philinopgenin B[54]、Nobiliside Ⅱ[58],分别从Cucumaria fraudatrix、Pentacta quadrangulasis、Holothuria nobilis中分离得到,其中Philinopgenin B的结构中不含有糖链。Auilou[70]、Afiyatullov等[71]先后从Eupentacta fraudatrix海参中发现Virescenosides O、P、Q、V、W、X,这6个化合物均在4位上与一个寡糖相连,它们具有相同的一类苷元,寡糖种类以及2、6、7位上取代基的不同导致了分子结构上的差异。从Pentacta australis中发现的ds-Penaustroside A、B[42]和Cucumaria echinata中发现的Disialo-、Trisialo-gangliosides A、B[72]的苷元属于第三类非海参烷型皂苷元,它们的结构相似,与之相连糖链的单糖组成相同,ds-Penaustroside A与Disialo-、Trisialo-gangliosides A、ds-Penaustroside B与Disialo-、Trisialo-gangliosides B结构区别仅在于后者比前者碳链短,缺少一个C原子。

图4 非海参烷型皂苷分子结构Fig.4 Structures of nonhol ostane saponins
2.2 生物活性
海参皂苷化学结构研究上取得的巨大进展,促使大量学者开始关注其药理活性,并进行了一系列的相关实验,发现多种对人体有意义的活性。
2.2.1 免疫调节
Aminin等[73-74]研究发现瓜参皂苷在极低剂量下能促进单核细胞的吞噬作用以及肿瘤坏死因子-α的释放,促进小鼠抗体细胞的生成,说明该类海参皂苷对机体免疫能力具有促进作用。王静凤等[75]研究证明了革皮氏海参中提取的海参皂苷,能显著提高正常小鼠的细胞免疫和非特异性免疫功能,促进其腹腔巨噬细胞的吞噬能力;同时对于免疫功能低下小鼠,革皮氏海参皂苷能显著提高小鼠体液免疫及细胞免疫功能。
2.2.2 抗肿瘤
Tian Fang等[76]对硫酸化皂素PE进行体外和体内的抗血管生成和抗肿瘤活性的研究,结果表明,PE能抑制人微血管内皮细胞(human microvascular endothelial cells,HMECs)和人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)的增殖,诱导内皮细胞的凋亡,剂量依赖性抑制细胞迁移、HMECs和HUVECs细胞黏附和形成,显示出抗肿瘤细胞的增殖活性。刘治东[77]研究了革皮氏海参皂苷抗肿瘤活性、作用机制及其构效关系,发现革皮氏海参皂苷能全面提高机体的抗氧化水平,抑制肿瘤的生长;三萜皂苷Holothurin A1(HA)、24-Dehydroechinoside A(DA)能通过降低MMP-9的表达,降低肿瘤细胞的运动能力、黏附能力、侵袭能力,抑制肿瘤细胞的转移,并通过诱导内皮细胞凋亡,降低肿瘤细胞促血管生长因子的表达,抑制肿瘤血管新生,其中,DA的活性高于HA。尹一恒等[78]研究海参皂苷Fuscocineroside A对人脑胶质母细胞瘤U251细胞的生长抑制作用及机制,结果显示Fuscocineroside A能显著抑制U251细胞的生长,诱导其凋亡,下调survivin基因的表达,呈浓度及时间依赖性,而对正常胶质细胞并没有明显抑制作用。樊廷俊等[79]对海参皂苷体内外抑瘤活性和诱导肿瘤细胞凋亡进行了检测,发现大孔树脂柱的70%乙醇洗 脱组分以及硅胶柱色谱的部分纯化组分(pSC-2、pSC-3)对HeLa宫颈癌细胞、A-549肺癌细胞、SGC-7901胃癌细胞、Bel-7402肝癌细胞均具有显著的抑瘤活性;经过葡聚糖凝胶柱色谱获得的SC-2纯化样品,能抑制HeLa细胞的体外增殖、S180实体瘤的体内生长,说明水溶性海参皂苷SC-2纯化样品具有显著的抑瘤活性,其机制可能是通过诱导肿瘤细胞凋亡来实现的。张淑瑜等[33]应用稻瘟霉生物模型进行活性跟踪筛选分离得到一种新的三萜皂苷Violaceuside A,并对其进行细胞毒活性研究,结果表明其对Bel-7402肝癌细胞株、HL-60白血病细胞株均具有很强的细胞毒性。Zhao Qin等[47]还从菲律宾刺参中得到海参皂苷(ds-Echinoside A,DSEA),研究其在体外、体内对肿瘤细胞的影响,发现DSEA对肝癌细胞HepG2增殖的抑制能力较强,同时可剂量依赖的抑制细胞黏附、迁移、入侵。Zhao Qin等[80]从菲律宾刺参中分离出两个海参皂苷,研究其抗癌能力,发现HA1、DHEA抑制HepG2黏附能力显著,并能抑制HepG2细胞迁移和入侵。Al Marzouqi等[81]对Frondoside A影响人类乳腺癌细胞的存活、迁移、入侵的能力进行了研究,发现Frondoside A可以降低乳腺癌细胞生存的能力,能剂量依赖性的影响MDA-MB-231乳癌细胞的迁移和入侵,且无明显毒副作用,表明Frondoside A具有作为治疗乳腺癌药物的潜力。
2.2.3 抗菌
丛日山等[82]从仿刺参中提取分离出一种水溶性海参皂苷,抑菌实验结果显示该海参皂苷对6株真菌都具有显著的抑制作用,其抑制活性大小依次为裂殖酵母菌、啤酒酵母菌、白色念珠菌、葡萄炭疽原菌、黄瓜枯萎病原菌、黑曲霉。袁文鹏等[83]分离纯化筛选出海参皂苷中SC-1、SC-2、SC-3、SC-4这4种样品,其中SC-2、SC-3、SC-4对裂殖酵母菌、白色念珠菌的抗真菌活性显著。Yuan Weihua等[84]从图纹白尼参中提取得到6 种海参皂苷,对其抗菌活性进行了研究,其中Marmoratoside A、17α-Hydroxy Impatienside A、Impatienside A、Bivittoside D对4种菌株表现出了很强的抗菌活性。韩华等[85]对糙海参皂苷提取物的抗真菌、抗肿瘤活性进行研究,结果发现Scabraside A、B两种 皂苷对7种真菌均表现出很强的抑制活性。Wang Zenglei等[86]从刺参中提取出海参皂苷,经过抑菌实验,发现其在体外对白色念珠 菌、热带念珠菌、新型隐球菌、红色毛癣菌、石膏样小孢子菌及曲霉菌有很强的抗真菌的活性。
2.2.4 其他
Hu Xiaoqian等[87]对菲律宾刺参中提取的海参皂苷(saponins of sea cucumber,SSC)进行了大鼠脂肪肝预防的活性研究,喂养SSC的大鼠肝脂肪变性和血清TG、TC浓度明显降低,肝脂肪生成酶,如脂肪酸合酶、苹果酸脱氢酶、葡萄糖-6-磷酸脱氢酶的活性也受到抑制。因此认为,SSC可能有助于减轻脂肪肝。李冰等[88]研究了海参皂苷对小鼠骨髓造血机能的促进作用,革皮氏海参总皂苷能明显促进雄性大鼠外周血中白细胞数、血小板数增加,通过刺激肺、脾脏、腹腔巨噬细胞等组织中分泌多种造血生长因子、调整细胞周期、促进细胞有丝分裂、抑制细胞凋亡,促进小鼠骨髓造血功能。
3 脑苷脂
脑苷脂亦称为酰基鞘氨醇己糖苷,是一类广泛存在于菌类、植物类、动物类及海洋生物组织细胞膜中的内源性生物活性物质[89]。1876年,Thudichum[90]最早指出大脑中存在一种叫脑苷脂类的化合物,后续研究表明,脑苷脂属鞘脂类(sphingolipids)的一种,由神经酰胺、糖基两部分组成。近年来海参中已报道的脑苷脂类化合物仅10多种,发现其具有预防脂肪肝、抗肿瘤等生物活性。
3.1 化学结构
脑苷脂是海参中含量最高的鞘脂类化合物,国外对其化学成分的研究较少,国内的相关研究更是刚刚起步。Holothuria pervicax中的HPC-3-A~HPC-3-J[91]、Stichopus japonicus的SJC-4、SJC-5[92]和Bohadschia argus中的BAC-4-4[93]是目前有明确结构报道的海参脑苷脂(图5)。

图5 海参脑苷脂分子结构图Fig.5 Structures of sea cucumber cerebrosides
3.2 生物活性
Xu Jie等[94]用柱层析法分离得到脑苷脂AMC-2(acaudina molpadioides cerebrosides-2),并研究其对大鼠脂肪肝的影响,发现AMC-2使大鼠肝中TG、TC水平,硬脂酰辅酶A去饱和酶(stearoyl-coenzyme A desaturase,SCD)的活性降低,mRNA的表达明显减少,这表明AMC-2能通过抑制SCD活动和脂肪细胞的生物合成来改善大鼠的非酒精性脂肪肝。Du Lei等[95]研究了海参中脑苷脂的抗肿瘤活性,结果表明:脑苷脂AMC、AAC(asterias amurensis cerebrosides)能通过诱导S180细胞的凋亡抑制细胞增殖,在体外和体内通过诱导线粒体介导细胞凋亡而表现出抗肿瘤活性。
4 神经节苷脂
1942年,Klenk[96]从牛脑中分离得到一种含有唾液酸的鞘糖脂化合物,将其命名为神经节苷脂(ganglioside,Gls)。神经节苷脂是棘皮动物体内一种重要生物活性成分,其分子中含有一个或多个唾液酸。神经节苷脂与许多生物学过程相关,并且在一些中枢神经系统疾病的病理过程中起重要作用。
4.1 化学结构
神经节苷脂是海参中除脑苷脂外发现的另一种活性较高的鞘脂类化合物,迄今为止,对于海参中神经节苷脂的研究并不深入,文献中已报道的结构仅有Yamada[97-99]和Kisa[100-101]等先后在Holothuria pervicax、Holothuria leucospilota、Stichopus chloronotus、Cucumaria echinata 4种海参中发现HPG-7、HLG-2、HLG-3、SCG-1~3、CEG-3~6、CEG-8、CEG-9这12种神经节苷酯,它们具有6种不同的母核结构。


图6 海参神经节苷脂的分子结构图Fig.6 Structures of sea cucumber gangliosides
4.2 生物活性
Yamada[97-98]和Kisa[100]等对获得的HPG-7、HLG-1、HLG-2、HLG-3、SCG-1、SCG-2、SCG-3进行相应活性实验,证明在有神经生长因子存在时对大鼠嗜铬细胞瘤细胞系有抑制作用,对PC-12细胞具有抑制活性。
5 结 语
海参作为棘皮动物中经济价值最大的纲,潜藏着巨大的开发利用空间。海参体内含有多种人体所需的营养成分,人类对其在养生、保健、治疗上的应用已有很长的历史。在现有理论及技术的基础上,随着海参中生物活性成分研究的逐步深入,海参在新型药物以及功能性保健食品开发方面的应用受到越来越多的关注。到目前为止,多数学者主要针对海参多糖和皂苷的结构以及生物活性进行了深入研究,已通过体内外实验及临床研究证实海参多糖与海参皂苷对人体具有多种重要的功能,其中对皂苷的研究更为全面。而针对海参中含有的其他成分,以及它们所具有的生理药理活性方面研究尚浅。日后,随着人们保健意识的增强,科研水平的提高,相关研究的深入,海参中所含有的活性成分将更多地为人们所发现,很可能被应用于抗癌、抗肿瘤、抗菌、提高免疫力等新型药物以及功能性保健食品的开发。
[1] 李熙灿. 海参及海参中的化学成分综述[J]. 辽宁中医学院学报, 2004, 6(4): 341-342.
[2] 诸杰. 中医食疗[M]. 北京: 中国商业出版社, 1995: 34.
[3] 赵学敏. 本草纲目拾遗[M]. 北京: 商务印书馆, 1995: 495.
[4] 王士雄, 宋咏梅, 张传友. 随息居饮食谱[M]. 天津: 天津科学技术出版社, 2003:103.
[5] 尹利昂, 陈士国, 薛长湖, 等. 4种海参中含岩藻糖支链的硫酸软骨素化学组成差异的分析[J]. 中国海洋大学学报: 自然科学版, 2009, 39(增刊1): 63-68.
[6] 苏秀榕, 娄永江, 常亚青, 等. 海参的营养成分及海参多糖的抗肿瘤活性的研究[J]. 营养学报, 2003, 25(2): 181-182.
[7] 吴萍茹, 陈粤, 方金瑞, 等. 二色桌片参的化学成分的研究Ⅳ二色桌片参糖蛋白的分离性质与抗肿瘤活性的研究[J]. 中国海洋药物, 2000, 19(5): 4-6.
[8] 王静凤, 张珣, 李辉, 等. 海参岩藻聚糖硫酸酯抗肿瘤转移作用研究[J].中国海洋药物, 2012, 31(2): 14-18.
[9] COLLIN P D. Inhibition of angiogenesis by sea cucumber fraction containing sulfated polysaccharides: U.S., US5985330 A[P]. 1999-11-16.
[10] 王振立, 刘桂敏, 郑瑞, 等. 刺参酸性粘多糖抑制小鼠肿瘤细胞DNA合成及代谢研究[J]. 中国医药工业杂志, 1993, 24(9): 405-408.
[11] MOON J H, RYU H S, YANG H S, et al. Antimutagenic and anticancer effect of glycoprotein and chondroitin sulfatefrom sea cucumber (Stichopus japonicus)[J]. Han guk Sikp um Yongyang Kw ahak Hoechi, 1998, 27(2): 350-358.
[12] LORY K L, DARAH I, IBRAHIM C O. Structural and morphological alterations of Candida albicans cells after treatment with a tratoxin B1from Holothuria atra (Jarger) [J]. Natural Product Sciences, 1998, 4(3): 136-142.
[13] 杨玉红, 王静凤, 张珣, 等. 海参岩藻聚糖硫酸酯对缺氧条件下胃癌HGC-27细胞转移作用的影响[J]. 营养学报, 2013, 35(1): 73-77.
[14] 黄益丽, 郑忠辉, 苏文金, 等. 二色桌片参的化学成分研究 Ⅲ. 二色桌片参多糖-1-岩藻聚糖的免疫调节作用[J]. 海洋通报, 2001, 20(1): 88-91.
[15] NAGASE H, ENJYOJI K, MINAMIIGUCHI K. Deploymerized holothurian glycosminoglycan with novel anticoagulant actions: antithrombin Ⅲ and heparin cofactor Ⅱ-independent inhibitor of factor X activation by factor Ⅷ complex and heparin cofactorⅡ-dependent inhibition of thrombin[J]. Blood, 1995, 85: 1527-1534.
[16] 王学锋, 王鸿利. 玉足海参酸性粘多糖 (抗栓胶囊) 抗血栓形成作用的观察[J]. 中华血液学杂志, 1997, 18(9): 457-459.
[17] 李志广, 王学峰, 王鸿利, 等. 糖胺聚糖对受刺激内皮细胞组织因子和凝血酶调节蛋白表达的影响[J] . 中华血液学杂志, 2000, 21(4): 201-204.
[18] 沈卫章, 周荣富, 王学锋, 等. 玉足海参糖胺聚糖抗血形成的研究[J].中华血液学杂志, 2006, 27(9): 579-583.
[19] 王学锋, 李志广, 储海燕. 海参糖胺聚糖抗血栓形成机制的研究[J].中国新药与临床杂志, 2002, 21(12): 718.
[20] CHEN Shiguo, HU Yaqin, YE Xinqian, et al. Sequence determination and anticoagulant and antithrombotic activities of a novel sulfated fucan isolated from the sea cucumber Isostichopus badionotus[J]. Biochimica et Biophysica Acta, General Subjects, 2012 (7): 989-1000.
[21] LIU H H, KO W C, HU Miaolin. Hypolipidemic effect of glycosaminoglycans from the sea cucumber Metriatyl a scabra in rats fed a cholesterol-supplemented diet[J]. Journal of Agricultural and Food Chemistry, 2002, 50(12): 3602-3606.
[22] LIU Xin, SUN Zhenliang, ZHANG Miansong, et al. Antioxidant and antihyperlipidemic activities of polysaccharides from sea cucumber Apostichopus japonicus[J]. Carbohydrate Polymers, 2012, 90(4): 1664-1670.
[23] NIGRELLI R F, JAKOWSKA S. Effects of holothurin, a steroid saponin from the bahamian sea cucumber (Actinopyga agassizi), on various biological systems[J]. Annals of the New York Academy of Sciences, 1960, 90(3): 884-892.
[24] YAMANOUCHI T. On the poisonous substance contained in holothurians[J]. Publications of the Seto Marine Biological Laboratory, 1955, 4(2/3): 183-203.
[25] ANTONOV A S, AVILOV S A, KALINOVSKY A I, et al. Triterpene glycosides from Antarctic sea cucumbers Ⅲ. Structures of liouvillosides A4and A5, two minor disulphated tetraosides containing 3-O-methylquinovose as terminal monosaccharide units from the sea cucumber Staurocucumis liouvillei (Vaney)[J]. Natural Product Research, 2011, 25(14): 1324-1333.
[26] SILCHENKO A S, AVILOV S A, KALININ V I, et al. Constituents of the sea cucumber Cucumaria okhotensis. structures of okhotosides B1-B3and cytotoxic activities of some glycosides from this species[J]. Journal of Natural Products, 2008, 71(3): 351-356.
[27] ZOU Zhengrong, YI Yanghua, WU Houming, et al. Intercedensides A-C, three new ctotoxic triterpene glycosides from the sea cucumber Mensamaria intercedens Lampert[J]. Journal of Natural Products, 2003, 66(8): 1055-1060.
[28] SILCHENKO A S, AVILOV S A, KALININ V I, et al. Pseudostichoposide B-new triterpene glycoside with unprecedent type of sulfatation from the deep-water North-Pacific sea cucumber Pseudostichopus trachus[J]. Natural Product Research, 2004, 18(6): 565-570.
[29] ZHANG Yongjuan, LU Xuejun, YI Yanghua. A new triterpene glycoside from the sea cucumber Colochirous[J]. Chinese Journal of Marine Drugs, 2005, 24(2): 13-17.
[30] MAIER M S, ROCCATAGLIATA A J, KURISS A, et al. Two new cytotoxic and virucidal trisulfated triterpene glycosides from the Antarctic sea cucumber Staurocucumis liouvillei[J]. Journal of Natural Products, 2001, 64(6): 732-736.
[31] ZHANG Shilong, LI Ling, YI Yanghua, et al. Philinopgenin A, B, and C, three new triterpenoid aglycones from the sea cucumber Pentacta quadrangulasis[J]. Marine Drugs, 2004, 2(4): 185-191.
[32] 张淑瑜, 易杨华, 李玲, 等. 紫伪翼手参中一个新的三萜皂苷[C]//中国海洋生化学术会议论文荟萃集. 上海: 中国生物化学与分子生物学会, 2005: 195-198.
[33] MORAES G, NORTHCOTE P T, SILCHENKO A S, et al. Mollisosides A, B1, and B2: minor triterpene glycosides from the New Zealand and South Australian sea cucumber Australostichopus mollis[J]. Journal of Natural Products, 2005, 68(6): 842-847.
[34] 王晓华, 李玲, 易杨华, 等. 花刺参中两个新的三萜皂苷[J]. 中国天然 药物, 2006, 4(3): 176-180.
[35] SILCHENKO A S, AVILOV S A, KALININ V I, et al. Monosulfated triterpene glycosides from Cucumaria okhotensis Levin et Stepanov, a new species of sea cucumbers from sea of Okhotsk[J]. Russian Journal of Bioorganic Chemistry, 2007, 33(1): 73-82.
[36] SILCHENKO A S, AVILOV S A, ANTONOV A A, et al. Triterpene glycosides from the deep-water North-Pacific sea cucumber Synallac tes nozawai Mitsukuri[J]. Journal of Natural Products, 2002, 65(12): 1802-1808.
[37] IÑIGUEZ-MARTINEZ A M M, GUERRA-RIVAS G, RIOS T, et al. Triterpenoid oligoglycosides from the sea cucumber Stichopus parvimensis[J]. Journal of Natural Products, 2005, 68(11): 1669-1673.
[38] KISA F, YAMADA K, MIYAMOTO T, et al. Constituents of Holothuroidea, 18. Isolation and structure of biologically active disialoand trisialo-gangliosides from the sea cucumber Cucumaria echinata[J]. Chemical and Pharmaceutical Bulletin, 2006, 54(9): 1293-1298.
[39] KISA F, YAMADA K, MIYAMOTO T, et al. Constituents of Holothuroidea, 18. Isolation and structure of biologically active disialoand trisialo-gangliosides from the sea cucumber Cucumaria echinata[J]. Chemical and Pharmaceutical Bulletin, 2006, 54(9): 1293-1298.
[40] 喇明平, 易杨华, 李玲, 等. 叶瓜参中的三个海参皂苷[J]. 中国天然药物, 2008, 6(4): 254-258.
[41] ANTONOV A S, AVILOV S A, KALINOVSKY A I, et al. Triterpene glycosides from Antarctic sea cucumbers. 1. Structure of liouvillosides A1, A2, A3, B1, and B2from the sea cucumber Staurocucumis liouvillei: new procedure for separation of highly polar glycoside fractions and taxonomic revision[J]. Journal of Natural Products, 2008, 71(10): 1677-1685.
[42] MIYAMOTO T, TOGAWA K, HIGUCHI R, et al. Structures of four new triterpenoid oligoglycosides: DS-penaustrosides A, B, C and D from the sea cucumber Pentacta australis[J]. Journal of Natural Products, 1992, 55 (7): 940-946.
[43] TONG Yunguang, ZHANG Xiongwen, TIAN Fang, et al. Philinopside A, a novel marine-derived compound possessing dual anti-angiogenic and anti-tumor effects[J]. International Journal of Cancer, 2005, 114(6): 843-853.
[44] ZOU Zhengrong, YI Yanghua, WU Houming, et al. Intercedenol A and B, two new triterpenoids from the sea cucumber Mensamaria intercedens[J]. Chinese Chemistry Letters, 2004, 15(3): 309-312.
[45] HAN Hua, XU Qiangzhi, YI Yanghua, et al. Two new cytotoxic disulfated holostane glycosides from the sea cucumber Pentacta quadrangularis[J]. Chemistry & Biodiversity, 2010, 7(1): 158-167.
[46] 张淑瑜, 汤海峰, 易杨华, 等. 棕环海参化学成分的研究[J]. 中国海洋药物, 2006, 25(6): 7-13.
[47] ZHAO Qin, LIU Zhidong, XUE Yong, et al. Ds-echinoside A, a new triterpene glycoside derived from sea cucumber, exhibits antimetastatic activity via the inhibition of NF-κB-dependent MMP-9 and VEGF expressions[J]. Journal of Zhejiang University Science B, 2011, 12(7): 534-544.
[48] 巫军, 易杨华, 吴厚铭, 等. 梅花参化学成分研究(Ⅰ)[J]. 中国天然药物, 2005(1): 38-41.
[49] SUN Peng, YI Yanghua, LI Ling, et al. 17-Dehydroxyholothurin A, a new sulfated triterpene glycoside from sea cucumber Holothuria impatiens[J]. Chinese Chemistry Letters, 2006, 17(11): 1454-1456.
[50] ANTONOV A S, AVILOV S A, KALINOVSKY A I, et al. Triterpene glycosides from Antarctic sea cucumbers. 2. Structure of Achlioniceosides A1, A2, and A3from the sea cucumber Achlionice violaecuspidata (Rhipidothuria racowitzai)[J]. Journal of Natural Products, 2008, 72(1): 33-38.
[51] 巫军, 易杨华, 邹峥嵘, 等. 黑乳海参中两个新的三萜皂苷[J]. 中草药, 2006, 37(4): 497-500.
[52] HAN Hua, YI Yanghua, LI Ling, et al. A new triterpene glycoside from sea cucumber Holothuria leucospilota[J] . Chinese Chemistry Letters, 2007, 18(2): 161-164.
[53] SILCHENKO A S, Kalinovsky A I, Avilov S A, et al. Triterpene glycosides from the sea cucumber Eupentacta fraudatrix. Structure and biological action of cucumariosides A1, A3, A4, A5, A6, A12and A15, seven new minor non-sulfated tetraosides and unprecedented 25-keto, 27-norholostane aglycone[J]. Natural Product Communications, 2012, 7(4): 517-525.
[54] HAN Hua, YI Yanghua, LIU Baoshu, et al. Leucospilotaside C, a new sulfated triterpene glycoside from sea cucumber Holothuria leucospilota[J]. Chinese Chemistry Letters, 2008, 19(12): 1462-1464.
[55] 翁怡毅, 易杨华, 李玲, 等. 沙海参中的三个海参皂苷[J]. 中国天然药物, 2007, 5(2): 96-100.
[56] YUAN Weihua, YI Yanghua, TANG Haifeng, et al. Two new holostan-type triterpene glycosides from the sea cucumber Bohadschia marmorata Jaeger[J]. Chemical and Pharmaceutical Bulletin, 2008, 56(8): 1207-1211.
[57] YUAN Weihua, YI Yanghua, XUE Mei, et al. Two antifungal active triterpene glycosides from sea cucumber Holothuria (Microthele) axiloga[J]. Chinese Journal of Natural Medicines, 2008, 6(2): 105-108.
[58] HAN Hua, YI Yanghua, XU Qiangzhi, et al. Two new cytotoxic triterpene glycosides from the sea cucumber Holothuria scabra[J]. Planta Medica, 2009, 75: 1608-1612.
[59] CAREAGA V P, MUNIA IN C, MAIER M S. Patagonicosides B and C, two antifungal sulfated triterpene glycosides from the sea cucumber Ps olus patag onicus[J]. Chemistry & Biodiversity, 2011, 8(3): 467-475.
[60] ZHANG Shuyu, YI Yanghua, TANG Haifeng. Bioactive triterpene glycosides from the sea cucumber Holothuria fuscocinerea[J]. Journal of Natural Products, 2006, 69(10): 1492-1495.
[61] 孙国权. 灰海参生物活性成分研究[D]. 上海: 第二军医大学, 2008.
[62] HAN Hua, YI Yanghua, LI Ling, et al. A new triterpene glycoside from sea cucumber Holothuria leucospilota[J]. Chinese Chemistry Letters, 2007, 18(2): 161-164.
[63] WU Jun, YI Yanghua, TANG Haifeng, et al. Nobilisides A-C, three new triterpene glycosides from the sea cucumber Holothuria nobilis[J]. Planta Medica, 2006, 72(10): 932-935.
[64] SILCHENKO A S, STONIK V A, AVILOV S A, et al. Holothurins B2, B3, and B4, new triterpene glycosides from mediterranean sea cucumbers of the genus Holothuria[J]. Journal of N atural Products, 2005, 68(4): 564-567.
[65] YUAN Weihua, YI Yanghua, LI Ling, et al. Two triterpene glycosides from the sea cucumber Bohadschia marmorata Jaeger[J]. Chinese Chemistry Letters, 2008, 19(4): 457-460.
[66] 张佳佳. 黑乳海参三萜皂苷的提取分离及其结构鉴定[J]. 中草药, 2011, 42(8): 1467-1472.
[67] ANA P M, CLAUDIA M, ALICIA M, et al. Patagonicoside A: a novel antifungal disulfated triterpene glycoside from the sea cucumber Psolus patagonicus[J]. Tetrahedron, 2001, 33(12): 9563-9568.
[68] H AN H, LI L, YI Y H, et al. Triterpene glycosides from sea cucumber Holothuria scabra with cytotoxic activity[J]. Chinese Herbal Medicines, 2012, 4(3): 183-188.
[69] 闫冰. 糙海参生物活性成分研究[D]. 上海: 第二军医大学, 2005.
[70] AVILOV S A, KALININ V A, MAKARIEVA T N, et al. Structure of cucumarioside G2, a novel nonholostane glycoside from the sea cucumber Eupentacta fraudatrx[J]. Journal of Natural Products, 1994, 57(8): 1166-1171.
[71] AFIYATULLOV S S, KALINOVSKY A I, KUZNETSOVA T A, et al. New diterpene glycosides of the fungus Acremonium striatisporum isolated from a sea cucumber[J]. Journal of Natural Products, 2002, 65(5): 641-644.
[72] AFIYATULLOV S S, KALINOVSKY A I, PIVKIN M V, et al. New diterpene glycosides of the fungus Acremonium striatisporum isolated from a sea cucumber[J]. Natural Product Research, 2006, 20(10): 902-908.
[73] AMININ D L, PINEGIN B V, PIC HUGINA L V, et al. Immunomodulatory properties of Cumaside[J]. International Immunopharmacology, 2006, 6(7): 1070-1082.
[74] AMININ D L, AGAFONOVA I G, KALININ V I, et al. Immunomodulatory propertie s of frondoside A, a major triterpene glycoside from the North Atlantic commercially harvested sea cucumber Cucumaria frondosa[J]. Journal of Medici nal Food, 2008, 11(3): 443-453.
[75] 王静凤, 傅佳, 王玉明, 等. 革皮氏海参皂苷对小鼠免疫功能的调节作用[J]. 中国海洋大学学报: 自然科学版, 2010, 40(2): 28-32.
[76] TIAN Fang, ZHANG Xiongwen, TONG Yunguang, et al. PE, a new sulfated saponin from sea cucumber, exhibits anti-angiogenic and antitumor activities in vitro and in vivo[J]. Cancer Biology & Therapy, 2005, 4(8): 874-882.
[77] 刘治东. 革皮氏海参皂苷抗肿瘤活性及其作用机制的研究[D]. 青岛: 中国海洋大学, 2009.
[78] 尹一恒, 章翔, 程光, 等. 海参皂苷抑制人脑胶质母细胞瘤U251细胞生长实验研究[J]. 中华神经外科疾病研究杂志, 2009, 8(1): 19-22.
[79] 樊廷俊, 袁文鹏, 丛日山, 等. 仿刺参水溶性海参皂苷的分离纯化及其抑瘤活性 研究[J]. 药学学报, 2009, 44(1): 25-31.
[80] ZHAO Qin, XUE Yong, LIU Zhidong, et al. Differential effects of sulfated triterpene glycosides, holothurin A1, and 24-dehydroechinoside A, on antimetastasic activity via regulation of the MMP-9 signal pathway[J]. Journal of Food Science, 2010, 75(9): 280-288.
[81] AL MARZOUQI N, IRATNI R, NEMMAR A, et al. Frondoside A inhibits human breast cancer cell survival, migrati on, invasion and the growth of breast tumor xenografts[J]. European Journal of Pharmacology, 2011, 668(1): 25-34.
[82] 丛日山, 袁文鹏, 樊廷俊, 等. 仿刺参水溶性海参皂苷的分离制备及抗真菌活性的研究[J]. 中国海洋大学学报, 2006, 36(6): 959-964.
[83] 袁文鹏, 丛日山, 杨秀霞, 等. 水溶性海参皂苷的分离纯化及其抗真菌活性研究[J]. 山东大学学报: 理学版, 2007, 42(5): 69-73.
[84] YUAN Weihua, YI Yanghua, TANG Haifeng, et al. Antifungal triterpene glycosides from the sea cucumber Bohadschia marmorata[J]. Planta Medica, 2008, 75(2): 168-173.
[85] 韩华, 易杨华, 喇明平, 等. 糙海参皂苷Seabraside A、B的抗真菌和抗肿瘤活性[J]. 中国药理学通报, 2008, 24(8): 1111-1112.
[86] WANG Zenglei, ZHANG Hongwei, YUAN Waihua, et al. Antifungal nortriterpene and triterpene glycosides from the sea cucumber Apostichopus japonicas Selenka[J]. Food Chemistry, 2012, 132(1): 295-300.
[87] HU Xiaoqian, WANG Yuming, WANG Jingfeng, et al. Dietary saponins of sea cucumber alleviate orotic acid-induced fatty liver in rats via PPARα and SREBP-1c signaling[J/OL]. Lipids in Health and Disease, http://www.lipidworld.com/content/9/1/25.
[88] 李冰. 革皮氏海参总皂苷促进小鼠骨髓造血机能的作用及其机制的研究[D]. 青岛: 中国海洋大学, 2011.
[89] 华会明, 裴月湖. 神经鞘苷的研究概况[J]. 沈阳药科大学学报, 2001, 18(4): 299-306.
[90] THUDICHUM J L W. Reports of the medical officer of privy council and local government board[M]. Great Britain: Nabu Press, 1876: 117.
[91] YAMADA K, SASAKI K, HARADA Y, et a l. Constituents of holothuroidea, 12. Isolation and structure of glucocerebrosides from the sea cucumber Holothuria pervicax[J]. Chemical and Pharmaceutical Bulletin, 2002, 50(11): 1467-1470.
[92] KISA F, YAMADA K, KANEKO M, et al. Constituents of holothuroidea, 14. Isolation and structure of new glucocerebroside molecular species from the sea cucumber Stichopus japonicus[J]. Chemical and Pharmaceutical Bulletin, 2005, 53(4): 382-386.
[93] IKEDA Y, INAGAKI M, YAMADA K, et al. Isolation and structure of a galactocerebroside from the sea cucumber Bohadschia argus[J]. Chemical and Pharmaceutical Bulletin, 2009, 57(3): 315-317.
[94] XU Jie, WANG Yuming, FENG Tingyu, et al. Isolation and anti-fatty liver activity of a novel cerebroside from the sea cucumber Acaudina molpadioides[J]. Bioscience, Biotechnology, and Biochemistry, 2011, 75(8): 1466-1471.
[95] DU Lei, LI Zhaojie, XU Jie, et al. The anti-tumor activities of cerebrosides derived from sea cucumber Acaudina molpadioides and starfish Asterias amurensis in vitro and in vivo[J]. Journal of Oleo Science, 2012, 61(6): 321-330.
[96] KLENK E. Über die Ganglioside, eine neue Gruppe von zuckerhaltigen Gehirnlipoiden[J]. Hoppe-Sey ler’s Zeitschrift für physiologische Chemie, 1942, 273(1/2): 76-86.
[97] YAMADA K, HARADA Y, MIYAMOTO T, et al. Constituents of holothuroidea. 9. Isolation and structure of a new ganglioside molecular species from the sea cucumber Holothuria pervicax[J]. Chemical and Pharmaceutical Bulletin, 2000, 48(1): 157-159.
[98] YAMADA K, HAMADA A, KISA F, et al. Constituents of holothuroidea. 10. Isolation and structure of a biologically active ganglioside molecular species from the sea cucumber Holothuria leucospilota[J]. Chemical and Pharmaceutical Bulletin, 2001, 49(4): 447-452.
[99] YAMADA K, HAMADA A, KISA F, et al. Constitu ents of holothuroidea, 13. Structure of neuritogenic active ganglioside molecular species from the sea cucumber Stichopus chloronotus[J]. Chemical and Pharmaceutical Bulletin, 2003, 51(1): 46-52.
[100] KISA F, YAMADA K, MIYAMOTO T, et al. Constituents of holothuroidea, 18. Isolation and structure of biologically active disialo-and trisialogangliosides from the sea cucumber Cucumaria echinata[J]. Chemical and Pharmaceutical Bulletin, 2006, 54(9): 1293-1298.
[101] KISA F, YAMADA K, MIYAMOTO T, et al. Constituents of holothuroidea, 17. Isolation and structure of biologically active monosialo-gangliosides from the sea cucumber Cucumaria echinata[J]. Chemical and Pharmaceutical Bulletin, 2006, 54(7): 982-987.
Progress in Research on Main Bioactive Constituents of Sea Cu cumber
GUO Ying-ying1, DING Yan1,2,*, XU Fei-fei1, LIU Bao-yue1, KOU Zi-nong2,3, ZHU Jing-bo1,2,*
(1. College of Food Science, Dalian Polytechnic University, Dalian 116034, China; 2. Institute of Chemistry and Applications of Plant Resources, Dalian Polytechnic University, Dalian 116034, China; 3. Instrumental Analysis Center, Dalia n Polytechnic University, Dalian 116034, China)
Sea cucumber is a kind of dietary delicacy and is also an important ingredient in Asian traditional medicine s over many centuries. It contains many bioactive components, such as polysaccharide, sea cucumber saponins, cerebroside and ganglioside. Sea cucumber possesses anti-tumor, anti-cancer, immuno-enhancing and antibacterial activities. The objective of this paper is to summarize the molecular structures and biological activities of main bioactive components in sea cucumber and to propose a scientific basis for reasonable application of sea cucumber resources.
sea cucumber; molecular structures; biological activity
TS254.1
A
1002-6630(2014)15-0335-10
10.7506/spkx1002-6630-201415066
2013-10-08
辽宁省博士科研启动基金项目(20121097);辽宁省教育厅科学技术研究一般项目(L2012183)
郭盈莹(1990—),女,硕士研究生,研究方向为天然产物化学。E-mail:huo657787@163.com
*通信作者:丁燕(1980—),女,讲师,博士,研究方向为天然产物化学与功能性。E-mail:dingyan_515@hotmail.com
朱靖博(1963—),男,教授,博士,研究方向为天然产物化学与功能性。E-mail:zhujingb@sina.com
