邻苯二甲酸二丁酯高效降解菌H-2的分离鉴定及其降解特性
2014-03-08严忠雍郭远明顾蓓乔
金 雷,陈 瑜,严忠雍,郭远明,祝 银,龙 举,顾蓓乔,*
(1.浙江省海洋水产研究所,浙江 舟山 316100;2.浙江省海水增养殖重点实验室,浙江 舟山 316100)
邻苯二甲酸二丁酯高效降解菌H-2的分离鉴定及其降解特性
金 雷1,2,陈 瑜1,严忠雍1,郭远明1,祝 银1,龙 举1,顾蓓乔1,*
(1.浙江省海洋水产研究所,浙江 舟山 316100;2.浙江省海水增养殖重点实验室,浙江 舟山 316100)
为了获得高效广谱的邻苯二甲酸二丁酯(di-n-butyl phthalate,DBP)降解菌,本研究从长期受食品塑料垃圾污染的土壤中通过富集培养和分离纯化,获得一株DBP高效降解菌,命名为H-2。根据菌株的形态、生理生化特征和16S rRNA序列分析,将其鉴定为类芽孢杆菌属(Paenibacillus sp.)。运用高效液相色谱法分析了菌株H-2对DBP的降解特性及对邻苯二甲酸酯类化合物的广谱性降解情况。结果表明:菌株H-2降解DBP的最适温度为30 ℃,最适pH值为7.0;在此最适条件下,菌株H-2在3 d内对100 mg/L DBP的降解率高达87.6%。菌株H-2能高效降解短链邻苯二甲酸二甲酯、邻苯二甲酸二乙酯和DBP,而对长链邻苯二甲酸二辛酯的降解效果较差。
邻苯二甲酸二丁酯;类芽孢杆菌属;降解特性;降解谱
邻苯二甲酸酯(phthalic acid esters,PAEs)是一类被广泛使用的有机化合物,在食品领域常用于食品塑料包装袋、塑料保鲜膜、盛装食物的塑胶容器等的合成[1]。塑料是食品包装的主要材料,常常与食品直接接触,由于PAEs在加工、加热、包装、盛装的过程中很容易溶出而渗入食物中,严重威胁着食品安全[2-3]。已有研究表明,PAEs即使在较低的浓度下,对人的内分泌系统和生殖系统也会造成较大的影响[4]。另有研究表明,PAEs对植物也有毒害作用[5]。因此,美国环保局、中国环监站以及欧盟都将邻苯二甲酸酯类化合物列为优先控制污染物[6-7]。邻苯二甲酸二丁酯(di-n-butyl phthalate,DBP)是PAEs中重要的一种。研究表明,DBP的降解主要有生物降解和非生物降解两种,而微生物降解是其降解的主要途径[8-9]。目前国内外有关DBP降解的微生物菌株包括:Delfia sp.[3]、Sphingomonsa sp.[10]、Arthrobacter sp.[11-12]、Gordonia sp.[13]、Rhodococcus sp.[14]、Acinetobacter calcoaceticus[15]和Pseudomonas aeruginosa[15]等。但已报道的菌株能高效降解DBP且能降解多种邻苯二甲酸酯类化合物的还较少,因此筛选高效广谱的DBP降解菌非常必要。
本实验从长期受食品塑料垃圾污染的土壤中分离到1 株DBP高效降解菌株H-2,经鉴定为类芽孢杆菌属(Paenibacillus sp.)。目前,国内外鲜有见类芽孢杆菌降解DBP的报道。该菌株能高效降解DBP,3 d内对质量浓度为100 mg/L DBP的降解率高达87.6%。本实验还对菌株的降解特性和广谱性进行了初步研究,以期为进一步探明DBP的降解机理及将其应用于消除食品塑料垃圾的PAEs残留污染提供一定理论依据。
1 材料与方法
1.1 材料、培养基与试剂
浙江省舟山市普陀区某长期堆放食品塑料垃圾的污染土壤。
无机盐培养基(g/L):KH2PO43.0、K2HPO4·3H2O 1.5、NH4NO32.0、MgSO4·7H2O 0.1、CaCl20.01、乙二胺四乙酸二钠0.01,pH 7.5,121 ℃灭菌30 min。
LB培养基(g/L):酵母浸粉5.0、蛋白胨10.0、NaCl 10.0,pH 7.0,固体培养基加20 g/L琼脂,121 ℃灭菌30 min。
二氯甲烷(分析纯)、甲醇溶液(色谱纯)、无水硫酸钠 上海试剂总厂;邻苯二甲酸二甲酯(dimethyl phthalate,DMP,分析纯)、邻苯二甲酸二乙酯(diethyl phthalate,DEP,分析纯)、邻苯二甲酸二丁酯(di-nbutyl phthalate,DBP,分析纯)、邻苯二甲酸二辛酯(dioctyl phthalate,DOP,分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
T6新世纪紫外-可见分光光度计 北京普析通用仪器有限公司;Waters e2695/Waters 2489 UV型高效液相色谱 美国Waters公司。
1.3 方法
1.3.1 降解菌株的分离筛选与纯化
称取土样5 g,置于装有100 mL无机盐液体培养基(含DBP 20 mg/L)的250 mL三角瓶中,160 r/min、30 ℃摇床培养7 d。之后以10%的接种量每隔7 d转接1 次,并逐渐提高培养基中DBP的质量浓度至100 mg/L。连续转接3 次后验证降解效果,取0.2 mL具有降解能力的富集液涂布在固体无机盐培养基(含DBP 100 mg/L)平板上,30 ℃恒温培养。将平板上生长出的单菌落转接至无机盐液体培养基(含DBP 100 mg/L)试管中,160 r/min、30 ℃摇床培养,验证单菌的降解效果。
1.3.2 菌株的生理生化鉴定
菌株形态及生理生化特性鉴定参见东秀珠等[16]的方法。
1.3.3 16S rRNA基因序列的聚合酶链式反应(polymerase chain reaction,PCR)扩增及测序
首先提取H-2的基因组DNA作为为模板,然后在PCR仪上进行16S rRNA基因的扩增[17],所用引物、扩增体系及PCR的反应条件参照倪俊等[18]方法。PCR产物通过琼脂糖凝胶电泳检测扩增片段的大小(1.5 kb左右),采用PCR回收试剂盒回收16S rRNA的基因片段,T/A克隆后进行测序[19]。测序工作由上海英潍捷基公司完成,将扩得的长度为1 424 bp的序列与GenBank数据库中的16S rRNA基因序列进行相似性分析,构建系统发育树[20]。
1.3.4 溶液中DBP的检测
采用高效液相色谱(high performance liquid chromatography,HPLC)法,将待测溶液加入等体积的二氯甲烷,剧烈振荡后放入摇床,160 r/min振荡30 min。室温下静置分层后弃上层水相,有机相过无水硫酸钠柱,取1.0 mL置于离心管中,氮气吹干,加入1.0 mL甲醇(色谱纯)溶解,再用孔径为0.22 μm的有机相过滤器过滤,利用HPLC测定液体中DBP的含量。
HPLC条件:色谱柱:Thermo syncronis-C18(250 mm×4.6 mm,5 μm);流动相:甲醇-水(90:10,V/V);检测器波长:230 nm;流速:1.0 mL/min;进样量:10 μL。
1.3.5 菌株降解特性的研究
1.3.5.1 种子液的制备
将LB固体培养基上的单菌落转接至LB液体培养基试管中,160 r/min、30 ℃摇床培养2 d后离心收集菌体,用无机盐液体培养基重悬,并调整菌液浓度约为OD600nm=1.0,即为种子液。
1.3.5.2 菌株对DBP的生长与降解曲线
以2%的接种量将上述种子液接种到100 mL无机盐液体培养基(含DBP 100 mg/L)中,以接种灭活的菌株H-2为对照,160 r/min、30 ℃摇床培养。每12 h定时取样测定OD600nm值,并用高效液相色谱法检测溶液中DBP的含量。所有实验数据均为3 次重复的平均值,数据采用Excel软件进行分析处理。降解率的计算见下式。
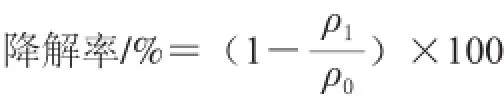
式中:ρ1为降解菌处理后DBP质量浓度/(mg/L);ρ0为对照处理后DBP质量浓度/(mg/L)。
1.3.5.3 不同因子对菌株降解DBP的影响
按上述研究方法,设定不同的培养温度和初始pH值,3 d定时取样测定菌株的生长量及DBP的降解情况,以此考察其对菌株H-2生长及降解能力的影响。
1.3.5.4 菌株对不同邻苯二甲酸酯的降解情况
在无机盐培养基中分别添加100 mg/L的DMP、DEP、DBP和DOP为唯一碳源,按上述研究方法测定菌株对不同邻苯二甲酸酯的降解情况。
2 结果与分析
2.1 菌株H-2的分离、形态学及生理生化特征
通过富集驯化,分离纯化获得一株能以邻苯二甲酸二丁酯为唯一碳源生长的DBP高效降解菌株,将其命名为H-2,该菌株革兰氏染色显阳性,菌落形态和电镜照片如图1所示。菌株H-2在LB固体平板上生长36 h后,菌落呈浅黄色,大小为2~3 mm,圆形,表面光滑,边缘整齐,不透明;电子显微镜下观察,菌株呈杆状,大小为(3.2~3.3) μm×(0.7~0.8) μm,两端端生鞭毛,无荚膜,产芽孢。

图1 菌株H-2的菌落形态(a)和电镜照片(b)(标尺为1 μm)Fig.1 Colony morphology (a) and electronic micrograph (b) (Bar, 1 μmm) of strain H-2
生理生化实验研究表明,菌株H-2对接触酶、氧化酶、淀粉水解、V-P反应和硝酸盐还原为阳性;酪氨酸水解、脲酶、硫化氢反应、吲哚反应、柠檬酸盐利用为阴性;对四环素、链霉素及卡那霉素抗性。
2.2 菌株16S rRNA的相似性分析

图2 菌株H-2的16S rRNA电泳图谱Fig.2 Electrophoresis pattern of 16S rRNA from strain H-2
提取H-2的基因组DNA进行PCR扩增,扩增后进行琼脂糖凝胶电泳,结果如图2所示。产物经回收、T/A克隆后送至上海英潍捷基公司进行测序,测得16S rRNA基因片段的长度为1 424 bp,将此序列在GenBank上登录(登录号为KF495601)。同时在美国国立生物技术信息中心网站(National Center of Biotechnology Information,NCBI)上进行基因同源性比对,结果显示H-2菌株与Paenibacillus chibensis JCM 9905T(NO.AB073194)的16S rRNA基因序列的相似性为100%。通过个体形态学、生理生化,再结合菌株H-2的16S rRNA基因的同源性分析,最终将H-2鉴定为类芽孢杆菌属(Paenibacillus sp.),图3为菌株H-2的系统发育树。)
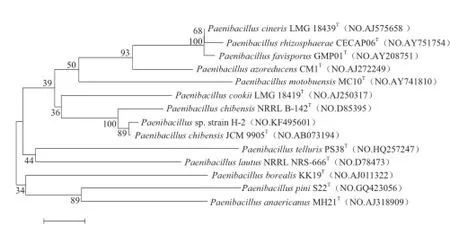
图3 菌株H-2的系统发育树Fig.3 Phylogenetic tree of strain H-2
2.3 菌株H-2降解特性的研究
2.3.1 菌株H-2的生长与对DBP降解曲线
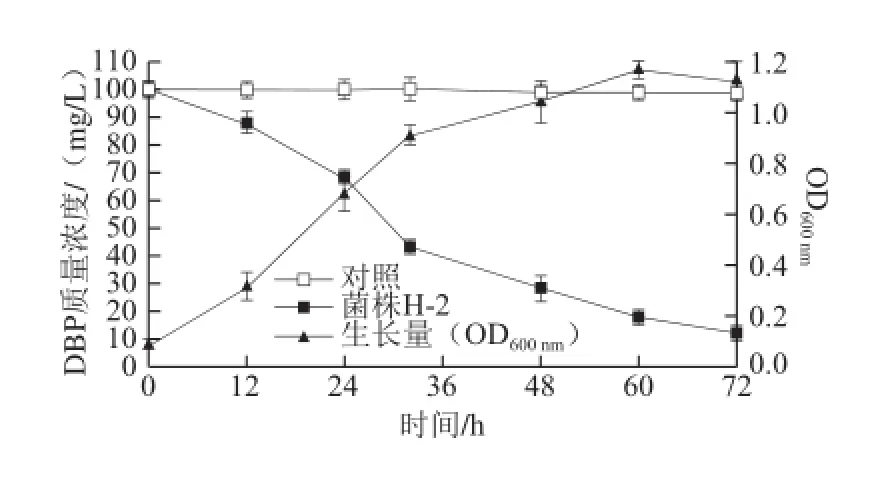
图4 菌株H-2利用邻苯二甲酸二丁酯的生长和降解曲线Fig.4 The growth curve and DBP degradation curves of strain H-2
将菌株H-2的种子液以2%的接种量接种到无机盐液体培养基(含DBP 100 mg/L)中,每12 h定时取样一次测定OD600nm值和DBP的残留量,连续取样3 d,设接种灭活的H-2为对照。由图4可知,菌株H-2能利用DBP为唯一碳源生长,菌株的降解能力与生长量呈一定的正相关,在培养初期降解较缓慢,但在12 h以后随着菌体浓度的增大DBP开始快速降解,3 d内对质量浓度为100 mg/L DBP的降解率高达87.6%。
2.3.2 培养温度对菌株H-2降解DBP的影响

图5 温度对菌株H-2降解邻苯二甲酸二丁酯的影响Fig.5 Effect of temperature on DBP degradation by strain H-2
以2%接种量将菌株H-2的种子液接种至pH 7.0的无机盐液体培养基(含DBP 100 mg/L)中,分别放置于温度为10、20、30、37、40、50 ℃,160 r/min的摇床中培养,3 d后定时取样测定OD600nm值和DBP的残留量。由图5可知,温度在20~40 ℃时菌株H-2的生长和对DBP的降解效果较好,而10 ℃的低温和50 ℃的高温抑制了菌株的生长,进而影响了菌株对DBP的降解,结果表明菌株H-2对DBP的最适降解温度为30 ℃。
2.3.3 初始pH值对菌株H-2降解DBP的影响

图6 pH值对菌株H-2降解邻苯二甲酸二丁酯的影响Fig.6 Effect of pH on DBP degradation by strain H-2
菌株H-2的种子液以2%的接种量接种于无机盐液体培养基(含DBP 100 mg/L)中,将培养基的pH值分别调为4.0、5.0、6.0、7.0、8.0、9.0、10.0,于160 r/min、30 ℃培养,3 d后定时取样测定OD600nm值和DBP的残留量。由图6可知,菌株H-2在pH 6.0~8.0之间表现出良好的生长和降解效果,而在较低pH值(4.0、5.0)和较高pH值(9.0、10.0)条件下其生长和对DBP的降解受到抑制,研究结果表明菌株对DBP的最适降解pH值为7.0。
2.3.4 菌株H-2的降解谱
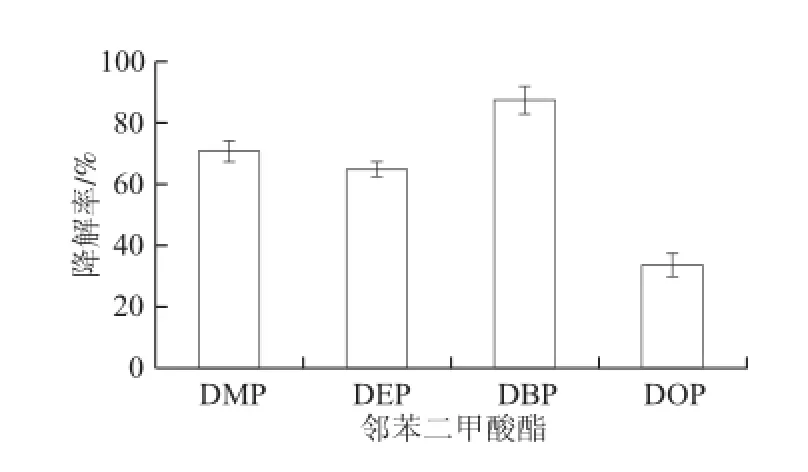
图7 菌株H-2对不同邻苯二甲酸酯的降解Fig.7 Degradation rates of different PAEs by strain H-2
将洗涤的菌株H-2的种子液以2%的接种量接种到无机盐液体培养基中,分别以100 mg/L的DMP、DEP、DBP和DOP为唯一碳源,160 r/min、30 ℃摇床培养3 d,测定菌株H-2对这些邻苯二甲酸酯的降解情况。由图7可知,菌株H-2对短链邻苯二甲酸酯(DMP、DEP和DBP)的降解效果较好,而对长链的DOP的降解效果较差。
3 结论与讨论
类芽孢杆菌属(Paenibacillus sp.)是由Ash等[21]在1993年从芽孢杆菌属中分离出来建立的新属。该类细菌具有生长快、营养简单、能够形成较强抗逆力芽孢、活菌数量高、性能稳定等优势,而备受国内外学者的关注。近年来有不少类芽孢杆菌属降解菌的报道:刘海燕等[22]分离到一株能降解微囊藻毒素的类芽孢杆菌;任明[23]和安霞[24]等分别获得一株能高效降解氯氰菊酯的类芽孢杆菌。因此类芽孢杆菌在有机污染物的生物降解中占有重要的地位。本实验从长期受食品塑料垃圾污染的土壤中分离到一株DBP高效降解菌株H-2,通过个体形态学、生理生化,再结合菌株H-2的16S rRNA基因的同源性分析,将其鉴定为类芽孢杆菌属(Paenibacillus sp.)。目前,有关类芽孢杆菌属菌株降解DBP还鲜有报道。菌株H-2降解DBP的最适温度为30 ℃,最适pH值为7.0;在最适条件下,H-2在3 d内对质量浓度为100 mg/L DBP的降解率高达87.6%。此外,H-2能高效降解DMP和DEP。研究表明,H-2是一株性能良好的DBP高效降解菌,在消除食品塑料垃圾的PAEs残留污染方面具有独特的应用潜力。
[1] 刘明华. 塑化剂的危害与预防分析[J]. 绿色科技, 2013(4): 210-212.
[2] LATINI G. Potential hazards of exposure to di-(2-ethylhexyl)phthalate in babies[J]. Biology of the Neonate, 2000, 78(4): 269-276.
[3] 刘洋, 马保华, 王兆梅, 等. 食品塑料包装中邻苯二甲酸酯类增塑剂的调查分析[J]. 现代食品科技, 2013, 29(1): 181-185.
[4] WU Xueling, WANG Yangyang, LIANG Renxing, et al. Biodegradation of an endocrine-disrupting chemical di-n-butyl phthalate by newly isolated Agrobacterium sp. and the biochemical pathway[J]. Process Biochemisty, 2011, 46(5): 1090-1094.
[5] YIN Rui, LIN Xiangui, WANG Shuguang, et al. Effect of DBP/ DEHP in vegetable planted soil on the quality of capsicum fruit[J]. Chemosphere, 2003, 50(6): 801-805.
[6] CHEN Ji’an, LIU Huijie, QIU Zhiqun, et al. Analysis of di-nbutyl phthalate and other organic pollutants in Chongqing women undergoing parturition[J]. Environmental Pollution, 2008, 156(3): 849-853.
[7] NEELAKANTESHWAR K P, RAJESH K, YOGESH S, et al. Degradation of plasticizer di-n-butyl phthalate by Delftia sp. TBKNP-05[J]. Current Microbiology, 2006, 52(5): 369-374.
[8] STAPLES CHALES A, PETERSON DENNIS R, PARKERTON THOMAS F, et al. The environmental fate of phthalate esters: a literature review[J]. Chemosphere, 1997, 35(4): 667-749.
[9] 曾锋, 傅家谟, 盛国英. 邻苯二甲酸酯类有机污染物生物降解性研究进展[J]. 环境科学进展, 1999, 7(4): 1-13.
[10] 周洪波, 胡培磊, 刘飞飞, 等. DBP降解菌株XJ1的分离鉴定及其降解特性[J]. 生物技术, 2008, 18(2): 64-67.
[11] 吴学玲, 金德才, 赵维良, 等. 4株邻苯二甲酸二丁酯降解菌的分离鉴定及其相关降解基因的克隆[J]. 环境科学, 2009, 30(9): 2722-2727.
[12] WANG Yangyang, MIAO Bo, HOU Dongmei, et al. Biodegradation of di-n-butylphthalate and expression of the 3,4-phthalate dioxygenase gene in Arthrobacter sp. ZH2strain[J]. Process Biochemisty, 2012, 47(6): 936-940.
[13] WU Xueling, WANG Yangyang, DAI Qinyun, et al. Isolation and characterization of four di-n-butyl phthalate (DBP)-degrading Gordonia sp. strains and cloning the 3,4-phthalate dioxygenase gene[J]. World Journal of Microbiology and Biotechnology, 2011, 27(11): 2611-2617.
[14] 金德才, 梁任星, 王洋洋, 等. 一株DBP高效降解菌的筛选及其降解特性[J]. 中南大学学报: 自然科学版, 2010, 41(1): 8-14.
[15] 段星春, 易筱筠, 杨晓为, 等. 两株邻苯二甲酸二丁酯降解菌的分离鉴定及降解特性的研究[J]. 农业环境科学学报, 2007, 26(5): 1937-1941.
[16] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 364-398.
[17] 萨姆布鲁克J, 弗里奇E F, 曼尼阿蒂斯T. 分子克隆实验指南[M]. 2版.北京: 科学出版社, 1995: 5-57; 870-898.
[18] 倪俊, 沈维亮, 闫新, 等. 乙草胺降解菌Y-4的分离鉴定及降解特性研究[J]. 农业环境科学学报, 2011, 30(5): 946-951.
[19] 奥斯伯 F, 布伦特 R, 金斯顿 R E, 等. 精编分子生物学实验指南[M].北京: 科学出版社, 1999: 39-40.
[20] WILLIAM D H, BATBARA A M. Bacterial diversity in Adiondack mountain lakes as revealed by 16S rRNA gene sequences[J]. Applied Environmental Microbiology, 1997, 63(7): 2957-2960.
[21] ASH C, PRIEST F G, COLLINS M D. Molecular identification of rRNA group 3 bacilli using a PCR probe test[J]. Antonie van Leeuwenhoek, 1993, 64(3/4): 253-260.
[22] 刘海燕, 宦海琳, 汪育文, 等. 微囊藻毒素降解菌S3的分子鉴定及其降解毒素的研究[J]. 环境科学学报, 2007, 27(7): 1145-1150.
[23] 任明, 赵蕾. 一株韭菜内生高效氯氰菊酯降解生防细菌的分离与鉴定[J]. 西北农业学报, 2010, 19(3): 57-61.
[24] 安霞, 赵蕾. 一株农药降解生防细菌的分离与鉴定[J]. 微生物学通报, 2009, 36(12): 1838-1841.
Isolation and Identification of a Di-n-butyl phthalate (DBP)-Degrading Strain H-2 and Its Degradation Characteristics
JIN Lei1,2, CHEN Yu1, YAN Zhong-yong1, GUO Yuan-ming1, ZHU Yin1, LONG Ju1, GU Bei-qiao1,*
(1. Marine Fishery Research Institute of Zhejiang Province, Zhoushan 316100, China; 2. Zhejiang Province Key Laboratory of Mariculture and Enhancement, Zhoushan 316100, China)
A broad-spectrum and efficient di-n-butyl phthalate (DBP)-degrading bacterial strain H-2 was isolated from plastic food packaging garbage-contaminated soil by enrichment culture and purification. Based on its morphological, physiobiochemical characteristicsand 16S rRNA gene sequence, strain H-2 was identified as Paenibacillus sp. By high performance liquid chromatography (HPLC), its DBP degrading characteristics and diversity of de gradable substrates were studied. The results showed that the optimal temperature and pH for DBP degradation by strain H-2 was 30 ℃ and 7.0, respectively. Under these conditions, H-2 degraded more than 87.6% of 100 mg/L DBP within 3 d. The diversity of degradable substrates showed that strain H-2 could degrade phthalate (DMP), DEP and DBP efficiently, while DOP was degraded difficultly by strain H-2. This research may provide the theoretical basis to decontaminate PAEs pollution of plastic food packaging garbage.
di-n-butyl phthalate; Paenibacillus sp.; degradation characteristics; degradation spectrum
Q939.96
A
1002-6630(2014)15-0202-05
10.7506/spkx1002-6630-201415041
2013-08-01
浙江省科技计划项目(2012F20026);2012年度浙江省重大科技专项计划项目(2012C13005)
金雷(1987—),男,工程师,硕士,研究方向为食品和环境微生物。E-mail:jinlei2388@126.com
*通信作者:顾蓓乔(1963—),男,工程师,本科,研究方向为食品质量与安全。E-mail:gubeiqiao@zjou.edu.cn
