植物乳杆菌β-D-葡萄糖苷酶的定位及活性研究
2014-03-08樊明涛李爱霞刘延琳
张 哲,樊明涛,*,董 梅,李爱霞,刘延琳
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.西北农林科技大学葡萄酒学院,陕西 杨凌 712100)
植物乳杆菌β-D-葡萄糖苷酶的定位及活性研究
张 哲1,樊明涛1,*,董 梅1,李爱霞1,刘延琳2
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.西北农林科技大学葡萄酒学院,陕西 杨凌 712100)
以对硝基苯基β-D-葡萄糖苷为底物,通过比色法从5 株植物乳杆菌中筛选出2 株有较高β-D-葡萄糖苷酶酶活力的菌株,并利用 差速离心分级沉淀对其β-D-葡萄糖苷酶进行定位。根据对植物乳杆菌的生长状况的分析,测定其在不同生长条件下β-D-葡萄糖苷酶的酶活力。结果表明:目的菌株体内的β-D-葡萄糖苷酶为胞内酶,属于细胞膜结合酶;该酶在对数生长末期(培养至12 h)酶活力最高,最适产酶培养基为改良MRS培养基;以完整细胞为参照对象,植物乳杆菌520、XJ-25菌株所产的β-D-葡萄糖苷酶均受纤维二糖及熊果苷的诱导,熊果苷的诱导作用较强。
植物乳杆菌;β-D-葡萄糖苷酶;定位;酶活力
β-D-葡萄糖苷酶(β-Glucosidase,EC 3.2.1.21)是催化水解烃基或芳香基与糖基之间的糖苷键生成芳香物质和葡萄糖的一种水解酶[1-2],主要存在于细菌、真菌和植物中,不同来源的酶在分子大小及催化特性等方面存在较大差异[3]。在葡萄和葡萄酒中除了游离的挥发性风味物质外还有大量的以β-D-葡萄糖苷形式存在的非挥发性风味前体物质[4]。β-D-葡萄糖苷酶能将其水解为具有浓郁天然风味的香气物质[5],另外,还可与其他风味酶协同作用释放出挥发性糖苷配基,起到增香作用[6]。因此,开发β-D-葡萄糖苷酶作为水果风味增香酶在葡萄酒酿造中具有重要意义。
由于植物来源的β-D-葡萄糖苷酶含量低,成本高,目前的很多研究集中于黑曲霉、酵母菌、乳酸菌等微生物中β-D-葡萄糖苷酶[7-9]。国内对黑曲霉中β-D-葡萄糖苷酶研究较多,但其存在食品安全隐患,在食品加工中受到限制[10]。而与酵母菌相比,乳酸菌是在酒精发酵结束后接种于葡萄酒中[11],其生长环境比酒精发酵的葡萄醪环境稳定,因此不易在酶的作用下生成不利于葡萄酒质量的副产物。作为下一代苹果酸乳酸发酵的发酵剂,植物乳杆菌有潜在启动苹果酸乳酸发酵的能力[12]。与常被用于苹果酸乳酸发酵的酒酒球菌相比,植物乳杆菌含有更高的β-D-葡萄糖苷酶和酚酸脱羧酶,对于葡萄酒增香应用具有广阔的前景[13]。此外,有关研究[14-15]表明该酶的存在形式分胞内、胞外两种。存在形式不同,其分离提取的手段也各不相同。胞外酶容易提取,利用离心方法即可获得;而胞内酶则需通过破碎细胞来释放酶,细胞破碎则成为酶分离提取的关键。因此,酶的定位研究是其分离纯化的前提,为其后续分离纯化方法和条件的选择提供参考和依据。目前关于植物乳杆菌糖苷酶活性及定位的研究较少,本实验对不同来源的5 株植物乳杆菌进行了酶活力测定及其定位分析,为该酶在食品行业中的应用奠定了基础,也对该酶的分离纯化及其结构性质研究提供重要理论依据。
1 材料与方法
1.1 菌株与培养基
1.1.1 供试菌株
植物乳杆菌520(由泡菜中分离)由本实验室分离、鉴定并保存;植物乳杆菌CS-1、XJ-14、XJ-25、XJA-2(由葡萄酒中分离)由西北农林科技大学葡萄酒学院提供。
1.1.2 培养基与试剂
MRS培养基:葡萄糖20 g/L、酵母浸粉4 g/L、蛋白胨10 g/L、牛肉膏5 g/L、MgSO4·7H2O 0.2 g/L、MnSO4·4H2O 0.05 g/L、乙酸钠5 g/L、磷酸氢二钾2 g/L、柠檬酸铵 2 g/L、吐温80 1 mL/L,用1 mol/L NaOH调pH值至6.2~6.4,121 ℃灭菌20 min。
改良MRS培养基:在MRS培养基的基础上,不添 加磷酸氢二钠,添加胰蛋白胨15 g/L代替蛋白胨10 g/L,用1 mol/L NaOH调pH值至4.8,121 ℃灭菌20 min。
ATB培养基:葡萄糖10 g/L、酵母浸粉5 g/L、蛋白胨10 g/L、Mg SO4·7H2O 0.2 g/L、MnSO4·4H2O 0.05 g/L、盐酸半胱氨酸0.5 g/L、番茄汁250 mL/L,用1 mol/L NaOH调pH值至4.8,121 ℃灭菌20 min。
MRST培养基:葡萄糖10 g/L、果糖5 g/L、酵母浸粉5 g/L、蛋白胨10 g/L、MgSO4·7H2O 0.2 g/L、MnSO4·4H2O 0.05 g/L、盐酸半胱氨酸0.5 g/L、吐温-80 1 mL/L、番茄汁100 mL/L,用1 mol/L NaOH将pH值调至5.0,121 ℃灭菌20 min[14]。
对硝基苯基-β-葡萄糖苷 上海宝曼生物科技有限公司;溶菌酶 美国Sigma公司;葡萄糖、纤维二糖、熊果苷 美国Amersc公司;其他常用试剂均为国产分析纯。
1.2 仪器与设备
DH-420A电热恒温培养箱、水浴锅 北京科伟永兴仪器有限公司;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司;HS-840U型水平层流单人净化工作台 苏州净化设备有限公司;pH计 上海雷磁仪器厂;UV-1700 紫外-可见分光光度计 日本Shimadzu公司;VC-130 超声波细胞破碎仪 美国Sonics & Materials公司。
1.3 方法
1.3.1 高酶活力菌株的筛选及β-D-葡萄糖苷酶的初步定位研究
初步定位研究方法参照文献[16],并稍加改动。分别取1 mL培养至对数生长末期的菌液,4 ℃、5 000×g离心10 min,得菌液上清及沉淀,用150 mmol/L NaCl洗涤沉淀2 次,得完整细胞。将完整细胞悬浮于细胞缓冲液中,冰浴条件下130 W超声破碎15 min(间隔2 s)得破碎液,破碎液经4 ℃、12 000×g离心10 min后,得破碎上清液及细胞碎片。将完整细胞及细胞碎片重 悬浮于1 mL蒸馏水中,进行酶活力测定,菌液上清、破碎液及破碎上清液直接进行酶活力测定。
酶活力测定方法:方法参照文献[16],并有所改动。一定量酶液(调整酶液量以确保最终比色值在0.2~0.8)用蒸馏水稀释到500 μL,然后和500 μL 2×柠檬酸磷酸缓冲液/对硝基苯-β-D-葡萄糖苷(终pH 5.0,底物浓度 5 mmol/L)混合,在37℃下水浴1 h后4 ℃、12 000×g离心10 min,将上清加入2 mL、1 mol/LNa2CO3终止反应,在400 nm波长下比色。对照组为用蒸馏水代替处理样品。
酶活力的定义:在反应体系中,1 min内1 g干质量菌体催化生成1 μmol对硝基苯酚所需的酶量为1 个酶活力单位,表示为1 μmol/(g·min)。
1.3.2 植物乳杆菌的的生长特性及最适产酶培养基的选择
将1.3.1节确定的高产酶植物乳杆菌分别以2%的接种量接入200 mL的MRS、改良MRS、ATB、MRST液体培养基中,37 ℃条件下静置培养(属于兼性厌氧培养),每隔2 h取样测定其OD600nm值并绘制生长曲线。根据生长曲线,测定各菌株在不同培养基中对数末期的酶活力,筛选出最适产酶培养基。
1.3.3 菌体不同生长时期的酶活力分布
根据1.3.2节中的各菌株生长曲线,分别对其对数生长中期、对数生长末期、稳定期取样,按照初步定位方法进行各部位酶活力测定。
1.3.4 不同碳源对β-D-葡萄糖苷酶酶活力的诱导
将筛选出的高酶活力植物乳杆菌分别在碳源为纤维二糖(10 g/L)、熊果苷(20 g/L)、葡萄糖(10 g/L)加熊果苷(10 g/L)、葡萄糖(10 g/L)加纤维二糖(5 g/L)的培养基中静置培养至对数生长末期,测其酶活力。以葡萄糖(20 g/L)碳源为对照组。
1.3.5 β-D-葡萄糖苷酶的进一步定位研究
参照文献[17]方法并稍加修改。取8 mL菌液,4 ℃、5 000×g离心10 min,然后用0.5 mol/L苹果酸钠缓冲液(pH 6.6)洗涤沉淀,4 ℃、5 000×g再次离心10 min,得完整细胞,并将其悬浮于8 mL、0.5 mol/L苹果酸钠缓冲液中(pH 6.6),然后加入溶菌酶(终质量浓度75 μg/mL),37 ℃水浴2 h,直到细胞壁完全破裂。破壁后4 ℃、7 000×g离心20 min,用0.5 mol/L苹果酸钠缓冲液(pH 6.6)洗涤沉淀,再次4 ℃、7 000×g离心20 min,得原生质体。两次离心所得上清混合在 一起命名为上清液A。原生质体再悬浮于8 mL低渗溶液中(10 mmol/L 苹果酸钠缓冲液,pH 6.6)使其破裂,将裂解液在4 ℃、24 000×g下离心1.5 h,得细胞膜和可溶性酶;上清液A在4 ℃、24 000×g下离心1.5 h,得细胞壁碎片和细胞周质。对所得各组分进行酶活力测定,确定β-D-葡萄糖苷酶的存在位置。
2 结果与分析
2.1 β-D-葡萄糖苷酶的初步定位

图1 植物乳杆菌β-D-葡萄糖苷酶初步定位Fig.1 β-D--glucosidase activity of different fractions from five strains
由图1可知,5 株植物乳杆菌均具有β-D-葡萄糖苷酶酶活力,其中植物乳杆菌520、XJ-25酶活力较高。此外,其不同部位酶活力显示,完整细胞酶活力最高,破碎液与细胞碎片次之,而菌液上清及破碎上清液几乎无酶活力。此与前人报道的β-D-葡萄糖苷酶主要存在于乳酸菌的完整细胞上,而菌液上清及破碎液上清液基本无酶活的结果一致[18],与一些研究者筛选出胞外及胞内β-D-葡萄糖苷酶的研究结果存在一定差异[14-15]。该结果也表明:β-D-葡萄糖苷酶属于胞内酶,主要为不可溶性酶。
2.2 植物乳杆菌生长状况
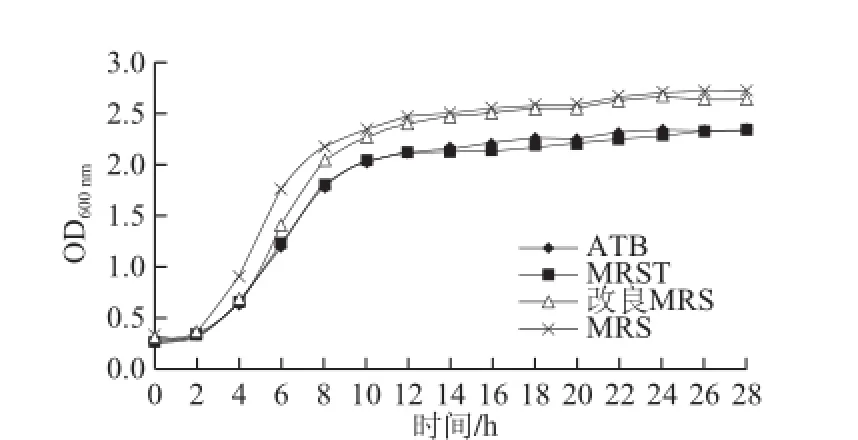
图2 520菌株在不同培养基中的生长情况Fig.2 Growth curves of strain 520 in different media

图3 XJ-25菌株在不同培养基中的生长情况Fig.3 Growth curves of strain XJ-25 in different media
由图2、3可知,植物乳杆菌520、XJ-25在不同的培养基上具有相同的生长趋势,且不同培养基对其生长无显著影响。菌株接种后0~2 h均为延滞期,菌体浓度基本保持不变,随后进入对数生长期,接种12 h后进入稳定期。
2.3 产酶培养基的选择
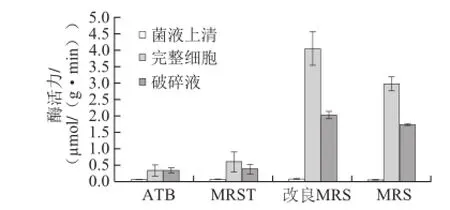
图4 520菌株在不同培养基中的β-D-葡萄糖苷酶酶活力Fig.4 Determination of the highest activity of strain 520 in four media

图5 XJ-25菌株在不同培养基中的β-D-葡萄糖苷酶酶活力Fig.5 Determination of the highest activity of strain XJ-25 in four media
图4 、5显示了植物乳杆菌520、XJ-25在4 种培养基中的酶活力情况,2 株菌株在不同培养基中均是完整细胞及破碎液酶活力较高,在改良MRS培养基中培养时,β-D-葡萄糖苷酶酶活力最高,在MRS培养基中次之,而适合酒酒球菌生长及产高酶活力的ATB、MRST培养基对植物乳杆菌并没有展现出高酶活力的能力。
2.4 菌体在不同生长时期的酶活力分布
图6、7显示了菌株520、XJ-25的菌液上清、完整细胞和破碎液在对数生长中期(6 h)、对数生长末期(12 h)和稳定期(24 h)的β-D-葡萄糖苷酶活力。2 株菌的菌液上清及破碎上清液在3 个不同时期的酶活力都几乎为零,这与细胞初步定位时的一致,而完整细胞、破碎液和细胞碎片酶活力均随着生长时期的变化而呈现先增后降的趋势。由此可知,2 株菌株均在对数生长末期具有最高β-D-葡萄糖苷酶酶活力。

图6 520菌株不同生长时期的β-D-葡萄糖苷酶酶活力Fig.6 Effects of growth phages on β-D--glucosidase activity of strain 520

图7 XJ-25菌株不同生长时期的β-D-葡萄糖苷酶酶活力Fig.7 Effects of growth phages on β-D--glucosidase activity of strain XJ-25
2.5 不同碳源对β-D-葡萄糖苷酶酶活力的诱导

图8 不同碳源对5200菌株β-D-葡萄糖苷酶酶活的诱导Fig.8 Induction of β-D--glucosidase activity of strain 520 by different carbon sources
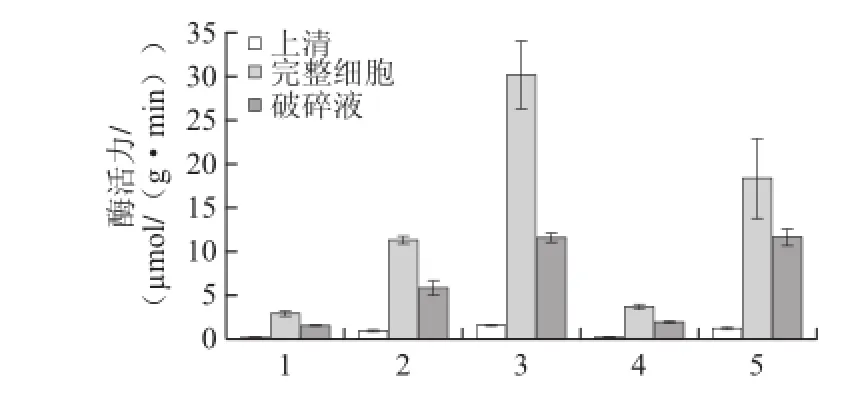
图9 不同碳源对XJ-255菌株β-D-葡萄糖苷酶酶活力的诱导Fig.9 Induction of β-D--glucosidase activity of strain XJ-25 by different carbon sources
由图8、9可知,在有熊果苷作为碳源时上清液具有一定的酶活力,且显著高于其他实验组的酶活力,此原因可能是培养基中的熊果苷分解产生对羟基苯酚和葡萄糖,而对羟基苯酚在碱性条件下显黄色,影响了酶活力的测定[19];对于完整细胞及细胞破碎液来说,在有纤维二糖或熊果苷作为碳源时的酶活力显著高于以葡萄糖作为碳源时的酶活力,且在有熊果苷作为碳源时的酶活力要高于有纤维二糖作为碳源时的酶活力,这说明2 株菌株的酶活力在含有糖苷键碳源的诱导下会有不同程度的提高。
2.6 β-D-葡萄糖苷酶的进一步定位
由2.1节的初步定位研究(图1)可知,本实验所采用的5 株植物乳杆菌均具有β-D-葡萄糖苷酶酶活力,且该酶属于胞内不可溶性酶。为了对该酶进行深入的了解,探寻其在细胞内的确切存在位置,故对其进行了进一步的定位研究,其结果如图10、11所示。细胞壁β-D-葡萄糖苷酶活力很低,几乎为零,细胞壁和细胞膜之间的周质腔内有一定的酶活力,且其酶活力几乎等于上清A的酶活力,说明上清A的酶活力主要来自于周质腔内的酶活力;原 生质体也具有酶活力,原生质体裂解、离心后得到的上清(可溶酶)和沉淀(细胞膜)中都有酶活力,且沉淀的酶活力远远高于上清中的酶活力,说明原生质体内的β-D-葡萄糖苷酶主要为不可溶性酶,多存在于原生质体的细胞膜中,为膜结合酶。
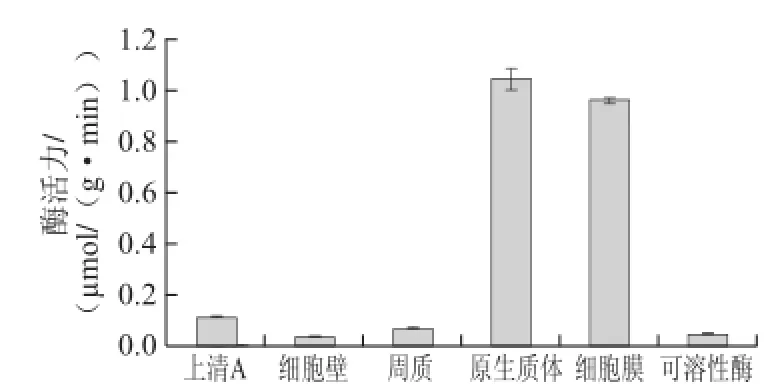
图10 5200菌株β-D-葡萄糖苷酶细胞定位Fig.10 Cellular localization of β-D--glucosidase from strain 520

图11 XJ-255菌株β-D-葡萄糖苷酶细胞定位Fig.11 Cellular localization of β-D--glucosidase from strain XJ-25
3 讨论与结论
目前所发现的β-D-葡萄糖苷酶中有两种:膜结合酶和非膜结合酶。因两者之间的性质差异极大,其分离提取的方法也各不相同。本实验结合国外的先进技术,采用差速离心分级沉淀对植物乳杆菌中的β-D-葡萄糖苷酶进行定位,结果表明其β-D-葡萄糖苷酶主要为胞内不可溶性酶,存在于细胞膜上,属于膜结合酶。膜结合酶因其不可溶、难提取等特点很少被用于分离纯化的研究中,但研究膜结合酶十分必要。分离纯化制得酶液或酶制剂应用于实践,不仅工序繁琐而且价格昂贵不适合工业的大批生产,而具有高膜结合酶活性的菌株可直接被投入生产应用,对葡萄酒的酿造具有重要意义。
作为一种食品安全菌种,不同来源的2 株植物乳杆菌在4 种培养基中均能良好生长且无显著差异,生长趋势一致,说明培养基的成分差异对其生长几乎无影响,但不同培养基下的酶活力差异, 则表明培养环境对产酶及酶活力有较大影响。2 株高酶活力菌株能否在葡萄酒苛刻条件(高酒精含量、低pH值、高糖及高SO2含量)下展现出高酶活力成为了目前探讨的问题[12]。
本实验从5 株植物乳杆菌中筛选出2 株高产β-D-葡萄糖苷酶菌株并对其进行定位及活性分析,结果表明该酶主要为胞内不可溶性酶,属于细胞膜结合酶,且其在对数生长末期酶活力最高,最适培养基为改良MRS培养基。此外,不同碳源下的诱导结果显示,该酶为组成型酶,但在纤维二糖和熊果苷的诱导下酶活力有不同程度的提高。
[1] 李华, 高丽. β-葡萄糖苷酶活性测定方法的研究进展[J]. 食品与生物技术学报, 2007, 26(2): 107-112.
[2] 谢宇, 尚晓娴, 胡金刚. β-葡萄糖苷酶纯化及酶学性质研究[J]. 江西农业大学学报, 2008, 30(3): 521-524.
[3] 郑芳, 曹小芳, 张亚玲, 等. 一株β-葡萄糖苷酶产生菌株的分离鉴定及酶学性质研究[J]. 微生物学通报, 2012, 39(8): 1059-1068.
[4] 孟宪文, 李长彪, 刘长江, 等. 乳酸菌β-葡萄糖苷酶的分离纯化及特性研究[J]. 食品科学, 2006, 27(11): 116-119.
[5] 杨芮, 吕珍, 文彦, 等. 酒类酒球菌中β-葡萄糖苷酶性质研究[J]. 食品科学, 2013, 34(4): 1-10.
[6] 陈静, 郝伟伟, 王春梅, 等. 产β-葡萄糖苷酶真菌的筛选鉴定、纯化及酶学性质分析[J]. 食品科学, 2013, 34(5): 191-196.
[7] GONZALEZ-POMBO P, FARINA L, CARRAU F, et al. A novel extracellular β-glucosidase from Issatchenkia terricola: isolation, immobilization and application for aroma enhancement of white Muscat wine[J]. Process Biochemistry, 2011, 46: 385-389.
[8] BAFFI M A, TOBAL T, LAGO J H G, et al. A novel β-Glucosidase from Sporidiobolus pararoseus: characterization and application in winemaking[J]. Journal of Food Science, 2011, 76(7): C997-C1002.
[9] CAPALDO A, WALKER M E, EORD C M, et al. β-Glucoside metabolism in Oenococcus oeni: cloning and characterization of the phospho-β-glucosidase CelD[J]. Journal of Molecular Catalysis B: Enzymatic, 2011, 69: 27-34.
[10] 谢爽. β-葡萄糖苷酶在食品增香中的应用[J]. 中外食品, 2004(12): 44-45.
[11] 李华. 葡萄酒工艺学[M]. 北京: 科学出版社, 2007.
[12] TOIT M D, ENGELBRECHT L, LERM E, et al. Lactobacillus: the next generation of malolactic fermentation starter cultures: an overview[J]. Food Bioprocess Technology, 2011, 4(6): 876-906.
[13] LERM E, ENGELBRECHT L, TOIT M D. Selection and characterisation of Oenococcus oeni and Lactobacillus plantarum south african wine isolates for use as malolactic fermentation starter cultures[J]. South African Journal of Enology and Viticulture, 2011, 32(2): 280-295.
[14] MICHLMAYR H, SCHUMANN C, BARREIRA BRAZ DA SLIVA N M, et al. Isolation and basic characterization of a β-glucosidase from a strain of Lactobacillus brevis isolated from a malolactic starter culture[J]. Journal of Applied Microbiology, 2010, 108(2): 550-559.
[15] 万振堂, 杨丽杰. 产胞外β-葡萄糖苷酶乳酸菌的筛选及其酶学性质的初步研究[J]. 食品与发酵工业, 2009, 35(4): 28-32.
[16] BARBAGALLO R N, SPAGNA G, PALMERI R, et al. Assessment of β-gl ucosidase activity in selected wild strains of Oenococcus oeni for malolactic fermentation[J]. Enzyme and Microbial Technology, 2004, 34(3): 292-296.
[17] de CORT S, SHANTHA KUMARA H M C, VERACHTER H. Localization and characterization of α-glucasidase activity in lactobacillus-brevis[J]. Applied and Environmental Microbiology, 1994, 60(9): 3074-3078.
[18] PEREZ-MARTI´N F, SESENA S, IZQUIERDO P M, et al. Screening for glycosidase activities of lactic acid bacteria as a biotechnological tool in oenology[J]. World Journal of Microbiology and Biotechnology, 2012, 28(4): 1423-1432.
[19] 李亚辉, 董梅, 崔禾苗, 等. 酒酒球菌SD-2a的β-D-葡萄糖苷酶活性研究[J]. 食品科技, 2013, 38(8): 48-52.
Localization and Activity of β-D-Glucosidase from Lactobacillus plantarum
ZHANG Zhe1, FAN Ming-tao1,*, DONG Mei1, LI Ai-xia1, LIU Yan-lin2
(1. College of Food Scienc e and Engineering, Northwest A&F University, Yangling 712100, China; 2. College of Enology, Northwest A&F University, Yangling 712100, China)
In this study, two strains of Lactobacillus plantarum (L. plantarum) with the highest β-D-glucosidase activity were obtained from five L. plantarum strains with p-nitro-phenyl-β-D-glucopyranoside as the substrate and their cellular localization of β-D-glucosidase was studied by using fractional precipitation with differential centrifugation. In addition, the enzymatic act ivity of β-D-glucosidase was determined under different growth conditions, followed by analyzing the growth of L. plantarum. Our results supported the conclusion that β-D-glucosidase was membrane-associated and might be insoluble. The highest activity was displayed at the late exponential phase and an improved MRS was verified as the optimal medium. For whole cells, β-D-glucosidase was induced by cellobiose and arbutin, but arbutin played more important role in the enzymatic activity.
Lactobacillus plantarum; β-D-glucosidase; cellular localization; enzymatic activity
TS261.1
A
1002-6630(2014)15-0161-05
10.7506/spkx1002-6630-201415033
2013-09-29
国家现代农业(葡萄)产业技术体系建设专项(nycytx-30-ch-03)
张哲(1990—),女,硕士研究生,研究方向为食品生物技术。E-mail:871805936@qq.com
*通信作者:樊明涛(1963—),男,教授,博士,研究方向为食品生物技术。E-mail:fanmt@nwsuaf.edu.cn
