番石榴叶乙酸乙酯萃取物化学成分研究
2014-03-08欧阳文朱晓艾邵祥辉刘晓娟刘润南杜方麓
欧阳文,朱晓艾,邵祥辉,刘晓娟,刘润南,刘 欣,杜方麓,曹 庸,*
(1.湖南中医药大学药学院,湖南 长沙 410208;2.华南农业大学食品学院,广东 广州 510642)
番石榴叶乙酸乙酯萃取物化学成分研究
欧阳文1,朱晓艾2,邵祥辉2,刘晓娟2,刘润南1,刘 欣2,杜方麓1,曹 庸2,*
(1.湖南中医药大学药学院,湖南 长沙 410208;2.华南农业大学食品学院,广东 广州 510642)
目的:寻找番石榴叶乙酸乙酯萃取物中具有降糖活性的功能成分。方法:采用硅胶、羟丙基葡聚糖凝胶柱层析与溶剂重结晶法进行单体分离纯化;通过分析化合物的理化性质、核磁共振谱(nuclear magnetic resonance spectrum,NMR)、质谱(mass spectrum,MS)数据进行结构鉴定;建立降糖脂肪细胞模型评价主要单体的降糖活性。结果:从番石榴叶乙酸乙酯萃取物中共分得14个单体化合物,分别鉴定为:金丝桃苷(化合物1)、异槲皮苷(化合物2)、槲皮素-3-O-β-D-木糖苷(化合物3)、广寄生苷(化合物4)、番石榴苷(化合物5),槲皮素-3-O-(2’-O-没食子酰基)-α-L-阿拉伯吡喃糖苷(化合物6),槲皮素(化合物7)、没食子酸乙酯(化合物8)、齐墩果酸(化合物9)、β-谷甾醇(化合物10)、isocaryolan-9-one(化合物11)、(-)-epiglobulol(化合物12)、t-cadinol(化合物13)和muurola-4,10(14)-dien-1-ol(化合物14)。降糖脂肪细胞模型测定结果表明,5种主要黄酮苷均具有降糖活性,其中以番石榴苷和广寄生苷降糖效果最好,40 μmol/L浓度下促葡萄糖摄取值分别达到了(1.74±0.076)、(1.81±0.029)mmol/L。结论:化合物6、8、11~14为首次从该植物中分得,化合物11为一新的天然产物;番石榴苷和广寄生苷可能为番石榴叶主要降糖活性成分。
番石榴叶;黄酮类;倍半萜类;isocaryolan-9-one;化学成分;降糖活性
番石榴(Psidium guajava Linn.)为桃金娘科(Myrtaceae)番石榴属(Psidium)果树。番石榴具有降糖、止泻、抗氧化、抗肿瘤、抗菌、降血压、保护心脏等多种药用功效,因此作为一种民间药物在全世界亚热带地区广泛使用[1]。番石榴具有明显的降糖作用,民间的广泛应用和大量的科学研究证明其具有较好的降糖效果且无毒副作用[2-6],在日本,FOSHU(特定保健用食品)已有批准作为防治2型糖尿病的含番石榴提取物的番石榴茶上市[7]。番石榴叶中化学成分种类丰富,含有三萜、黄酮、鞣质、倍半萜、杂萜类、挥发油等多种结构类型的化学成分,其中三萜类化合物主要为乌苏烷型和齐墩果烷型,黄酮类化合物主要为槲皮素和槲皮素为苷元的黄酮苷,除黄酮和鞣质外,还可见新颖二苯甲酮苷类的多元酚类存在。从2007年以后不断有新奇结构的杂萜类化合物发现,因此对番石榴叶进行进一步的化学成分和药理活性研究具有重要意义[8]。本实验对具有降糖功能的番石榴叶乙酸乙酯萃取物[2]进行了系统的化学成分研究,共分离得到14种单体化合物,其中化合物11(isocaryolan-9-one)为一种新的天然产物,同时通过建立降糖脂肪细胞模型,对主要黄酮苷类化合物的降糖活性进行了研究。
1 材料与方法
1.1 材料与试剂
番石榴叶,于2012年9月采自广东省茂名市林业局,原植物经湖南吉首大学廖博儒教授鉴定,为桃金娘科番石榴属植物,植物标本现存于华南农业大学食品学院天然活性物研究中心;雄性SD大鼠,SPF级,体质量120~150 g,购自南方医科大学实验动物中心。
薄层层析硅胶、柱层析硅胶(100~200目) 青岛海洋化工厂;Sephadex LH-20 美国GE公司;常规提取分离用试剂均为国产分析纯;葡萄糖(glucose,GLU)测定试剂盒 广州科方生物技术公司;胰岛素、Ⅰ型胶原酶 美国Sigma公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、葡萄糖 广州威佳生物公司;去酚红Hanks缓冲液、青霉素-链霉素双抗 杭州吉诺生物公司;肾上腺素 日本TCI公司;胎牛血清 杭州四季青公司。
1.2 仪器与设备
UV-1600紫外-可见光度计 北京瑞利分析仪器公司;INOVA-600 MHz高分辨超导核磁共振谱仪 瑞士Bruker公司;电子天平(万分之一) 美国梅特勒-托利多公司;Wallac VICTOR3-1420型酶标仪 美国PE公司;SW-CJ-2FD超净工作台 苏州净化公司;TC-2323二氧化碳培养箱 美国Sheldon公司;各种规格移液器 美国伯乐公司;1 200 L液相色谱/四极杆串联质谱联用仪 美国瓦里安公司;AEI-MS-50型质谱仪 美国AEI公司。
1.3 方法
1.3.1 提取与分离纯化
番石榴叶2 kg,粉碎,用12倍体积95%乙醇(体积分数)回流提取3次,60 ℃减压回收溶剂,加适当水分散,乙酸乙酯液充分萃取,减压回收溶剂得乙酸乙酯浸膏45.9 g。取乙酸乙酯萃取浸膏40 g,经硅胶常压、低压柱层析,重结晶及葡萄糖凝胶LH-20(SephadexLH-20)层析,共分离得到了14个单体化合物,分别为化合物1(25.5 mg)、2(17.4 mg)、3(30.3 mg)、4(117.9 mg)、5(105.3 mg)、6(6 mg)、7(124 mg)、8(8 mg)、9(17 mg)、10(25 mg)、11(6 mg)、12(14 mg)、13(11 mg)、14(7 mg)。
1.3.2 结构鉴定
对所获得的单体化合物,采用薄层层析或液相色谱检测纯度,测定单体化合物的紫外、核磁共振与质谱图,同时对获得的波谱数据综合解析,并与文献比较进行化合物结构鉴定。
核磁共振测定中根据化合物的极性,分别选用氘代氯仿,氘代甲醇,氘代二甲基亚砜为溶剂,以四甲基硅烷(tetramethylsilane,TMS)为内标测定;质谱测定中,电子轰击质谱(electron impact mass spectrometry,EI-MS)电离源为70 ev电子流,高分辨电喷雾质谱(high resolution electrospray ionization mass spectrometry,HRESI-MS)采用电喷雾方式离解,阴离子模式。
1.3.3 乙酸乙酯萃取物与单体降糖活性测定
1.3.3.1 供试样品的制备
将乙酸乙酯萃取物和单体化合物在无菌条件下,用体积分数0.5% DMSO配制成各浓度的供试样品溶液,并过0.22 μm微孔滤膜除菌。
1.3.3.2 脂肪细胞的分离纯化
参照Rodbell[9]方法,略作修改:大鼠脱颈处死,75%酒精浴后无菌开腹,取附睾外层白色脂肪组织,Hanks缓冲液漂洗2次并剔除附带血管,再剪碎至约1 mm×1 mm×1 mm,加入适量0.1%Ⅰ型胶原酶溶液,37 ℃水浴消化1.5 h后加入2~3倍体积的胎牛血清终止消化。细胞悬液1 200 r/min离心10 min弃下层溶液,上层脂肪细胞同法加Hanks缓冲液洗涤细胞2 次,通过细胞计数板,加入Hanks液调节细胞浓度。
1.3.3.3 大鼠脂肪细胞降糖模型
参照Nishide等[10]方法,略作修改:在96孔板中建立200 μL反应体系:浓度为2×106个/mL细胞悬液100 μL,30 μL葡萄糖溶液(质量浓度为1 mg/mL),30 μL胎牛血清,40 μL样品溶液。在此模型中,用0.1% DMSO Hanks缓冲液做对照组,胰岛素为阳性对照。200 μL反应体系培养30 min后,每孔加入终浓度为10-5mol/L肾上腺素,继续培养3 h后,冰浴终止反应。然后每孔精密吸取2 μL上清液,采用微量葡萄糖氧化酶法[11]显色,在酶标仪上(505 nm)读数,测定并计算各孔葡萄糖浓度,通过建立工作曲线,并和对照组比较计算各组的葡萄糖消耗浓度,由此评价萃取物或单体的摄取葡萄糖能力,具体计算公式如下:
葡萄糖摄取水平= c对照组-c供试组
式中:c对照组为对照组葡萄糖浓度/(mmol/L);c供试组为样品或分离得到的单体经过3 h培养后残留培养基中的葡萄糖浓度/(mmol/L)。
2 结果与分析
2.1 单体结构鉴定
2.1.1 化合物11
无色油状物,喷洒香草醛-浓硫酸后加热显黄色,[α]D-27.3° (c 0.09,CHCl3)。电子轰击质谱(EI-MS)给出分子离子峰[M]+·220,推出化合物的分子量为220 u,碳谱(图1)给出15个碳信号,结合DEPT谱,确定其共有3个甲基,6个亚甲基,3个次甲基,3个季碳(包含一个羰基 δ 215.8),因此推出分子式为C15H24O,计算不饱和度为4,为三环倍半萜类化合物。
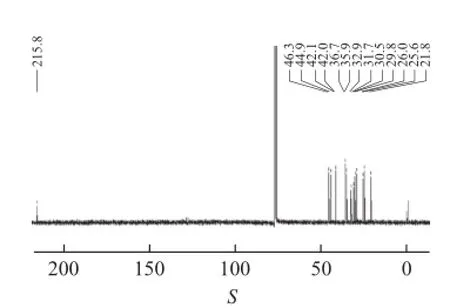
图1 化合物11碳谱图Fig.1 Carbon-13 spectrum of compound 11
在氢谱中δH0.903、0.939、0.984(each 3H, s)说明有3个甲基均与季碳相连,结合HSQC谱,表明分别与碳δC26.0(C-13)、21.8(C-14)、30.5(C-15)直接相连。据此信息点,结合二维核磁共振谱包括HSQC、COSy、HMBC(图2)进行结构连接和信号归属(表1)。
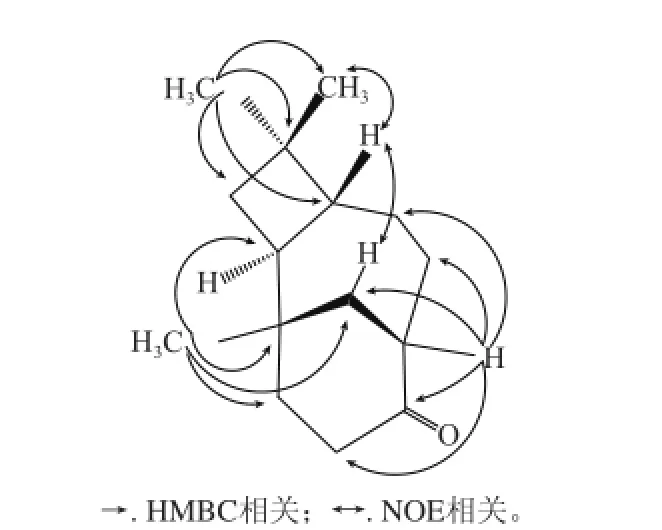
图2 关键二维相关示意图Fig.2 Key 2D correlations of compound 11
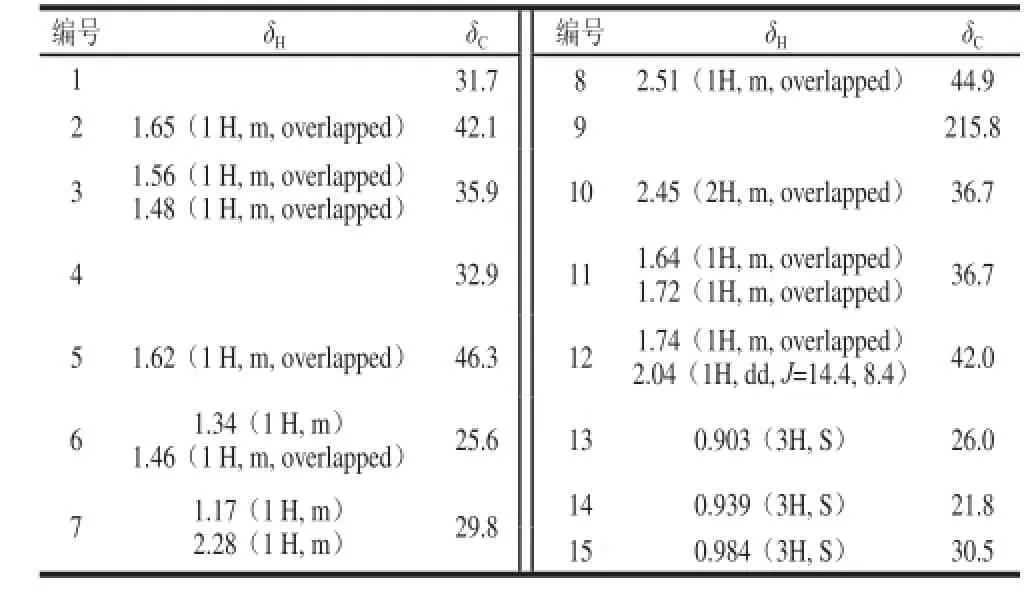
表1 Isocaryolan-9-one核磁数据归属表(CDCl3,, δ,, J in HHzz)Table 1 NMR Data of isocaryolan-9-one (CDCl3,, δ, JJ inn HHzz)
HMBC谱中,δH0.939(3H, s, H-15)和0.984(3H, s, H-14)均与δC32.9(C-4)、35.9(C-3)、46.3(C-5)远程相关;COSy谱中又可见δH1.34(1H, m, H-6)分别与δH1.62(1H, m, H-5)、2.28(1H, m, H-7)相关,同时δH2.28(1H, m, H-7)又与δH2.51(1H, m, H-8)相关,据此可连接成结构片段1(图3)。

图3 结构片段1Fig.3 Deduced structure of fragment 1
HMBC谱中,δH0.903(3H, s, H-13)与δC31.7(C-1)、42.1(C-2)、36.7(C-11)、42.0(C-12)远程相关,δH2.51(1H, m, H-8)和δH2.45(2H, m, H-10)均与δC215.8(C-9)远程相关;COSy谱中可见δH2.45(2H, m, H-10)与δH1.72(1H, m, H-11)相关,虽然在碳谱中C-10、C-11均重叠在δC36.7,氢谱和二维COSy可证实该两个亚甲基直接相连;COSy谱中还可见δH2.51(1H, m, H-8)与δH2.28(1H, m, H-7)、2.04(1H, m, H-12)均有相关,据此可连接成片段2(图4)。
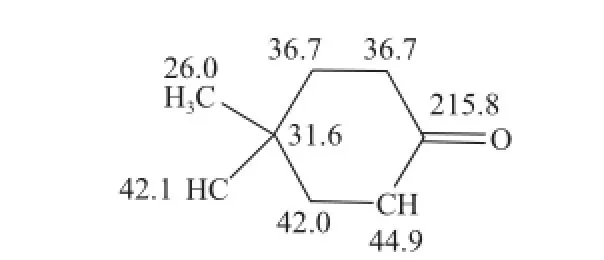
图4 结构片段2Fig.4 Deduced structure of fragment 2
δC44.9(C-8)为两结构片段所共有,将两结构片段连接,推出结构为isocaryolane型三环倍半萜,且羰基在9位,文献[12]报道已经从番石榴叶中分得石竹烯和氧化石竹烯,从生物合成途径上,双环石竹烷型再环化成isocaryolane型是可行的。进一步分析其NOE谱,可见H-5 (δ 1.62, 1H, m)与H-15(δ 0.939 3H, S),H-12(δ 1.74, 1H, m)有相关信号峰,证实了5位氢与12位亚甲基处于顺式的空间定向,综上确定结构为isocaryolan-9-one(图5)。经检索,该化合物可通过氧化石竹烯在四氰基乙烯催化的特殊条件下,发生氢1,2化学重排以副产物形成[13],但在自然界发现该种极为罕见的天然骨架为首次,因此确定为一新的天然产物。番石榴叶已经分离得到了杂萜醛类、二苯甲酮类这些独特的新颖骨架[8],本实验又获得了一新颖isocaryolane型倍半萜骨架。

图5 化合物11结构式Fig.5 Chemical structure of compound 11
2.1.2 化合物1
黄色粉末,盐酸-镁粉反应显红色,示其可能为一黄酮类化合物。1H NMR (CD3OD, 600 MHz)δ:6.21(1H, d, J=1.8 Hz, H-6)、6.40(1H, d, J=1.8 Hz, H-8)、7.83(1H, d, J=2.4 Hz, H-2’)、 6.87(1H, d, J=8.4 Hz, H-5’)、7.58(1H, dd, J=2.4, 8.4 Hz, H-6’)、5.15(1H, d, J=7.8 Hz, C-1’’)。13C NMR (CD3OD, 150 MHz)δ:158.9(C-2)、 135.9(C-3)、179.6(C-4)、105.7(C-4a)、163.0(C-5)、99.9(C-6)、166.0(C-7)、94.8(C-8)、158.5(C-8a)、122.9(C-1’)、117.9(C-2’)、145.9(C-3’)、149.9(C-4’)、116.1(C-5’)、123.0(C-6’)、105.5(C-1’’)、73.2(C-2’’)、75.1(C-3’’)、70.0(C-4’’)、77.2(C-5’’)、62.0(C-6’’)。碳氢化学位移数据和文献[14]报道的槲皮素3-O-β-D-半乳糖苷比较,完全一致,故鉴定化合物1为金丝桃苷(hyperoside)(图6),另该文献中13C核磁数据归属有部分错误,本实验做了校订。

图6 化合物1 结构式Fig.6 Chemical structure of compound 1
2.1.3 化合物2
黄色粉末,盐酸-镁粉反应显红色,示其可能为一黄酮类化合物。1H NMR(CD3OD, 600 MHz) δ:6.20(1H, s, H-6)、6.39(1H, s, H-8)、7.71(1H, s, H-2’)、6.88(1H, d, J=7.8 Hz, H-5’)、7.58(1H, d, J=7.8 Hz, H-6’)、5.23(1H, d, J=7.2 Hz, C-1’’)。13C NMR(CD3OD, 150 MHz)δ:159.1(C-2)、135.7(C-3)、179.5(C-4)、105.7(C-4a)、163.0(C-5)、99.9(C-6)、166.0(C-7)、94.8(C-8)、158.5(C-8a)、122.1(C-1’)、117.6(C-2’)、145.9(C-3’)、149.9(C-4’)、116.1(C-5’)、123.2(C-6’)、104.4(C-1’’)、75.8(C-2’’)、78.4(C-3’’)、71.3(C-4’’)、78.3(C-5’’)、62.6(C-6’’)。碳氢化学位移数据和文献[14]比较,完全一致,故鉴定化合物2为槲皮素3-O-β-D-葡萄糖苷,即异槲皮苷(isoquercitrin)(图7),另该文献中13C核磁数据归属有部分错误,本实验做了校订。

图7 化合物2结构式Fig.7 Chemical structure of compound 2
2.1.4 化合物3
黄色粉末,盐酸-镁粉反应显红色,示其可能为一黄酮类化合物。1H NMR (CD3OD, 600 MHz)δ:6.23(1H, d, J=1.8 Hz, H-6)、6.42(1H, d, J=1.8 Hz, H-8)、7.61(1H, d, J=1.8 Hz, H-2’)、6.88(1H, d, J=8.4 Hz, H-5’)、7.58(1H, dd, J=1.8, 8.4 Hz, H-6’)、5.16(1H, d, J=7.2 Hz, C-1’)。13C NMR (CD3OD, 150 MHz)δ:159.1(C-2)、135.4(C-3)、179.4(C-4)、105.7(C-4a)、162.9(C-5)、100.0(C-6)、166.0(C-7)、94.9(C-8)、158.5(C-8a)、123.0(C-1’)、117.3(C-2’)、146.0(C-3’)、149.8(C-4’)、116.2(C-5’)、123.4(C-6’)、104.5(C-1’’)、 75.2(C-2’)、77.4(C-3’’)、71.0(C-4’’)、67.1(C-5'')。与文献[15]比较,确定化合物3为槲皮素-3-O-β-D-吡喃木糖苷(quercetin-3-O-β-D- xylpyranoside)(图8)。

图8 化合物3结构式Fig.8 Chemical structure of compound 3
2.1.5 化合物4
黄色粉末,HCl-Mg粉反应阳性,Molish反应阳性,同时其紫外-可见吸收光谱明显可见两个黄酮吸收带(带Ⅰ:357 nm、带Ⅱ:258 nm),示其亦为一黄酮苷类化合物。1H NMR(DMSO-d6, 600 MHz)δ:12.6(5-OH)、6.20(1H, d, J=1.8 Hz, H-6)、6.41(1H, d, J=1.8 Hz, H-8)、7.47(1H, d, J=2.4 Hz, H-2’)、6.84(1H, d, J=9.0 Hz, H-5’)、7.55 (1H, dd, J=2.4, 9.0 Hz, H-6’)、5.58(1H, d, J=1.2 Hz, C-1’’)。13C NMR(DMSO-d6, 150 MHz)δ:156.9(C-2)、133.3(C-3)、177.6(C-4)、103.9(C-4a)、161.1(C-5)、98.6(C-6)、164.1(C-7)、93.5(C-8)、156.2(C-8a)、120.9(C-1’)、115.5(C-2’)、145.0(C-3’)、148.4(C-4')、115.5(C-5’)、121.6(C-6’)、107.8(C-1’)、82.0(C-2’)、76.9(C-3’)、85.8(C-4’)、60.6(C-5’)。以上数据和文献[16]报道一致,故确定化合物4为槲皮素3-O-α-L阿拉伯呋喃糖苷,即广寄生苷(avicularin)(图9)。

图9 化合物4结构式Fig.9 Chemical structure of compound 4
2.1.6 化合物5
黄色针状结晶(乙醇),盐酸-镁粉反应阳性显红色。其紫外-可见吸收光谱明显可见两个黄酮吸收带(带Ⅰ:360 nm、带Ⅱ:257 nm),以上提示该化合物为一黄酮类化合物。1H NMR (DMSO-d6, 600 MHz)δ:12.6(5-OH)、6.20(1H, d, J=1.8 Hz, H-6)、6.40(1H, d, J=1.8 Hz, H-8)、7.50 (1H, d, J=2.4 Hz, H-2’)、6.83(1H, d, J=8.4 Hz, H-5’)、7.65 (1H, dd, J=2.4, 8.4 Hz, H-6’)、5.27 (1H, d, J=4.8 Hz, C-1’’)。13C NMR(DMSO-d6, 150 MHz)δ:156.3(C-2)、133.8(C-3)、177.5(C-4)、103.9(C-4a)、161.2(C-5)、98.7(C-6)、164.2(C-7)、93.5(C-8)、156.3(C-8a)、120.9(C-1’)、115.8(C-2’)、144.9(C-3’)、148.6(C-4’)、115.4(C-5’)、122.0(C-6’)、101.4(C-1’)、70.7(C-2’)、71.7(C-3’’)、66.0(C-4’)、64.3(C-5’)。以上数据和文献[17]报道一致,故确定化合物5为番石榴苷(图10)。

图10 化合物5结构式Fig.10 Chemical structure of compound 5
2.1.7 化合物6
黄色粉末,盐酸-镁粉反应阳性,显红色,说明可能为一黄酮类化合物。高分辨电喷雾质谱(HR-ESI-MS):m/z 585.079 7 [M-H]-,给出化合物的分子式为C27H22O15。1H-NMR (CD3OD, 600 MHz)δ:6.18(1H, d, J=1.8 Hz, H-6)、6.36(1H, d, J=1.8 Hz, H-8)、7.60 (1H, d, J=1.8 Hz, H-2’)、6.83(1H, d, J=8.4 Hz, H-5’)、7.52 (1H, dd, J=1.8, 8.4 Hz, H-6’)、5.54 (1H, d, J=6.0 Hz, H-1’’)、7.12(2H, s, H-2’’, 6’’)。13C-NMR (CD3OD, 150 MHz)δ:158.2(C-2)、134.8(C-3)、178.9(C-4)、105.5(C-4a)、162.8(C-5)、99.5(C-6)、166.6(C-7)、94.3(C-8)、158.0(C-8a)、122.7(C-1’)、116.8(C-2’)、145.8(C-3’)、149.5 (C-4’)、116.0(C-5’)、123.0(C-6’)、100.6(C-1’’)、73.6(C-2’’)、71.5(C-3’’)、68.6(C-4’’)、65.8(C-5’)、121.1(C-1’’)、110.2(C-2’’, 6’’)、146.1(C-3’’, 5’’)、139.7(C-4’’)、167.4(C-7’’)。依据光谱分析,与文献[18]对照基本一致,确定化合物6为槲皮素-3-O-(2’-O-没食子酰基)-α-L-阿拉伯吡喃糖苷(图11)。
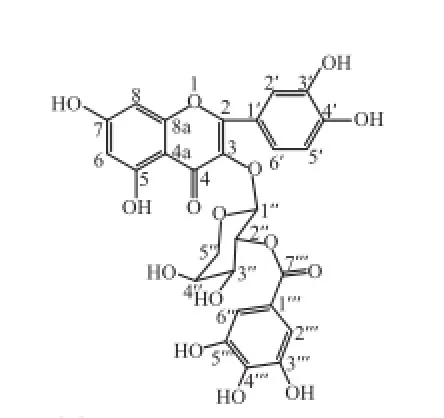
图11 化合物6结构式Fig.11 Chemical structure of compound 6
2.1.8 化合物7
黄色晶体(甲醇)与盐酸镁粉试剂呈阳性反应,三氯化铁反应阳性显墨绿色,三氯化铝反应紫外灯照射呈黄绿色荧光,提示该化合物为一黄酮类化合物。1H NMR(DMSO-d6, 600 MHz)δ:6.19(1H, d, J=1.8 Hz, H-6)、6.40(1H, d, J=1.8 Hz, H-8)、7.54(1H, d, J=2.4 Hz, H-2’)、6.87(1H, d, J=8.4 Hz, H-5’)、7.66(1H, dd, J=2.4, 8.4 Hz H-6’)。以上数据和文献[19]报道一致,并与标准品比较,确定化合物7为槲皮素(图12)。

图12 化合物7结构式Fig.12 Chemical structure of compound 7
2.1.9 化合物8
无色结晶(甲醇),薄层展开后三氯化铁显示阳性。1H-NMR(CD3OD, 600 MHz)δ:7.06(2H, s, H-2, 6)、4.26(2H, q, J=7.2 Hz, OCH2CH3)、1.34(3H, t, J= 7.2 Hz, OCH2CH3)。13C-NMR(CD3OD, 150 MHz)δ:168.7(COO-)、146.5(C-3, 5)、139.7(C-4)、121.8(C-1)、110.1(C-2, 6)、61.8(OCH2CH3)、14.6(OCH2CH3)。依据光谱分析,与文献[20]数据一致,确定化合物8为没食子酸乙酯(图13)。
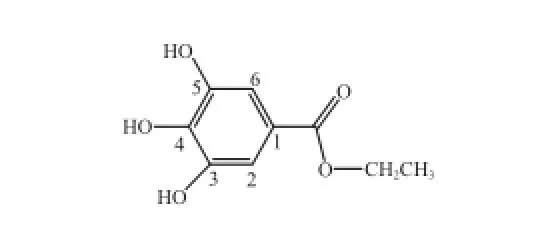
图13 化合物8结构式Fig.13 Chemical structure of compound 8
2.1.10 化合物9
无色针状结晶(甲醇),Liebermann-Burchard反应呈阳性。与齐墩果酸(图14)对照品共薄层层析,比移值完全一致。
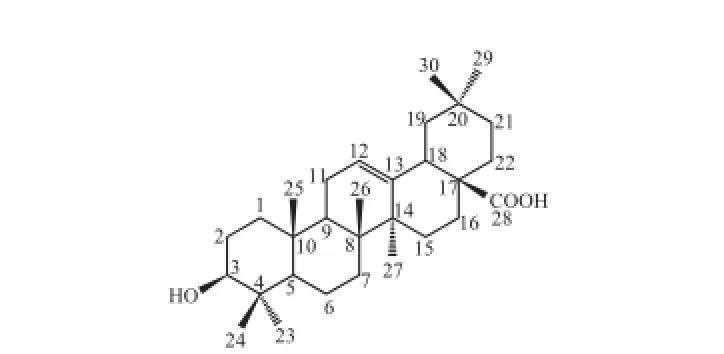
图14 化合物9结构式Fig.14 Chemical structure of compound 9
2.1.11 化合物10

图15 化合物10结构式Fig.15 Chemical structure of compound 10
无色针状结晶(甲醇),易溶于氯仿,可溶于醋酸乙酯、丙酮。Liebermann-Burchard反应呈阳性。1H-NMR(CDCl3, 600 MHz) δ:5.34(1H, m, H-6)、3.52(1H, m, H-3)、1.00(3H, s, H-19), 0.91(3H, d, J=6.6 Hz H-21)、0.79~0.86(9H, m, H-26, 27, 29)、0.67(3H, s, H-18)。13C-NMR(CDCl3, 150 MHz) δ:37.2(C-1)、 31.67(C-2)、71.8 (C-3)、42.3(C-4)、140.7(C-5)、121.7(C-6)、31.9(C-7)、31.9(C-8)、50.1(C-9)、36.5(C-10)、21.0(C-11)、39.7(C-12)、42.3(C-13)、56.7(C-14)、24.3(C-15)、28.2(C-16)、56.0(C-17)、 11.9(C-18)、19.4(C-19)、36.1(C-20)、19.0(C-21)、33.9(C-22)、29.1(C-25)、45.8(C-24)、26.0(C-23)、18.7(C-26)、19.8(C-27)、23.0(C-28)、11.8(C-29)。以上数据与文献[21]对照基本一致,故确定该化合物10为β-谷甾醇(图15)。同时对文献中碳谱数据归属错误重新进行了订正。
2.1.12 化合物12
无色油状物,香草醛浓硫酸显紫红色。EI-MS给出分子离子峰[M]+·222及[M-H2O]+·碎片离子204。1H-NMR(CDCl3, 600 MHz)δ:0.49(1H, m, H-7)、0.56(1H, m, H-8)、0.93(3H, d, J=7.2 Hz, H-15)、1.02(3H, s, H-13)、1.05(3H, s, H-12)、1.22(3H, s, H-14)。13C-NMR(CDCl3, 150 MHz)δ:55.9(C-1)、26.6(C-2)、34.6(C-3)、35.7(C-4)、37.5(C-5)、28.8(C-6)、27.1(C-7)、19.1(C-8)、42.8(C-9)、72.3(C-10)、20.5(C-11)、15.8(C-12)、28.7(C-13)、31.1(C-14)、16.5(C-15),以上数据和文献[22]报道的(-)-epiglobulol(图16)一致,另外文献[23]错误的将(-)-epiglobulol鉴定为viridif l orol。
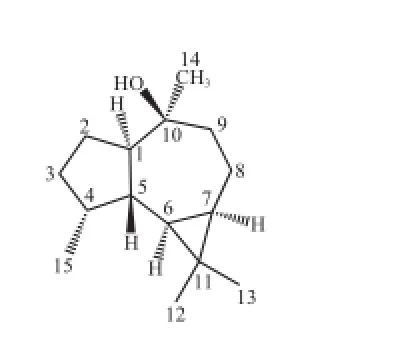
图16 化合物12结构式Fig.16 Chemical structure of compound 12
2.1.13 化合物13
无色油状物,香草醛浓硫酸显紫红色。1H-NMR(CDCl3, 600 MHz)δ:0.81(3H, d, J=7.2 Hz, H-12)、0.93(3H, d, J=7.2 Hz, H-13)、1.23(3H, s, H-14)、1.68(3H, s, H-15)、5.56(1H, m, H-5)。13C-NMR (CDCl3, 150 MHz)δ:48.3(C-1)、22.6(C-2)、30.9(C-3)、134.5(C-4)、123.0(C-5)、37.8(C-6)、46.9(C-7)、19.8(C-8)、40.4(C-9)、71.1(C-10)、26.3(C-11)、15.2(C-12)、21.5(C-13)、28.5(C-14)、23.7(C-15),以上数据和文献[24]报道的t-杜松醇(t-cadinol)(图17)一致。

图17 化合物13结构式Fig.17 Chemical structure of compound 13
2.1.14 化合物14
无色油状物,香草醛浓硫酸显蓝色。EI-MS给出分子离子峰[M]+·220及[M-H2O]+·碎片离子202。1H-NMR(CDCl3, 600 MHz)δ:0.81(3H, d, J=7.2 Hz, H-12)、0.92(3H, d, J=7.2 Hz, H-13)、1.74(3H, s, H-15)、4.79(1H, m, H-14)、5.13(1H, m, H-14)、5.52(1H, m, H-5)。13C-NMR(CDCl3, 150 MHz)δ:72.9(C-1)、25.5(C-2)、27.0(C-3)、133.6(C-4)、121.8(C-5)、48.4(C-6)、49.8(C-7)、29.8(C-8)、33.1(C-9)、154.2(C-10)、26.9(C-11)、15.2(C-12)、21.7(C-13)、105.8(C-14)、23.7(C-15),以上数据和文献[25]报道的muurola-4,10(14)-dien-1-ol(图18)一致。
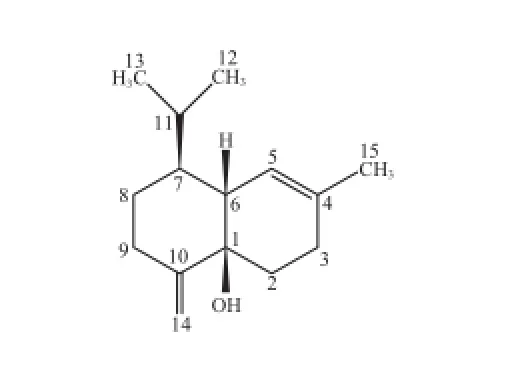
图18 化合物14结构式Fig.18 Chemical structure of compound 14
2.2 活性测定
2.2.1 葡萄糖测定标准曲线与胰岛素降糖效果
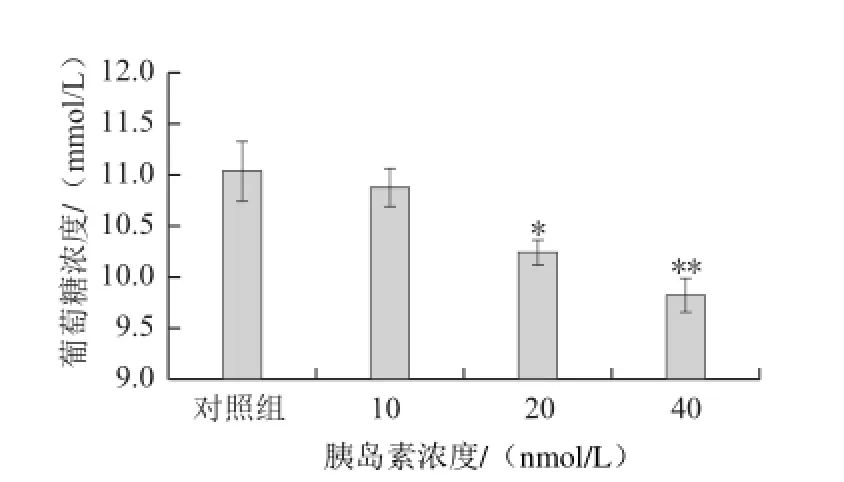
图19 胰岛素降糖结果Fig.19 Hypoglycemic activity of insulin
利用葡萄糖氧化酶法血糖测定试剂盒和酶标仪检测细胞培养液中葡萄糖浓度,其中标准曲线的回归方程为y=0.035 5x-0.019 4(R2=0.999 5),式中:x为葡萄糖浓度/(mmol/L),y为吸光度。说明通过比色测定吸收值,可准确计算出细胞培养液中葡萄糖的浓度。对建立的脂肪细胞模型,以胰岛素为阳性对照进行测试,结果如图19所示,胰岛素在10~40 nmol/L范围内能够剂量依赖性的促进脂肪细胞摄取葡萄糖,说明该模型能够用于评价化合物的促糖吸收活性。
2.2.2 乙酸乙酯萃取物和单体降糖活性
本实验对获得的5个主要黄酮苷类化合物(化合物1~5)和乙酸乙酯提取物在体外脂肪细胞模型的促葡萄糖吸收活性进行了研究,以对照组葡萄糖摄取量的基准值为0,结果见表2。
表2 乙酸乙酯萃取物和单体降糖活性Table 2 Effects of ethyl acetate extract of guava leaves and its pure compounds on glucose uptake of rat adipocytes

表2 乙酸乙酯萃取物和单体降糖活性Table 2 Effects of ethyl acetate extract of guava leaves and its pure compounds on glucose uptake of rat adipocytes
样品浓度/(μmol/L)葡萄糖摄取量/(mmol/L)样品浓度葡萄糖摄取量/(mmol/L)化合物1 10 0.12±0.013化合物4 10 μmol/L1.01±0.044 20 0.23±0.01820 μmol/L1.42±0.037 40 0.54±0.06540 μmol/L1.81±0.029化合物2 10 0.10±0.017化合物5 10 μmol/L0.98±0.054 20 0.42±0.02320 μmol/L1.50±0.023 400.50±0.18540 μmol/L1.74±0.076化合物3 10 0.28±0.022乙酸乙酯萃取物1.2 mg/mL1.75±0.04 20 0.52±0.0290.8 mg/mL0.90±0.26 40 0.79±0.0950.6 mg/mL0.80±0.10
由表2可知,番石榴中5种主要的黄酮苷类均有一定的促脂肪细胞摄取葡萄糖能力,均设定在40 μmol/L条件下比较,5种黄酮苷的降糖活性以番石榴苷、广寄生苷促糖吸收能力最强,降糖值分别为(1.74±0.076)mmol/L、(1.81±0.029)mmol/L,与1.2 mg/mL乙酸乙酯萃取物降糖能力相当,体现了这两种黄酮苷为主要降糖功能成分;而金丝桃苷、异槲皮苷、槲皮素-3-O-β-D-木糖苷降糖能力较弱,这同时也说明在这5种单体化合物中,化合物极性较低些,其降糖能力则更强些。
3 结 论
本实验对广东产番石榴叶粉末进行了化学成分研究,共分得了14种单体化合物:金丝桃苷(1)、异槲皮苷(2)、槲皮素-3-O-β-D-木糖苷(3)、广寄生苷(4)、番石榴苷(5)、槲皮素-3-O-(2’’-O-没食子酰基)-α-L-阿拉伯吡喃糖苷(6)、槲皮素(7)、没食子酸乙酯(8)、齐墩果酸(9)、β-谷甾醇(10)、isocaryolan-9-one(11)、(-)-epiglobulol(12)、t-cadinol(13)、muurola-4,10(14)-dien-1-ol(14)。其中化合物6、8、11~14为首次从该植物中分得,化合物11为一新的天然产物。从分离化合物类型来看,番石榴叶乙酸乙酯萃取物主要是以黄酮类和多酚类化合物为主,另外此次共分离得到4种倍半萜类化合物,属于杜松烷型、香木兰烷型,同时发现的由石竹烷再环化形成的新颖天然Isocaryolane型倍半萜在自然界十分罕见,加上杂萜二醛类和二苯甲酮这两类特有骨架,提示番石榴叶可能为富含多种新颖结构类型的一个化合物宝库。
考虑分离单体化合物得量与溶解性能,本实验通过建立降糖脂肪细胞模型,对番石榴叶5种主要黄酮苷的降糖活性进行了测定,结果表明5种单体均具有一定的促脂肪细胞摄取葡萄糖能力,尤其以含量最高的番石榴苷和广寄生苷的降糖效果最佳,提示可能为番石榴叶的主要降糖功能成分。
参考文献:
[1] GUTIERREZ R M, MITCHELl S, SOLIS R V. Psidium guajava: a review of its traditional uses, phytochemistry and pharmacology[J]. Journal of Ethnopharmacology, 2008, 117(1): 1-27.
[2] OH W K, LEE M S, BAE E Y, et al. Antidiabetic effects of extracts from Psidium guajava[J]. Journal of Ethnopharmacology, 2005, 96(3): 411-415.
[3] 王波, 刘衡川, 鞠长燕. 攀枝花地区野生番石榴叶不同提取物降血糖作用研究[J]. 四川大学学报: 医学版, 2005, 36(6): 858-861.
[4] 蔡丹昭, 刘华钢, 陈洪涛, 等. 番石榴叶总黄酮对实验性糖尿病小鼠血糖水平的影响[J]. 生命科学研究, 2009, 13(1): 34-37.
[5] OJEWOLE J A. Hypoglycemic and hypotensive effects of Psidium guajava Linn. (Myrtaceae) leaf aqueous extract[J]. Methods and Findings in Experimental and Clinical Pharmacology, 2005, 27(10): 689-695.
[6] 马山, 崔荣军, 郭尚福. 番石榴叶对2型糖尿病大鼠血糖的影响[J].牡丹江医学院学报, 2007, 28(6): 20-22.
[7] DEGUCHI y, MIyAZAKI K, KOUJI M. Anti-hyperglycemic and anti-hyperlipidemic effects of guava leaf extract[J]. Nutrition & Metabolism, 2010, 7(1): 9-13.
[8] 吴艳, 曲玮, 梁敬钰. 番石榴叶的研究进展[J]. 海峡药学, 2013, 25(12):14-19.
[9] RODBELL M. Metabolism of isolated fat cells I. effects of hormones on glucose metabolism and lipolysis[J]. Journal of Biological Chemistry, 1966, 239(2): 375-380.
[10] NISHIDE M, yOSHIKAWA y, yOSHIKAWA E U, et al. Insulinomimetic Zn (II) complexes as evaluated by both glucoseuptake activity and inhibition of free fatty acids release in isolated rat adipocytes[J]. Chemical & Pharmaceutical Bulletin, 2008, 56(8): 1181-1183.
[11] 杨桂枝, 高小平, 晏菊芳, 等. GOD-POD 法微量化测定方法的建立及其在3T 3-L1脂肪细胞和HepG2 细胞糖摄取中的应用[J]. 四川解剖学杂志, 2003, 11(1): 12-15.
[12] 邵萌, 范春林, 王英, 等. 番石榴叶的化学成分及药理活性研究进展[J].天然产物研究与开发, 2009, 21(3): 525-528.
[13] COLLADO I G, HANSON J R, HERNANDEZ-GALAN R, et al. Stereochemistry of a rearrangement of B and C rings in clovane skeleton[J]. Tetrahedron, 1998, 54(8): 1615-1626.
[14] 陈跃龙, 冯宝民, 唐玲, 等. 油茶叶的化学成分[J]. 沈阳药科大学学报, 2010, 27(4): 292-294.
[15] 柳建军, 刘锡葵. 黄连木食用部位化学成分研究[J]. 中草药, 2009, 40(2): 186-189.
[16] 周应军, 孙启时. 巴东栎化学成分研究[J]. 沈阳药科大学学报, 1999, 16(3): 194-197.
[17] FRAISSE D, HEITZ A, CARNAT A P, et al. Quercetin 3-arabinopyranoside, a major flavonoid compound from Alchemilla xanthochlora[J]. Fitoterapia, 2000, 71: 463-464.
[18] TETSUO I, KAWASAKI J I, TETSUO H, et al. An acylated fl avonol glycoside from Lasiobema japonica[J]. Phytochemistry, 1990, 29(3): 1013-1014.
[19] 张培成, 徐绥绪. 山楂叶化学成分研究[J]. 药学学报, 2001, 36(10): 754-757.
[20] 罗晓东, 吴少华, 马云保, 等. 椿叶的化学成分研究[J]. 中草药, 2001, 32(5): 390-391.
[21] 吴希, 夏厚林, 黄立华, 等. 香附化学成分研究[J]. 中药材, 2008, 31(7): 990-992.
[22] GIJSEN H J M, KANAI K, STORK G A, et al. The conversion of natural (+)-aromadendrene into chiral synthons-I[J]. Tetrahedron, 1990, 46(20): 7237-7246.
[23] 谈满良, 汪冶, 周立刚, 等. 蓝桉果实中的脂溶性成分[J]. 西北植物学报, 2006, 26(10): 2146-2149.
[24] 张培培, 高莎莎, 张甜甜, 等. 香血藤中倍半萜类化学成分研究[J].中国中药杂志, 2012, 37(22): 3426-3429.
[25] WEyERSTAHL P, MARSCHALL H, WEIRAUCH M, et al. Constituents of commercial labdanum oil[J]. Flavour and Fragrance Journal, 1998, 13: 295-318.
Chemical Constituents from Ethyl Acetate Extract of Psidium guajava Linn. Leaves
OUYANG Wen1, ZHU Xiao-ai2, SHAO Xiang-hui2, LIU Xiao-juan2, LIU Run-nan1, LIU Xin2, DU Fang-lu1, CAO Yong2,*
(1. School of Pharmacy, Hunan University of Chinese Medicine, Changsha 410208, China; 2. College of Food Science, South China Agricultural University, Guangzhou 510642, China)
Objective: To explore the hypoglycemic constituents of ethyl acetate extract of Psidium guajava Linn. leaves. Methods: The constituents were separated and purified by silica gel and Sephadex LH-20 column chromatography. The structures were identified on the basis of their physicochemical properties and spectral data. The hypoglycemic activities of five major flavonoid glycosides were tested in the hypoglycemic model of isolated rat adipocytes. Results: Fourteen compounds were isolated and identified as hyperoside compound (1), isoquercitrin compound (2), quercetin-3-O-β-D-xylpyranoside compound (3), avicularin compound (4), guaijaverin compound (5), quercetin 3-O-α-arabinopyranoside-2’-gallate compound (6), quercetin compound (7), ethyl gallate compound (8), oleanolic acid compound (9), β-sitosterol compound (10), isocaryolan-9-one compound (11), (-)-epiglobulol compound (12), t-cadinol compound (13), and muurola-4,10 (14)-dien-1-ol compound (14), respectively. At the same concentration of 40 μmol/L, avicularin and guaijaverin showed the most potent hypoglycemic activity among five major flavonoid glycosides with the glucose uptake value at (1.81 ± 0.029) and (1.74 ± 0.076) mmol/L respectively. Conclusions: Compounds 6, 8, 11 through 14 were isolated from this plant for the first time and compound 11 was a new natural compound. Avicularin (4) and guaijaverin (5) may be the most potent hypoglycemic compounds of guava leaves.
Psidium guajava Linn.; fl avanoids; sesquiterpenes; isocaryolan-9-one; chemical constituents; hypoglycemic activity
TS201.2
A
1002-6630(2014)15-0030-08
10.7506/spkx1002-6630-201415007
2014-03-05
国家自然科学基金青年科学基金项目(31201321);湖南省教育厅优秀青年基金项目(13B084);广州市科技计划项目(2013J4100075)
欧阳文(1981—),男,讲师,博士,研究方向为天然产物化学。E-mail:oyw810225@126.com
*通信作者:曹庸(1966—),男,教授,博士,研究方向为天然活性物质。E-mail:caoyong2181@scau.edu.cn
