玉米籽粒重金属铅(Pb2+)含量的QTL定位
2014-03-08赵雄伟林海建张志明沈亚欧潘光堂
赵雄伟,林海建,张志明,沈亚欧,潘光堂
四川农业大学玉米研究所,农业部西南玉米生物学与遗传育种重点实验室,成都611130
随着我国工业化和城市化步伐的加快,以及农药、化肥等不合理的施用,土壤重金属污染也随之加重,重金属不仅限制农作物的生长发育,更为重要的是可通过食物链传递危及到人类健康[1~3]。铅是现存环境最大量的有毒重金属污染元素,据统计,全世界每年铅生产超过 500万吨[4],也是最难控制的污染物之一,其比重高达11.34 g/cm3[5,6]。玉米是我国主要的粮食、饲料作物,以及重要的工业和食品深加工原料,然而我国、特别是西南地区种植的玉米,已日益受到重金属Pb2+的污染[7,8]。
Dai等[9]利用高浓度 Pb2+(195.55 mg/kg)处理后的土壤研究玉米品质,结果表明,对供试的25个玉米品种种植在污染土壤与未被污染土壤情况下籽粒Pb2+含量的比较,其中有12个供试品种的籽粒Pb2+含量有明显变化,且超过国家食用安全标准,而另外13个品种籽粒Pb2+含量则变化不大,且低于国家食用安全标准。金枫等[10]在高浓度 Pb2+(333.32 mg/kg)胁迫下对 12个玉米自交系及其杂交种籽粒Pb2+含量进行了测定分析,发现在籽粒 Pb2+含量未超标的杂交种中,50%的杂交种是以自交系 178为亲本之一组配的,说明自交系178在高浓度Pb2+污染下玉米籽粒 Pb2+低富集或低吸收育种的优良供体亲本。上述研究结果表明,玉米品种间对籽粒 Pb2+的吸收和富集存在着明显的差异,培育籽粒 Pb2+低富集或低吸收的玉米品种也是完全可能的。
近年来,玉米耐重金属相关QTL研究取得了一定进展。Roberta等[11]对玉米叶片中6种金属(Cu、Fe、Mn、Mg和 Sr)含量进行了 QTL定位分析,共检测到8个QTLs,分布在第1、2、3、5、8号染色体上,表型贡献率范围为 6.30%~11.00%。Dong等[12]对玉米苞叶、叶片、茎秆和籽粒的As含量进行了QTL定位分析,共定位到9个相关的QTLs,其中与籽粒相关的3个 QTLs分布在第3、5、7号染色体上,表型贡献率范围为 8.52%~10.73%;进一步研究发现,籽粒As含量跟苞叶、叶片和茎秆As含量间不存在重合QTL。因此认为作物籽粒中控制重金属含量的基因可能相对独立[13,14]。该研究结果为选育籽粒重金属低积累品种提供了新的思路。
迄今为止,国内外对玉米籽粒Pb2+含量的QTL定位研究还尚未见相关报道。本研究以本课题组[10]前期试验结果获得的玉米籽粒 Pb2+低富集的自交系178与籽粒 Pb2+高富集的自交系 9782为试验材料,构建RIL群体,采用SSR标记构建的遗传连锁图谱,对控制玉米籽粒Pb2+含量的QTL进行定位分析,旨在进一步探明玉米耐 Pb2+或籽粒 Pb2+低富集性状的遗传变异规律,为今后开展玉米耐Pb2+育种、特别是籽粒Pb2+低富集品种的分子标记辅助育种提供参考。
1 材料和方法
1.1 试验种质材料与土壤环境
本课题组通过前期研究,已筛选出的籽粒 Pb2+低富集的自交系 178与籽粒 Pb2+高富集的自交系9782为亲本,配置178×9782杂交组合,从得到的F2群体中随机抽取单株,经连续多代自交,构建了一个由 176个株系组成的RIL群体。以该群体及两亲本为本研究的试验材料。
在四川农业大学雅安多营农场内进行田间试验;土壤经风干、压碎过筛(5 mm)后测定,土壤Pb2+含量为 24.92 mg/kg,pH为 6.33,全氮、全磷、全钾的含量分别为1.70 g/kg、0.57 g/kg、13.64 g/kg;该土壤质量指标在国家土壤环境质量标准(GB15618-1995)一级限值以内,满足控制性试验的要求。
1.2 方法
1.2.1 Pb2+胁迫处理
首先将供试土壤装入塑料盆中,每盆装土壤 15 kg,然后将试验材料的种子直播于此塑料盆中,每份材料种植4盆,共712((176+2)×4)盆。待出苗长至3叶期时,每盆留取长势一致的幼苗 3株,呈三角形排列,此时向塑料盆中的土壤加入Pb(NO3)2溶液,浓度设定为 333.32 mg/kg。常规管理,人工控水,防止浇水过量使土壤中的 Pb2+外渗。玉米生长期间定期测定土壤中Pb2+浓度,通过外加Pb(NO3)2溶液的方式确保Pb2+浓度的相对稳定。
1.2.2 性状考察和籽粒Pb2+含量测定
根据亲本和RIL群体不同家系的成熟期及时收获、晒干。室内考察各株系的穗长、穗粗、行粒数、穗重和百粒重。不同株系收获后手工脱粒,在65℃烘箱中烘干至恒重,最后每份家系中均匀取一部分样品在小型万能粉碎机(型号:Z-750)上粉碎,完全过筛(20 mm),装入塑料样品袋,作为Pb2+含量的测定样品[15]。称取样品2.5 g(精确到 0.001 g)后放于三角瓶中,瓶内放3~4粒玻璃珠,加10 mL 混合酸(高氯酸和硝酸的体积比是1:4)及浓硫酸2.5 mL。置于有石棉网的电炉上进行消化,若液体变棕黑色,再加混合酸,直至冒白烟、消化液呈无色透明或略带黄色时为止,用蒸馏水少量多次的洗涤三角瓶,洗液无损地转移至25 mL容量瓶中定容至刻度、摇匀。用石墨炉(型号: GZ10-AA7003)原子吸收分光光度法测定Pb2+含量,重复测定2次。
1.2.3 遗传连锁图谱的构建和QTL分析
利用CTAB法[16]提取2个亲本自交系和176个RIL群体家系的基因组 DNA。从玉米数据库(www.maizegdb.org)中选取覆盖全基因组的1189对SSR标记,参照Senior等[17]方法进行多态性筛选,PCR扩增产物用6%的变性聚丙烯酰胺凝胶电泳,银染法检测。记录数据时,带型与母本178相同的记作1,与父本9782相同的记作2,缺失或模糊记作0,得到的SSR多态性标记用于群体的基因型分析。所有 RIL单株带型按孟德尔分离比例(1 : 1)进行卡方检验,推断标记是否存在偏分离。采用 MAPMAKER/EXP3.0b软件(LOD>3.0,重组率小于 0.5),Kosambi函数计算分子标记遗传距离(cM),用Mapchart2.2[18]绘制连锁图谱。
1.2.4 统计分析与QTL定位分析
用SPSS 20.0软件进行数据统计分析。在QTL定位时,利用Windows QTL Cartographer 2.5[19]软件,复合区间作图法(Composite interval mapping, CIM),检测运算模型标准模型6,背景标记设为5,窗口是10 cM。以LOD阈值2.5为指标来判断QTL是否存在,若标记区间中LOD>2.5,则认为该区间LOD最高处对应的位点为1个QTL,并估计各个QTL对表型变异的贡献率和加性效应。QTL命名采用McCouch等[20]原则。
2 结果与分析
2.1 玉米籽粒Pb2+含量表型分析
在高浓度Pb2+(333.32 mg/kg)土壤胁迫下,父本9782籽粒Pb2+含量为0.39 mg/kg,超过国家食品安全标准;母本178籽粒Pb2+含量为0.22 mg/kg,接近国家食品安全指标[21]。两亲本籽粒 Pb2+含量之差0.17 mg/kg,自交系9782籽粒Pb2+含量极显著高于自交系 178(|t| = 9.71>t0.01(2)=9.21)。
在RIL群体不同家系中,籽粒Pb2+含量平均值为0.46 mg/kg,变幅范围为0.11 mg/kg~1.03 mg/kg,标准差 0.025 mg/kg,变异系数为64.70%。其中有9个家系的籽粒未超过国家食品安全标准,占总家系的5.08%。该RIL群体方差分析表明(表1),不同家系的籽粒 Pb2+含量存在极显著差异,说明该性状在不同基因型间存在显著差异,受基因型影响较大。从偏度(0.65)和峰度(0.31)来看,群体内各家系的籽粒 Pb2+含量符合正态分布,出现了超亲变异。综合推测该群体籽粒中 Pb2+含量是由多个基因控制的数量性状。
2.2 遗传连锁图谱的构建
从1189对SSR引物中筛选扩增效果好、多态性明显的引物共165对,多态性比例为13.92%。根据SSR引物扩增信息,利用Mapmaker/EXP3.0b作图软件构建连锁图谱,165对SSR标记不均等的分布在玉米10条染色体上,图谱总长度为1499.85 cM,平均间距为9.07 cM,其中有142对引物间的遗传距离小于20 cM,占总引物的86.06%(图1)。另外,4对标记间的遗传距离大于30 cM,分别在2、4、5号染色体上,这可能与染色体不同位置发生交换的几率不等或者双亲在这些染色体片段上的多态性较低有关。进一步对 SSR标记进行卡平方(χ2)检验,结果表明(表2),作图所用的165个SSR标记中有131个标记符合 1 : 1的单基因理论分离比,占总标记数的79.39%;34个标记显著偏离1 : 1分离比,其中极显著偏分离标记 (P<0.01)有18个。偏向母本178的标记有13个,偏向父本9782的标记有21个,分别占偏分离总标记数的38.24%和61.76%。第6号染色体上偏分离标记所占的比例最高,占到该染色体上标记数的33.33%,第7号染色体上无偏分离标记。

表1 玉米178×9782 RIL群体Pb2+含量性状表型分析
2.3 籽粒Pb2+含量的QTL定位
以成熟期玉米籽粒 Pb2+含量两重复的平均值为表型指标,共检测到2个与籽粒中Pb2+含量相关的QTLs—qPC1和qPC4(表3)。qPC1位于第1号染色体标记 umc1661~phi002之间,邻近区间为 144.73 cM~168.19 cM,表型贡献率为11.13%,加性效应为正,其增效等位基因来自母本178;qPC4位于第4号染色体标记 umc1117~nc005之间,邻近区间为16.05 cM~24.28 cM,表型贡献率为5.55%,加性效应为负,其增效等位基因来自父本9782。
2.4 籽粒Pb2+含量与产量性状的相关性分析
对178份试验材料的籽粒Pb2+含量与其产量性状进行相关性分析,发现玉米不同基因型籽粒中Pb2+含量与穗长、穗粗、行粒数、百粒重等性状相关系数r的绝对值介于0.059~0.13之间,小于r0.05(177),均未达到显著水平,表明籽粒中 Pb2+含量与穗长、穗粗、行粒数、穗重和百粒重等产量性状无关,极有可能是受不同的基因控制。

图1 玉米178×9782RIL群体遗传连锁图谱
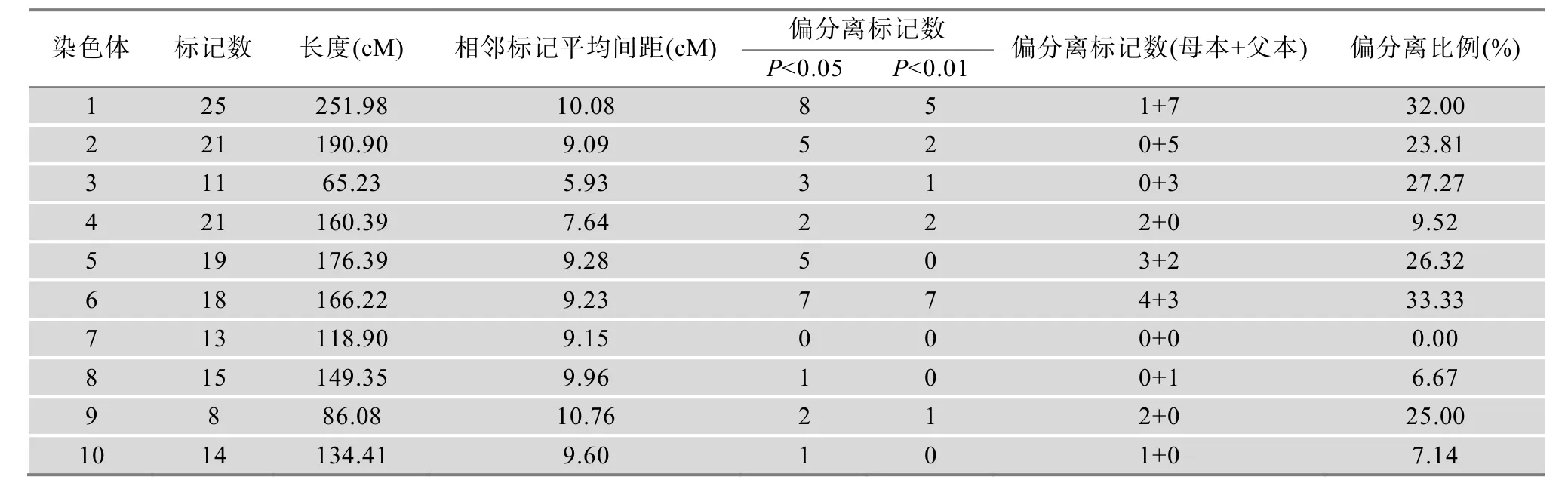
表2 染色体分布和偏分离情况

表3 玉米籽粒重金属Pb2+含量的QTL及效应
3 讨 论
籽粒中重金属Pb2+含量的高低直接关系到玉米品质优劣和食品安全,就重金属对食品的污染而言,国家出台的粮食重金属限制标准(GB2762-2005),玉米籽粒中的重金属含量不得高于国家粮食安全标准。前人研究已经表明,玉米吸收土壤中的重金属后大部分富集于根部器官,只有一小部分通过体内的共质体、质外体和导管途径运输到地上部分,体内的重金属会通过直接或间接的方式影响着玉米的生理生化;但由于不同基因型间的遗传背景与生理特性不同,从而对不同玉米品种生长发育产生伤害的程度不同[22~24]。影响玉米籽粒重金属的积累因素很多,除了土壤中重金属含量本身外, 也与同化产物积累量的多少密切相关[25]。本研究模拟了高浓度重金属Pb2+(333.32 mg/kg)污染条件,测定不同基因型玉米籽粒Pb2+含量。分析发现RIL群体间籽粒Pb2+含量差异极显著,表明完全有可能通过筛选获得籽粒 Pb2+低富集的育种种质材料,用于培育籽粒 Pb2+低富集的新品种。对籽粒中 Pb2+含量与产量性状相关性分析,发现不同基因型玉米籽粒中Pb2+含量与其穗长、穗粗、行粒数、穗重和百粒重等产量性状无关,这一结果跟 Amin等[26]研究结果一致;同时,还有多个研究者对一些玉米不同器官金属含量进行了QTL定位的研究[12,27],结果表明籽粒与其他器官之间不存在重合QTL,也从不同层面上说明控制籽粒重金属含量的基因可能是相对独立的,这些结果综合说明玉米籽粒Pb2+含量极可能是一个相对独立性状。综合结果表明通过遗传育种方法培育籽粒 Pb2+低富集且高产的新品种也是可能的。
目前,关于玉米籽粒重金属Pb2+含量的QTL定位还未见有报道。本研究用玉米籽粒 Pb2+含量两个重复的平均值为指标,LOD阈值为2.5,共检测到2个相关的QTLs(qPC1和qPC4),分别位于第1和4号染色体,表型贡献率分别为11.13%和5.55%。尽管这一结果跟Dong等[12]研究发现控制籽粒重金属砷(As)含量的QTLs存在差异,但通过网站(http://www.maizegdb.org)与本研究检测到的QTLs进行物理位置比较后发现,本研究检测到的qPC1与位于第 1号染色体上控制茎秆砷(As)含量的主效QTL(表型贡献率为 14.86%)座位相邻;而且也与周金凤等[27]研究发现位于第1号染色体控制籽粒Mn2+含量相关的主效QTL的座位相近。我们据此有理由推断,本研究所获得的位于第一条染色体上的QTL可能存在控制玉米籽粒低 Pb2+积累的基因。因此,位于第一染色体上的qPC1座位,可以用作开展玉米籽粒 Pb2+低富集新品种选育的分子辅助标记。
从本研究QTL定位结果来看,它们对表型变异的贡献率不太高,且数量少,要揭示玉米籽粒中控制 Pb2+含量遗传的分子机理还有许多基础工作要做。为此,构建高密度的遗传连锁图谱,进行多种方式的胁迫试验以及QTL定位研究是十分必要的,如在重金属 Pb2+污染的大田或水培条件下试验,采用大量不同遗传背景玉米材料或高密度的SNP分子标记来发掘稳定表达的主效低Pb2+富集QTL,对玉米遗传图谱与基因组的物理图谱进行对比,筛选、克隆、鉴定玉米耐 Pb2+或籽粒低 Pb2+积累的候选基因,以此为分子标记辅助技术选育低 Pb2+积累品种提供更科学的理论依据。
[1]Giordani C, Cecchi S, Zanchi C. Phytoremediation of soil polluted by nickel using agricultural crops.Environ Manag, 2005, 36(5): 675–681.
[2]熊严军. 我国土壤污染现状及治理措施. 现代农业科技,2010, (8): 294–297.
[3]崔斌, 王凌, 张国印, 孙世友, 耿暖, 茹淑华, 陈贵今.土壤重金属污染现状与危害及修复技术研究进展. 安徽农业科学, 2012, 40(1): 373–375.
[4]Clemens S. Toxic metal accumulation, responses to exposure and mechanisms of tolerance in plants.Biochimie,2006, 88(11): 1707–1719.
[5]张继舟, 王宏韬, 倪红伟, 马献发, 袁磊. 我国农田土壤重金属污染现状、成因与诊断方法分析. 土壤与作物,2012, 1(4): 212–218.
[6]张庆辉, 王贵, 赵捷, 丛艳静, 田海文, 程莉. 农田表层土壤重金属铅背景值调查与评价. 阴山学刊(自然科学版), 2008, 22(2): 28–31.
[7]曹莹, 黄瑞冬, 蒋文春, 曹志强. 重金属铅和镉对玉米品质的影响. 沈阳农业大学学报, 2005, 36(2): 218–220.
[8]刘树庆, 谢建治, 张书廷. 潮褐土重金属污染对小白菜营养品质指标的影响. 农业环境科学学报, 2004, 23(4):678–682.
[9]Dai QL, Yuan JG, Fang W, Yang ZY. Differences on Pb2+accumulation among plant tissues of 25 varieties of maize(Zea mays).Frontiers of Biology in China, 2007, 2(3):303–308.
[10]金枫. 玉米自交系的铅抗性及铅积累的遗传效应研究[学位论文]. 雅安: 四川农业大学, 2010.
[11]Roberta S, Tatjana L, Zvonimir Z, Antun J, Ivan B, Zdenko L, Vlado K, Domagoj Š. Quantitative trait loci for metal accumulation in maize leaf.Maydica, 2011, 56(4): 323–329.
[12]Dong D, Li W, Song G, Qi HY, Liu JB, Tang JH. Identification of QTLs for arsenic accumulation in maize (Zea maysL.)using a RIL population.PLoS ONE, 2011, 10(6): e25646.
[13]陈志德, 王州飞, 贺建波, 仲维功, 王军, 杨杰, 张红生.水稻糙米重金属 Cd2+含量的 QTL分析. 遗传, 2009,31(11): 1135–1140.
[14]Soric R, Loncaric Z, Kovacevic V, Brkic I, Simic D. A major gene for leaf cadmium accumulation in maize (Zea maysL.). In: The Proceedings of the International Plant Nutrition Colloquium XVI, 2009.
[15]杨欢春, 杨翠青, 陆凯南. 石墨炉原子吸收法测定食品中铅的分析. 现代医药卫生, 2007, 23(24): 3750–3751.
[16]Saghai-Maroof MA, Soliman KM, Jorgensen RA, Allard RW. Ribosomal DNA spacer-length polymorphisms in barley: Mendelian inheritance, chromosomal location, and population dynamics.Proc Natl Acad Sci USA, 1984, 81(24):8014–8018.
[17]Senior ML, Heun M. Mapping maize microsatellites and polymerase chain reaction confirmation of the targeted repeats using a CT primer.Genome, 1993, 36(5): 884–889.
[18]Voorrips RE. MapChart: software for the graphical presentation of linkage maps and QTLs.J Heredity, 2002, 93(1):77–78.
[19]Wang S, Basten CJ, Zeng ZB. Windows QTL cartographer 2. 5. Department of Statistics. Raleigh, NC: North Carolina State University, 2007.
[20]McCouch R S, Cho Y C, Yano M, Linstrub M, Morishima H, Kinoshita T. Report on QTL nomenclature.Rice Gent Newl, 1997, 14(11): 11–13.
[21]孟菲. 我国与国际组织和发达国家食品安全标准的对比分析. 粮食加工, 2011, 36(5): 1–4.
[22]Marmiroli N, Maestri E. Health implications of trace elements in the environment and the food chain. In: Prasad MNVed. Trace Elements As Contaminants and Nutrients.Consequences in Ecosystems and Human Health. New York: Wiley, 2008: 25–34.
[23]Maksymiec W. Signaling responses in plants to heavy metal stress.Acta Physiol Plantarum, 2007, 29(3): 177–187.
[24]Chattopadhyay S, Fimmen RL, Yates BJ. Phytoremediation of mercury and methyl mercury-contaminated sediment by waterhyacinth (Eichhoria crassipes).Int J Phytoremediation, 2011, 14(2): 142–161.
[25]程旺大, 张国平, 姚海根, 王润屹. 晚粳稻籽粒中砷、镉、铬、镍、铅等重金属含量的品种和粒位效应. 中国水稻科学, 2005, 19(3): 237–239.
[26]Amin AW, Sherif FK. Heavy metal contents in maize as affected by sewage sludge application: I-Morphological characters and yield.Pakistan J Biol Sci, 2001, 4(12): 1451–1455.
[27]周金凤, 黄亚群, 刘志增, 陈景堂, 祝丽英, 宋占权, 赵永锋. 玉米子粒中锌及铁铜锰含量的遗传及 QTL分析.植物遗传资源学报, 2010, 11(5): 593–595.
