盐酸丁咯地尔滴剂的制备及质量分析
2014-03-08曹春泉宋冶萍孙新堂杨瑞锋肖华平
魏 培,曹春泉,宋冶萍,孙新堂,杨瑞锋,肖华平
(1.山东畜牧兽医职业学院食品与药品科技系,山东潍坊261061;2.菏泽学院药物科学与技术系,山东菏泽274000)
盐酸丁咯地尔滴剂的制备及质量分析
魏 培1,曹春泉2,宋冶萍1,孙新堂1,杨瑞锋1,肖华平1
(1.山东畜牧兽医职业学院食品与药品科技系,山东潍坊261061;2.菏泽学院药物科学与技术系,山东菏泽274000)
目的制备盐酸丁咯地尔滴剂并进行质量分析。方法采用阿司帕坦、丙二醇、Pluronic F-127为辅料,通过处方筛选,制备盐酸丁咯地尔滴剂,从性状、鉴别、检查、含量测定等方面对其进行质量分析。结果所制备盐酸丁咯地尔滴剂为淡黄色澄清液体,其鉴别、检查、含量测定均符合要求。结论制剂口感良好,且性质稳定,生产工艺简便,所建立的质量分析方法简便、准确、可靠。
盐酸丁咯地尔滴剂;制备,质量分析
盐酸丁咯地尔(Buflomedil Hydrochloride)为血管扩张剂,具有选择性血管扩张作用,可改善大脑和上肢及下肢的微循环,改善局部缺血区受损血管床的微血管循环灌注作用,可显著增加脑局部血流量,在增加局部动脉血流量的同时,对中枢血流动力学无影响[1]。动物实验证明,本品有减少耗氧量的作用,抑制血小板凝聚作用,抑制红细胞Ca2+内流,使红细胞变形性恢复正常,促进红细胞进入血管,改善缺血组织氧的摄取[2]。临床主要用作脑局部和外周动脉血管因微循环障碍造成的功能不全性疾病。经临床双盲对照研究表明,本品对脑血管功能不全性老年性痴呆症有明显疗效;对外周微循环障碍性疾病及失眠、耳鸣眩晕、记忆力衰退等症有较好疗效;对雷诺氏症、间歇性跛行、肢体血栓闭塞性脉管炎、动脉炎等症亦有明显改善[3]。本品与其他血管活性剂药物比较,具有毒性低、副作用小、生产工艺简便、成本低等特点。
本品首先由法国Lafon公司开发,目前已在英国、意大利、美国、日本、德国等30多个国家上市,由于其疗效显著、独特而备受关注,在欧美市场已成为畅销药品[4]。国内齐鲁药厂、齐都药业股份有限公司已完成本品原料药、片剂和注射剂的研究亦于1998年先后已上市,由于片剂中处方因素与制备工艺因素等对药物吸收的影响,致使生物利用度的差异影响疗效;注射剂制备工艺较复杂,生产成本高,临床采用静脉注射或滴注给药,对于慢性病的治疗,用药不方便,病人依从性差。国外意大利罗马福斯卡玛生化制药公司已开发研究上市“IRRODAN滴剂”,有效成分盐酸丁咯地尔浓度为150 mg·mL-1,规格为30 mL/瓶,每日2~4 mL(300~600 mg),溶于水中,分次服用。目前,国内尚无盐酸丁咯地尔滴剂生产、销售及研究报导,根据国外盐酸丁咯地尔滴剂规格及临床用药情况,我们设计规格为150 mg·mL-1(30 mL/瓶),每天2~4 mL(300~600 mg)的滴剂。本品药物浓度高,体积小,服用方便,药物以分子状态分散在溶液中,较片剂更容易吸收,几乎不存在生物利用度方面的问题;较注射剂生产工艺简便,生产成本低廉,用药更方便,特别是本品主要用于慢性疾病的治疗,病人依从性更好;更方便临床医师根据病情调整用药,更易推广。
1 仪器与材料
1.1 仪器 LC-10AT高效液相色谱仪,SPD-10A紫外检测器(日本岛津);TU-1801紫外分光光度计(北京普析通用仪器有限公司);EST-D4型定时恒温磁力搅拌器(上海雷磁仪器厂);PHS-25型精密pH计(上海雷磁仪器厂);电子天平(上海天平);电磁超声器(上海科导超声仪器有限公司)。
1.2 材料 盐酸丁咯地尔原料药(齐鲁制药有限公司,纯度98.6%,批号:130615);盐酸丁咯地尔对照品(上海瑞齐生物科技有限公司,批号:130927);阿司帕坦(常州法码泰克药用辅料有限公司,批号:140225);丙二醇(天津市大茂化学试剂厂,批号:131012);Pluronic F-127(Sigma制剂公司),其他试剂均为分析纯。
2 方法与结果
2.1 盐酸丁咯地尔滴剂的制备 取新鲜蒸馏水2 000 mL,加入Pluronic F-127 90 g溶解,过滤,加入处方量丙二醇、阿司帕坦溶解,加热至45~50℃,加入处方量盐酸丁咯地尔溶解,搅拌混匀,测定pH及含量,加新鲜蒸馏水至足量,过滤(垂熔玻璃滤球G3)至澄明,100℃45 min灭菌,无菌分装于经处理的灭菌玻璃瓶中(每瓶30 mL)。
2.2 质量分析
2.2.1 性状 盐酸丁咯地尔原料药为白色粉末,试制3批样品(批号:20140520、20140521、20140522)均为淡黄色的澄清液体,因此,将本品性状定为淡黄色澄清液体。
2.2.2 鉴别 ①取本品适量,加水制成每1 mL中约含盐酸丁咯地尔25μg的溶液,照分光光度法[《中国药典》2010年版(二部)附录ⅣA]测定,在282 nm的波长处有最大吸收,在249 nm的波长处有最小吸收。②在含量测定项下记录的色谱图中,供试品主峰的保留时间应与对照品主峰的保留时间一致。
2.2.3 检查
2.2.3.1 pH值的检查 3批样品(批号:20140520、20140521、20140522)的pH值分别为4.79、4.73和4.82。
2.2.3.2 有关物质及其方法学研究[5]照高效液相色谱法[《中国药典》2010年版(二部)附录ⅤD]测定。
色谱条件:同含量测定项下色谱条件。
系统适用性试验:同含量测定项下系统适应性试验。
专属性试验:为考察盐酸丁咯地尔有关物质检查法的可行性,本品采用酸、碱、氧化、热及光破坏性试验。称取本品适量用流动相制成10 mg·mL-1的溶液,分别量取1 mL置于5个10 mL的容量瓶中,分别向其加入1 mL 0.1 mol·L-1HCl、1 mL 0.1 mol·L-1NaOH、1滴0.1%KMnO4溶液、适量的流动相于100℃水浴煮沸1.5 h及强光照射后,用0.1 mol·L-1HCl和0.1 mol·L-1NaOH调节pH至中性,流动相稀释至刻度,进样20μL,记录色谱图。结果表明,经以上条件破坏,降解产物峰之间、降解产物峰与主峰之间均能分离良好,本方法专属性好,其中酸破坏性试验条件下降解产物峰与主峰分离度最大。
空白辅料干扰试验:按处方比例配制空白辅料溶液,进样20μL,得空白辅料色谱图,结果表明辅料不干扰盐酸丁咯地尔的测定。
最小检出限:精密称取盐酸丁咯地尔对照品适量,加流动相溶解并稀释至浓度为15 ng·mL-1,进样使主成分峰为基线噪音的2倍。因此,将其最小检出限定为15 ng·mL-1,记录色谱图。
有关物质的测定方法:取本品适量用流动相配制成10 mg·mL-1的溶液,量取1 mL,置于10 mL容量瓶中,用流动相稀释至刻度,作为供试液,即有关物质的高浓度溶液;从供试液中量取1 mL置于100 mL容量瓶中,用流动相稀释至刻度,作为对照液,即有关物质的低浓度溶液。
照上述色谱条件试验,精密量取上述对照溶液20μL,进行预试验,调节灵敏度,使主成分色谱峰的峰高为满量程的20%~25%;再取供试品溶液与对照液各20μL,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的2倍。量取各杂质峰面积之和,不得大于对照溶液主成分峰面积的2倍(2.0%)。
取3批样品(批号:20140520,20140521,20140522)按照上述方法进行测定,记录色谱图,结果见表1。

表1 3批样品有关物质测定结果
结果表明,3批样品的有关物质均小于2.0%,符合要求。
2.2.4 含量测定[6]
2.2.4.1 方法 照高效液相色谱法[《中国药典》2010年版(二部)附录ⅤD]测定。
色谱条件与系统适应性试验:用十八烷基硅烷键合硅胶为填充剂;以甲醇-水-冰醋酸-三乙胺(250∶300∶0.8∶1.0)为流动相;检测波长为282 nm;流速为1.0 mL·min-1;进样量为20μL;理论塔板数按盐酸丁咯地尔峰计算应不低于2 000,盐酸丁咯地尔峰及其他杂质峰的分离度应符合要求。
测定方法:精密量取本品适量(约相当于盐酸丁咯地尔50 mg),用流动相制成每1 mL含50μg的溶液,摇匀,精密量取20μL,注入液相色谱仪,记录色谱图;另取盐酸丁咯地尔对照品约50 mg,同法测定,按外标法以峰面积计算,即得。
2.2.4.2 方法的建立 采用高效液相色谱法[《中国药典》2010年版(二部)附录ⅤD]测定含量。
系统适应性试验:取盐酸丁咯地尔对照品,精密称定,加流动相适量使之溶解,并定量稀释成浓度为10μg·mL-1的溶液,检测波长:282 nm,进样20 μL,记录色谱图。结果表明,盐酸丁咯地尔峰理论塔板数约为2 100,符合要求,与其他峰的分离度为亦符合要求。
检测波长的确定:取盐酸丁咯地尔对照品50 mg,置100 mL量瓶中,用流动相溶解并稀释至刻度,摇匀,吸取5.0 mL,于100 mL量瓶中,用流动相稀释至刻度,摇匀,以流动相为空白,照分光光度法[《中国药典》2010年版(二部)附录ⅣA],于200~400 nm范围内进行紫外扫描,记录图谱,发现在282 nm处有最大吸收,因此本品选择282 nm为测定波长。
工作曲线的绘制:精密称取盐酸丁咯地尔对照品50 mg,于100 mL容量瓶中,用流动相溶解并稀释至刻度,摇匀,精密量取1、3、5、7、9 mL,分别置50 mL容量瓶中,流动相稀释至刻度,摇匀,分别精密量取20μL进样,记录色谱图,结果见表2。

表2 盐酸丁咯地尔含量测定工作曲线测定结果
以峰面积对浓度(μg·mL-1)进行线性回归,得回归方程为:

结果表明,盐酸丁咯地尔在10~90μg·mL-1浓度范围内线性关系良好。
精密度试验:精密称取盐酸丁咯地尔对照品50 mg,于100 mL容量瓶中,用流动相溶解并稀释至刻度,摇匀,精密量取上述溶液5 mL,于50 mL容量瓶中,流动相稀释至刻度,分别精密量取20μL连续进样5次,记录色谱图,结果见表3。

表3 盐酸丁咯地尔含量测定精密度试验结果
结果表明本法精密度良好。
稳定性试验:精密称取盐酸丁咯地尔对照品50 mg于100 mL容量瓶中,用流动相溶解并稀释至刻度,摇匀,精密量取上述溶液5 mL,于50 mL容量瓶中,流动相稀释至刻度,分别精密量取20μL于0、2、4、6、8 h分别进针,结果见表4。
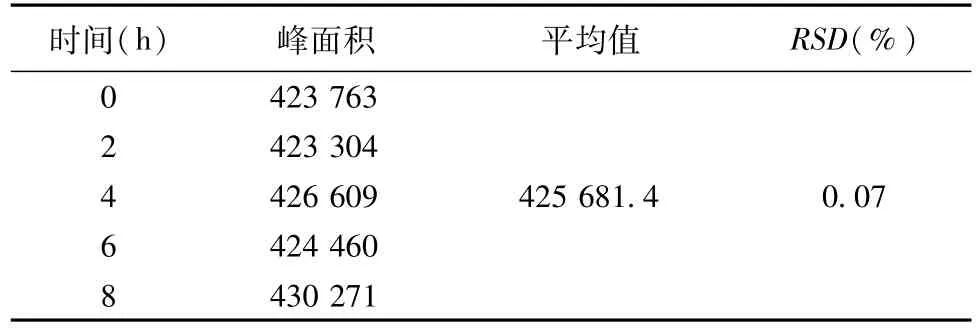
表4 盐酸丁咯地尔含量测定稳定性试验结果
结果表明本方法8 h内稳定性良好。
回收率试验:精密称取盐酸丁咯地尔对照品50 mg,于100 mL容量瓶中,用流动相溶解并稀释至刻度,摇匀,分别精密量取4、5、6 mL各3份,于9个50 mL的容量瓶中,加入处方量空白辅料,流动相稀释至刻度,分别精密量取20μL注入液相色谱仪,记录色谱图。
同时精密称取盐酸丁咯地尔对照品50 mg,于100 mL容量瓶中,用流动相溶解并稀释至刻度,摇匀,精密量取5 mL,于50 mL容量瓶中,流动相稀释至刻度,分别精密量取20μL注入液相色谱仪,记录色谱图,结果见表5。

表5 盐酸丁咯地尔含量测定回收率试验结果

续表5:
结果表明3种浓度下方法回收率满足要求。
2.2.4.3 含量测定结果
本品3批(批号:20140520、20140521、20140522)含量测定结果见表6。

表6 3批样品含量测定结果
结果表明:本品3批含量测定均符合规定。
3 讨论
3.1 处方筛选过程中,根据辅料的矫味作用,对含量测定的影响,对溶解度的影响及配制工艺等方面综合确定最佳处方工艺。处方中的丙二醇与阿司帕坦配合矫味增加甜度;同时丙二醇与水组成溶剂使盐酸丁咯地尔更易分散、湿润、溶解,且15%~30%的丙二醇具有防腐作用,是常用口服液体制剂的溶剂;Pluronic F-127在处方中用作增溶剂和稳定剂,同时Pluronic F-127作为表面活性剂具有促进药物吸收等多种作用;由于本品浓度较高,不利于微生物生长,且处方中含20%丙二醇具有防腐作用,因此处方中不需加防腐剂,制剂口感较好,且性质稳定,生产工艺简便。
3.2 依据《中国药典》2010年版及制备的盐酸丁咯地尔滴剂的规格、特点,从性状、鉴别、检查、含量测定等方面对其进行质量分析,结果准确、可靠。本品在282 nm波长处有最大吸收,在249 nm波长处有最小吸收;在含量测定项下记录的色谱图中,供试品主峰保留时间与对照品保留时间一致,两法均具有较好的专属性,可用于本品的鉴别。
[1]Ehrly AM,Saeger-Lorenz k.Exercise-induced variations in muscle tissue oxygen pressure in claudicants:effects of buflomedil[J].Blood Vessels,1991,28(1):27-32.
[2]陈新谦,金有豫,汤光.新编药物学[M].第16版.北京:人民卫生出版社,2007:305.
[3]White C.Clinical practice.Intermittent claudication[J].N Engl JMed,2007,356(12):1241-1250.
[4]袁洪雨,董旭.盐酸丁咯地尔的临床应用研究[J].齐鲁药事,2010,29(3):165-167.
[5]何庆园,王桂珍.HPLC法检查盐酸丁咯地尔中有关物质[J].江苏药学与临床研究,1999,7(2):20-21.
[6]杭太俊,谭涌霞,刘洁.HPLC法测定盐酸丁咯地尔注射液的含量与杂质[J].中国药师,2001,4(1):22-24.
The preparation and quality analysis of Buflomedil Hydrochloride Drops
WEIPei1,CAO Chun-quan2,SONG Ye-ping1,SUN Xin-tang1,YANG Rui-feng1,XIAO Hua-ping1
(1.The Food and Drug Department of Science and Technology,Shandong Vocational Animal Science and Veterinary College,Weifang 261061,China;2.Medical Science and Technology Department,Heze University,Heze274000,China)
ObjectiveTo prepare Buflomedil Hydrochloride Drops,and analyse its quality.MethodsThrough formulation screening with aspartame,propylene glycol and Pluronic F-127.And to analyze the quality of buflomedil hydrochloride drops from nature,appreciation,inspection and assaying.ResultsThe Buflomedil Hydrochloride Drops was light yellow clear liquid,and its appreciation,inspection and assaying allmet the requirements.ConclusionThe preparation had good taste,stable nature and convenientmanufacturing technique.The quality analysismethod established was convenient,precise and reliable.
Buflomedil Hydrochloride Drops;Preparation;Quality analysis
R944
:A
2095-5375(2014)07-0395-004
魏培,女,讲师,研究方向:药物新剂型,E-mail:108584969@qq.com
