微孔过滤对茶叶儿茶素类和生物碱HPLC检测的影响
2014-03-07王丽丽杨军国陈键宋振硕陈林
王丽丽,杨军国,陈键,宋振硕,陈林
(福建省农业科学院茶叶研究所,福建 福安 355015)
微孔过滤对茶叶儿茶素类和生物碱HPLC检测的影响
王丽丽,杨军国,陈键,宋振硕,陈林*
(福建省农业科学院茶叶研究所,福建 福安 355015)
本试验分别选用4种不同材质[尼龙66(NL 66)、聚醚砜(PES)、混合纤维素(MCE)和聚四氟乙烯(PTFE)]滤膜过滤茶样浸提液,考察微孔滤膜过滤对茶叶中没食子酸、儿茶素类和嘌呤碱HPLC分析检测的影响。结果表明同种材质滤膜连续过滤获得3瓶滤液(约1 mL/瓶)中的没食子酸和生物碱含量基本相当;尼龙66滤膜过滤液中的儿茶素含量存在较大的瓶间差异,但PES、MCE和PTFE滤膜过滤液并无明显的先后差别。由此可见,PES、MCE和PTFE等是茶样浸提液净化预处理较为适宜的滤膜材质,而吸附作用则可能是引起NL 66滤膜过滤液中儿茶素类含量测定结果不一致的主要原因。
微孔滤膜;茶叶;儿茶素类;生物碱;HPLC
微孔滤膜常用于高效液相色谱法过滤待测液和流动相,以去除微粒杂质,防止堵塞损坏色谱柱,常用孔径为0.45 μm或0.22 μm[1]。依据其材质可分为水系膜、有机系膜和通用性膜,通常根据待测靶标物提取溶剂的不同来选择适宜材质的微孔滤膜。目前,市面上常见微孔滤膜有尼龙膜(NL 66)、聚四氟乙烯膜(PFTE)、聚偏氟乙烯膜(PVDF)、混合纤维素膜(MCE)和聚醚砜膜(PES)等多种,适用于绝大多数有机溶剂和(或)水溶液的过滤[2]。高效液相色谱法是目前茶叶儿茶素含量测定的主要方法[3],其浸提液过滤所涉及到的滤膜材质包括尼龙[4-6]、混合纤维素酯[7]、硝酸纤维素[8]和聚丙烯酸[9]等,而多数方法则较少提及滤膜材质,仅注明需用“微孔滤膜”[10-13]或“水系滤膜”[14]。笔者通过前期试验发现,经不同材质滤膜过滤后,茶汤中儿茶素类物质含量的测定结果不相一致,甚至个别滤材对检测结果影响很大。因此本试验比较了尼龙66(NL 66)、聚四氟乙烯(PTFE)、聚醚砜(PES)和混合纤维素酯(MCE)4种材质滤膜过滤对茶叶中没食子酸(GA)、8种儿茶素(EGC、EGCG、EC、ECG、GC、GCG、C与CG)与3种生物碱(TP、CAF与TB)HPLC检测的影响,并筛选出较为适宜的滤膜材料,旨在为茶叶中儿茶素含量的准确测定以及保证不同实验室研究结果的可比性提供参考依据。
1 材料与方法
1.1 材料与仪器
供试茶样为自制绿茶,以福云6号一芽二叶新梢为原料,在福建省农业科学院茶叶研究所加工车间制作,加工工艺为:摊放→杀青→揉捻→干燥。表儿茶素(epicatechin,EC)、表没食子儿茶素(epigallocatechin,EGC)、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)、表儿茶素没食子酸酯(epicatechin gallate,ECG)、没食子酸(gallic acid,GA)、可可碱(theobromine,TB)和咖啡碱(caffeine,CAF)购自阿拉丁(试剂)上海有限公司,纯度均>98%;茶碱(theophylline,TP)、没食子儿茶素(gallocatechin,GC)和没食子儿茶素没食子酸酯(gallocatechin gallate,GCG)购自上海阿达玛斯有限公司,纯度均>98%;儿茶素
(catechin,C)和儿茶素没食子酸酯(catechin
gallate,CG)购自美国Sigma公司,纯度>98%;甲醇(色谱纯,Sigma-Aldrich);甲酸溶液(色谱纯,49%~51%(T),Fluka);乙腈(分析纯,上海国药)。
美国Agilent 1260型液相色谱系统,包括四元泵(G1311C VL)、标准自动进样器(G1329B)、柱温箱(G1316A)和二极管阵列检测器(G1315D
VL);TSKgel ODS-100Z色谱柱(4.6 mm×150 mm,5 μm,日本Tosoh);ACD-0502-U实验室超纯水系统(重庆颐洋);A11 basic分析用研磨机和MS3 basic小型涡旋混合器(德国IKA);DHC-9246A电热恒温鼓风干燥箱(上海精宏);KQ5200DV超声波清洗器(江苏昆山超声);SKY-200B恒温摇床(上海苏坤);DK-8D型电热恒温水浴槽(上海一恒);有机系NL 66滤膜(国产津腾与美国进口PALL 2种,0.45 μm)、水系MCE滤膜(TROODY,0.45 μm)、水系PES滤膜(津腾,0.45 μm)和通用性PTFE滤膜(TROODY,0.45 μm)等。
1.2 试验方法
1.2.1 茶样预处理
采用以下2种方法提取茶样。1)乙腈浸提法:准确称取磨碎茶样0.200 g,加50%乙腈10 mL,超声混匀5 min,30℃振荡浸提40 min。2)纯水浸提法:准确称取磨碎茶样0.200 g,加沸水10 mL,涡旋混匀,沸水浴浸提30 min。待提取完毕,将浸提液转移至10 mL容量瓶,少量提取液润洗瓶壁,定容。取上述溶液适量,用流动相A稀释10倍后过滤。乙腈浸提液采用有机系NL 66滤膜(国产津腾牌与美国进口PALL牌2种)与通用性PTFE滤膜过滤,纯水浸提液采用水系滤膜(PES和MCE 2种材质)以及通用性PTFE滤膜过滤。具体步骤为:一次性注射器移取浸提液适量,使用上述指定滤膜将其依次过滤至3个样品瓶内,过滤量约1mL/瓶,并分别编号为No.1、No.2和No.3。
1.2.2 色谱条件
色谱柱:TSKgel ODS-100Z;流动相由0.2%(v/v)甲酸水溶液(A相)和甲醇(B相)组成;梯度洗脱程序:83%A(0 min)→55%A(16 min)→83%A(18 min)→83%A(21 min);进样量10 μL;柱温40℃;流速1 mL/min;检测波长280 nm。
2 结果与分析
2.1 有机系膜过滤对茶叶儿茶素类与生物碱分析测定的影响
50%乙腈提取茶样,并选用国产津腾牌与进口PALL牌2种品牌的有机系NL 66滤膜过滤浸提液,HPLC法测定其没食子酸、儿茶素类和嘌呤碱含量。从表1可以看出,采用2种NL66滤膜过滤后,12种茶叶组分含量平均值无明显差异,说明这2种品牌的NL66滤膜对HPLC测定的茶叶组分含量影响甚小。结果还表明,浸提液经NL66滤膜连续过滤的3瓶滤液中,GA、TB、TP与CAF组分测得含量无明显差异,而8种儿茶素组分含量呈增加趋势,如GC、C、EGCG与ECG,国产膜过滤后的含量分别从0.397 mg/g、0.957 mg/g、8.463 mg/g、2.812 mg/g增加至0.612 mg/g、1.608 mg/g、33.469 mg/g、12.050 mg/g,即依次增加0.54倍、0.68倍、2.95倍、3.29倍;进口膜过滤后的含量分别从0.339 mg/g、0.942 mg/g、9.566 mg/g、2.799 mg/g增加至0.665 mg/g、1.610 mg/g、30.353 mg/g、10.478 mg/g,即依次增加0.96倍、0.71倍、2.17倍、2.74倍。分析茶叶组分含量变化原因,可能与NL 66滤膜对儿茶素类物质吸附作用相关,随着对其吸附饱和,滤液中儿茶素类含量逐步增加,而这种滤膜对GA、TB、TP与CAF组分吸附极低。因此,采用尼龙66滤膜过滤后滤液中儿茶素类含量降低,从而影响了HPLC法检测结果的准确性。

表 1 尼龙66滤膜(国产与进口2种)对茶叶中12种组分HPLC检测的影响 (单位:mg/g)Table 1 Effects of NL66 membrane(domestic and imported)microfiltration on HPLC determination of 12 compositions in tea
2.2 水系膜过滤对茶叶儿茶素类与生物碱分析测定的影响
茶样经纯水提取后,采用PES与MCE 2种水系膜过滤,HPLC法测定茶叶组分结果见表2。结果表明,PES与MCE 2种滤膜分别过滤的3瓶滤液中,HPLC法测定的茶叶没食子酸、儿茶素类和生物碱碱含量基本无差异,说明这2种水系滤膜对所测茶叶组分无吸附或吸附小。但相对来说,采用PES滤膜过滤后,滤液中EGCG、GCG、ECG和CG组分含量No.1比No.2和No.3均小,说明PES滤膜首次使用时对酯型儿茶素类有少量吸附,鉴于酯型儿茶素是茶叶儿茶素类的主要组分,可能会导致测定结果稍有偏差。而MCE膜过滤的3瓶滤液中,所测12个组分含量基本无差异,表明MCE滤膜不会影响HPLC测定结果的准确性。鉴于此,HPLC法测定纯水浸提的儿茶素等茶叶组分时,MCE滤膜稍好于PES滤膜,考虑到成本因素,使用PES滤膜时可预先用少量浸提液润洗滤膜,以减少吸附作用带来的不良影响。
2.3 通用性膜过滤对茶叶儿茶素类与生物碱分析测定的影响
同时,试验考察了通用性膜PTFE滤膜对HPLC法测定茶样中儿茶素类与生物碱含量的影响(表3)。结果表明,经有机溶剂或纯水提取、PTFE滤膜过滤后,3瓶滤液中茶叶组分含量值无明显差异,说明PTFE滤膜对儿茶素类与生物碱均无吸附,不会对HPLC法测定结果的准确性造成影响。从结果来看,2种提取法所得的浸提液中茶叶组分含量有较大差别,如GC、C、GCG、CG与CAF,其平均值分别为0.530 mg/g(50%乙腈浸提,下同)与9.275 mg/g(纯水浸提,下同),1.610 mg/g与3.394 mg/g,ND与16.828 mg/g,ND与3.173 mg/g以及16.085 mg/g与28.406 mg/g,相差1倍以上。这主要是由于提取溶剂、温度、料液比等不同所致,与滤膜材质无关。

表 2 水系膜(PES和MCE 2种材质)对茶叶中12种组分HPLC检测的影响 单位:mg/gTable 2 Effects of 2 kinds of aquo membrane(PES and MCE)microfiltration on HPLC determination of 12 compositions in tea
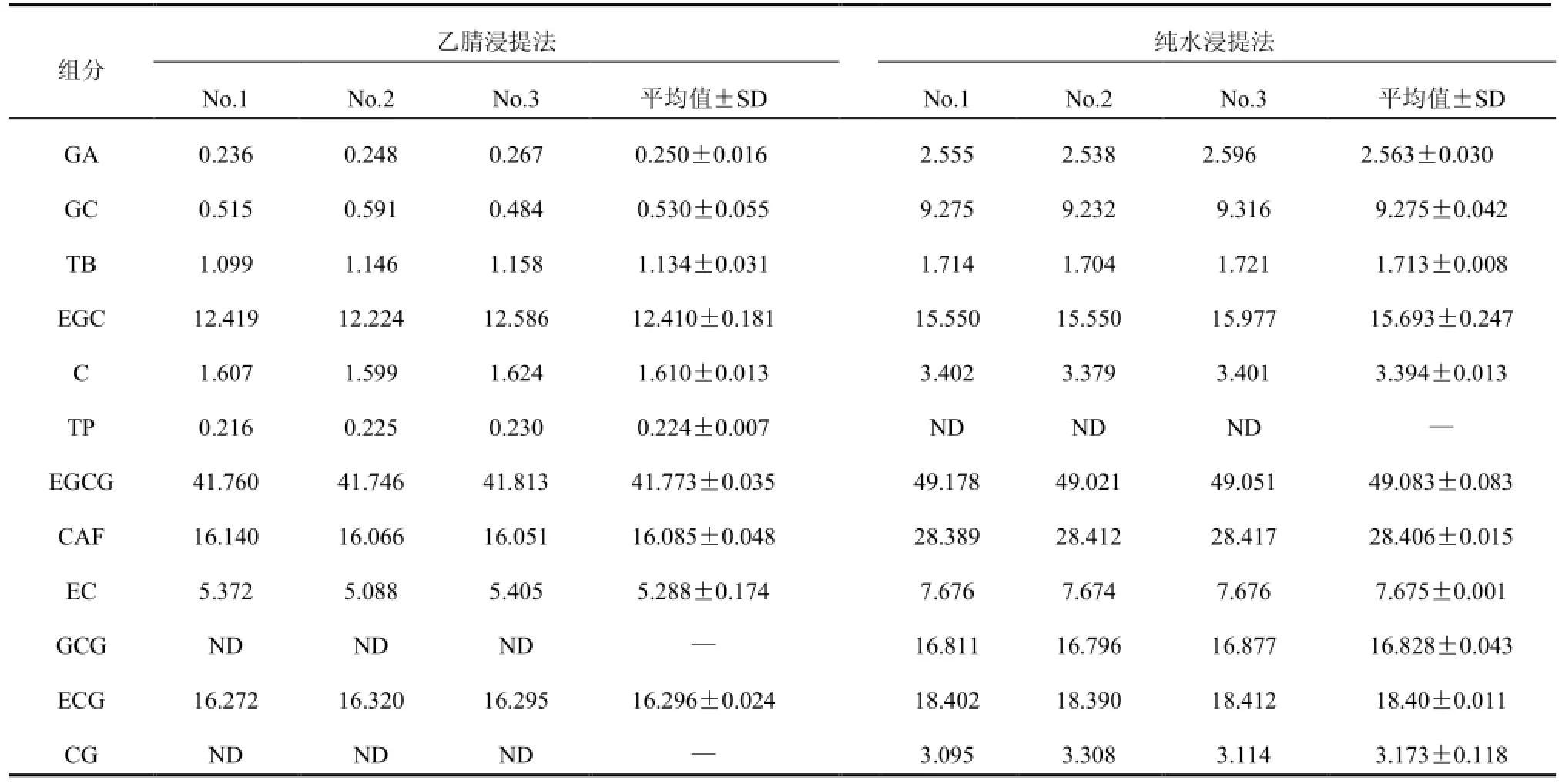
表 3 2种溶剂提取下PTFE滤膜对茶叶中12种组分HPLC检测的影响 单位:mg/gTable 3 Effects of PTFE membrane microfiltration on HPLC determination of 12 compositions in tea extracted by 2 kinds of solvents
3 小结与讨论
本试验表明,PES、MCE与PTFE 3种材质滤膜分别过滤的3瓶滤液中儿茶素含量相互一致,而采用尼龙66材质滤膜过滤后,儿茶素含量相互差别较大,推测其原因很可能是尼龙材质对它们的吸附作用,因此不建议选用尼龙66材质滤膜。有研究文献[4-6]报道使用尼龙膜过滤儿茶素溶液,然而这些文献多以建立HPLC方法为目的,考察重点在于色谱柱、流动相组成及洗脱梯度的选择,所以尼龙66材质滤膜对儿茶素类的吸附作用通常不在考察范围内。但从用于HPLC方法检测茶叶组分含量来说,其吸附效果与结果准确性呈相关性,不应忽视。一般而言,滤膜适用于样品溶液与HPLC流动相的过滤,对保护色谱柱及输液泵管系统和进样阀等不被污染具有良好的作用。笔者认为,选择滤膜时除需考虑它能否滤除不溶性颗粒物外,还应考察其材质与样品的相容性,若材质对样品中待测组分有吸附作用,就会影响该组分含量测定的准确性。滤器材质对药物吸附性研究较多[15-18],而对植物提取成分如儿茶素的吸附作用未见报道,因此关于它们对儿茶素的吸附情况及其选择合理性等亟需关注。
综上所述,水提茶样可选择MCE材质滤膜过滤,无需润洗;若使用PES材质滤膜,需润洗。过滤有机溶剂提茶样时,不建议选用尼龙66材质滤膜。无论何种溶剂提取茶样,均可使用PTFE通用性滤膜过滤。
[1] 许亚夫,邹大江,熊俊.滤膜材料及微滤技术[J].中国组织工程研究与临床康复,2011,15(16):2949-2952.
[2] 上海索莱宝生物科技有限公司.滤器的使用说明[EB/OL].(2011-07-11)[2014-08-14] http://www.chem17.com/st151778/Article_214667.html.[3] 王丽丽,陈键,宋振硕,等.茶叶中茶多酚检测方法研究进展[J].茶叶科学技术,2013,(4):6-12.
[4] Zuo Y G,Chen H,Deng Y W.Simultaneous determination of catechins, caffeine and gallic acids in green,Oolong,black and pu-erh teas using HPLC with a photodiode array detector[J]. Talanta,2002, 57(2):307-316.
[5] Cabrera C,Gimenez R,Lopez M C.Determination of tea components with antioxidant activity[J]. Journal of Agricultural and Food Chemistry,2003,51(15):4427-4435.
[6] Wang Y Y,Yang X R,Li K K,et al.Simultaneous determination of theanine,gallic acid,purine alkaloids,catechins,and theaflavins in black tea using HPLC[J]. International Journal of Food Science and Technology,2010,45(6):1263-1269.
[7] Hu B,Wang L,Zhou B, et al.Eff i cient procedure for isolating methylated catechins from green tea and effective simultaneous analysis of ten catechins, three purine alkaloids, and gallic acid in tea by high-performance liquid chromatography with diode array detection[J]. Journal of Chromatography A,2009,1216(15):3223-3231.
[8] Samanidou V,Tsagiannidis A,Sarakatsianos I.Simultaneous determination of polyphenols and major purine alkaloids in Greek Sideritis species,herbal extracts,green tea,black tea,and coffee by high-performance liquid chromatography-diode array detection[J]. Journal of Separation Science,2012,35(4):608-615.
[9] Nishitani E,Sagesaka Y M.Simultaneous determination of catechins,caffeine and other phenolic compounds in tea using new HPLC method[J]. Journal of Food Composition and Analysis,2004,17(5):675-685.
[10] He Q, Lv Y P, Zhou L, et al.Simultaneous determination of caffeine and catechins in tea extracts by HPLC[J]. Journal of Liquid Chromatography & Related Technologies,2010, 33(4):491-498.
[11] Mizukami Y,Sawal Y,Yamaguchi Y.Simultaneous analysis of catechins,gallic acid,strictinin,and purine alkaloids in green tea by using catechol as an internal standard[J]. Journal of Agricultural and Food Chemistry,2007,55(13): 4957-4964.
[12] 谷勋刚,蔡继宝,张正竹,等.HPLC-DAD分析红茶儿茶素类物质和咖啡因的方法研究[J],安徽农业大学学报, 2010,37(1):5-10.
[13] 肖俊松,袁英髦,张爱雪,等.茶叶中茶多酚和生物碱的测定及聚类和线性判别分析[J].食品科学,2010, 31(22):343-348.
[14] 李银花,李娟,龚雪,等.高效液相色谱法同时测定茶叶中8 种儿茶素、3 种嘌呤碱和没食子酸的含量[J].食品科学,2011,32(18):214-217.
[15] 聂新华,严翠环,陶金成.3种材质输液容器对药物的相容性及吸附性考察[J].中国药房,2005,16(16): 1273-1275.
[16] 白玉国,张爱琴,魏娟娟.丹参酮ⅡA 磺酸钠与灯盏花素在一次性滤膜上的吸附性研究[J].医学导报,2011, 30(5):663-665.
[17] 辛凤鲜,薛云燕.TPE输液器药物相容性探讨[J].中国医疗器械信息,2011,17(2):34-37.
[18] 王晨,薛玲,林华,等.一次性使用输液器的药液过滤器、滤膜过滤性能的研究[J].首都医药,2011,(20):4.
Effects of Microfiltration on HPLC Determination of Catechins and Alkaloids in Tea
WANG Li-li,YANG Jun-guo,CHEN Jian,SONG Zhen-shuo,CHEN Lin*
(Tea Research Institute,Fujian Academy of Agricultural Sciences,Fu’an,Fujian 355015,China)
In this experiment, effects of microfiltration on HPLC determination of catechins and alkaloids in tea were investigated with four different membrane materials, nylon 66(NL 66), polyether sulfone(PES), mixed cellulose(MCE) and polytetrafluoroethylene(PTFE). The results indicated that there was no obvious difference in the contents of gallic acid and alkaloids among three auto sampler vials(approximately 1mL per vial) when the tea infusions were continuously filtered with the same membrane. However, the contents of catechins in the filtrates obtained from NL 66 membrane filtration showed more difference between each vial and less difference would be found for MCE, PES and PTFE membrane filtration. These facts suggested that MCE, PES and PTFE filters were more suitable for pretreatment of tea infusions combined with HPLC determination of tea compositions, and the inaccuracy of HPLC determination of tea catechins with Nylon 66 filter might result from its absorption character.
microporous membrane, tea, catechins, alkaloids, HPLC
福建省自然科学基金资助项目(2012J01099);福建省农业科学院导师制青年科技创新基金项目(2012DQB-14);福建省农业科学院科技创新团队项目(CXTD-1-1302)。
王丽丽(1985-),女,硕士,研究实习员,主要从事茶叶生物化学与天然产物分离纯化技术研究。
陈林(1975-),男,博士,副研究员,主要从事茶叶加工、茶叶生物化学及综合利用研究。E-mail:chenlin_xy@163.com。
