广西茅尾海牡蛎天然种苗种类鉴定和群体组成的初步分析
2014-03-07钟方杰严雪瑜蒋钦杨李琼珍李文红
钟方杰, 严雪瑜 高 扬 蒋钦杨 贾 峥 李琼珍, 李文红 陈 琴
(1. 广西大学 动物科学技术学院, 广西 南宁 530004; 2. 广西水产研究所, 广西 南宁 530021)
广西茅尾海牡蛎天然种苗种类鉴定和群体组成的初步分析
钟方杰1,2, 严雪瑜1, 高 扬1, 蒋钦杨1, 贾 峥1, 李琼珍2, 李文红1, 陈 琴1
(1. 广西大学 动物科学技术学院, 广西 南宁 530004; 2. 广西水产研究所, 广西 南宁 530021)
了解广西茅尾海牡蛎种质资源现状, 有助于提高牡蛎采苗效果。通过在茅尾海采集常见 5种牡蛎成体, 并在牡蛎不同繁殖高峰期分别采集牡蛎D型幼虫DⅠ、DⅡ, 在不同附着期分别采集牡蛎幼苗MⅠ、MⅡ、MⅢ, 采用多重PCR技术对牡蛎成体、稚贝及幼虫进行种类鉴定。香港巨牡蛎(Crassostrea hongkongensis)在茅尾海牡蛎稚贝和幼虫高峰期均属于优势种; 稚贝中香港巨牡蛎、有明巨牡蛎(Crassostrea ariakensis)和熊本牡蛎(Crassostrea sikamea) 3个种类的平均比例分别为 88.3%、6.7%和5.0%, 香港巨牡蛎与熊本牡蛎、有名巨牡蛎相比差异显著(P<0.05), 熊本牡蛎与有明巨牡蛎差异不显著(P>0.05)。香港巨牡蛎是茅尾海牡蛎优势种, 7月12日之前投放采苗器可采集到数量多、种类单一的香港巨牡蛎。7月12日之后投放采苗器, 附着的稚贝中有明巨牡蛎和熊本牡蛎比例增加, 影响采苗效果及养殖生产。
茅尾海; 牡蛎稚贝;D型幼虫; 多重PCR;COⅠ基因
广西钦州是中国牡蛎之乡, 钦州茅尾海是国家级海洋公园保护区, 也是广西牡蛎养殖基地和中国最大的牡蛎天然采苗区[1]。茅尾海牡蛎养殖户通过每年 6月(农历)向海区投放水泥球片采苗器采集牡蛎天然苗, 最高年产牡蛎苗种约 1000亿粒, 对广西、广东、福建和海南等地牡蛎养殖产业有重要贡献[2]。当地养殖户根据牡蛎的贝壳外形、外套膜颜色和闭壳肌痕颜色将茅尾海牡蛎分为 5个种, 俗称分别为“白眼蚝”、“红眼蚝”、“蚝砺”、“黑眼蚝”、“黄蚝”; 有关茅尾海天然牡蛎种质资源报道很少。茅尾海采苗区牡蛎幼虫数量监测发现, 每年有 4~5个可以投放采苗器的牡蛎幼虫高峰期; 虽然不同种牡蛎存在繁殖期不同的生殖隔离现象[3], 由于同种牡蛎具有分批产卵的繁殖特性, 导致无法准确判断茅尾海香港巨牡蛎幼虫高峰期出现次数和时间, 采苗效果受到影响, 不利于茅尾海牡蛎资源的保护以及合理开发利用。
结合生物形态学分类与分子生物技术的方法已成为鉴定牡蛎品种最为有效和广泛应用的方法之一[4]。Wang等[5]利用多重PCR 技术有效区分了巨蛎属的5个物种。近年基因测序、系统进化树分析等分子技术的发展, 已鉴定证实华南沿海的“白肉蚝”为香港巨牡蛎(C.hongkongensis), “红肉蚝”为日本有明巨牡蛎(C. ariakensis)[6]; “赤蚝”可能是一个新种, 而“白蚝”含有香港巨牡蛎和有明巨牡蛎2个物种[2]。2010年宋忠魁等[7]的分子鉴定结果发现广西茅尾海 3种常见牡蛎分别是“白眼蚝”香港巨牡蛎、“红眼蚝”有明巨牡蛎、“蚝砺”熊本牡蛎(C.sikamea), 其中香港巨牡蛎是茅尾海主要养殖品种。李咏梅等[8]通过序列特征、遗传距离和系统进化树分析结果表明, COⅠ 基因可用于牡蛎的种类鉴定和系统发育分析。以上研究结果表明COⅠ条形码技术和基于COⅠ条形码技术发展的PCR-RFLP及多重PCR等技术能对一些牡蛎种类进行快速鉴定。
本研究根据现有的成体牡蛎 COⅠ条形码标记和PCR分子标记, 对茅尾海养殖户提供的5种成体牡蛎, 以及不同牡蛎繁殖高峰期采集的牡蛎 D型幼虫和相应高峰期附着的稚贝进行种类鉴定, 以查明茅尾海牡蛎的种类和组成等种质资源情况, 为提高茅尾海牡蛎半人工采苗预报技术和制订养殖规划提供科学参考依据。
1 材料与方法
1.1 试验材料
1.1.1 成体牡蛎的采集
试验所用的5个种类成体牡蛎由钦州茅尾海养殖户提供, 分别编号为样品 A、B、C、D、E。每个种类随机选取样本各10个, 分别采集贝壳肌40 mg于1.5 mL 离心管中, 经液氮处理后, −40℃保存备用。
1.1.2 牡蛎D形幼虫的采集
采样地点设在钦州茅尾海牡蛎采苗区(21°49.354′N, 108°33.065′E), 采样方法参照《海洋渔业调查规范》[9]。2012年7月3日和7月13日牡蛎繁殖高峰期分别采集水样, 水样浓缩后, 将不同牡蛎繁殖高峰期D型幼虫记为DⅠ、DⅡ; 在解剖显微镜下分离单个D型幼虫, 各40个移入0.2 mL PCR管中, 加入2 μL无水乙醇固定, –40℃保存备用。
1.1.3 牡蛎稚贝的采集
2012年11月初在钦州沙井养蚝专业合作社茅岭江牡蛎保苗区随机抽取6月8~10日、7月3~5日、7月 12~15日幼虫高峰时附着的牡蛎稚贝; 各期分别随机选取牡蛎稚贝40个, 记为MⅠ、MⅡ、MⅢ, 所选牡蛎稚贝平均壳高和壳长分别为2.03 cm和1.78 cm;采集去除内脏的软体部置于1.5 mL离心管中, 经液氮处理后, −40℃保存备用。试验样品详见表1。
1.2 实验方法
1.2.1 DNA的提取
牡蛎稚贝、牡蛎D型幼虫总DNA提取分别按FOREGENE公司的Genomic DNA Isolation Kit 和Genomic DNA Micro Kit操作。
1.2.2 引物的设计与合成
根据Folmer[10]开发的线粒体基因组COⅠ基因通用引物, 设计外引物LCO-1490和HCO-2198, 参照WANG[5]设计的Chk、Car、Csi作为多重PCR特异性内引物, 并送至上海生工生物工程有限公司进行合成。引物序列如表2所示。
1.2.3 通用引物PCR扩增
PCR反应体系: CWBIO生物公司 Taq Master Mix酶(Taq DNA Polymerase、Taq PCR Buffer、Mg2+、dNTP mix)7.5 μL, 成体牡蛎DNA模板2 μL, 通用引物(LCO、HCO)终浓度为0.6 μmol/L, 补足灭菌双蒸蒸馏水至15 μL。

表1 试验样品Tab.1 The test samples

表2 PCR引物序列Tab.2 The PCR primer sequences
PCR反应程序: 94 ℃预变性2 min, 94℃变性30 s, 55℃退火30 s, 72℃延伸30 s, 30个循环, 72 ℃后延伸10 min。PCR 产物经1.5 %琼脂糖凝胶电泳, 溴化乙锭(EB)染色, 用凝胶图像及分析系统观察、照相。将5个种类牡蛎扩增得到的PCR产物分别送至深圳华大基因生物公司和英骏(上海)生物技术有限公司进行序列测定。
1.2.4 多重PCR鉴定
参照Wang[5]牡蛎鉴定多重PCR技术鉴别采集到的牡蛎成体、稚贝和分离得到的单个 D型幼虫, 并对所得结果进行统计分析。
多重PCR反应体系: Taq Master Mix酶7.5 μL, DNA模板2 μL, 两条外引物(LCO、HCO)终浓度为0.8 μmol/L, 3条特异性内引物(Car、Chk、Csi)终浓度为0.2 μmol/L, 补足灭菌双蒸蒸馏水至15 μL。
PCR反应程序同1.2.3。PCR 产物经1.5%琼脂糖凝胶电泳, 溴化乙锭(EB)染色, 用凝胶图像及分析系统观察、照相。阴性对照组用灭菌双蒸蒸馏水代替模板DNA。
1.2.5 数据统计及序列分析
试验数据采用Excel 2003和SPSS 17.0软件进行数据统计, 用DNASTAR7.1软件进行序列分析。
2 结果与分析
2.1 成体牡蛎多重PCR和测序结果
2.1.1 多重PCR结果
用两条通用外引物和 3条特异性内引物对成体牡蛎进行多重 PCR鉴定, 两条外引物在所有品种中均扩增得到大小约700 bp的片段, 而特异性引物仅在该品种中得到扩增; 电泳检测结果如图1所示。检测结果显示: 俗称“白眼蚝” 和“黑眼蚝”的样品A和D扩增出现香港巨牡蛎(C.hongkongensis) 387 bp特异目的片段; 俗称“红眼蚝”样品 B扩增得到有明巨牡蛎(C. ariakensis)183 bp特异目的片段; 俗称“蚝砺”和“黄蚝”的样品 C和 E扩增出现熊本牡蛎(C.sikamea)546 bp特异目的片段。说明“红眼蚝” 是有明巨牡蛎, “白眼蚝”和“黑眼蚝” 是香港巨牡蛎,“蚝砺” 和“黄蚝”是熊本牡蛎。
2.1.2 通用引物PCR扩增及测序结果
用通用引物LCO-1490 和HCO-2198, 对5种成体牡蛎进行PCR扩增, 将PCR产物于1.5%琼脂糖凝胶进行电泳, 结果如图 2所示, 可见大小约 700 bp的条带, 与预期目的片段大小一致。
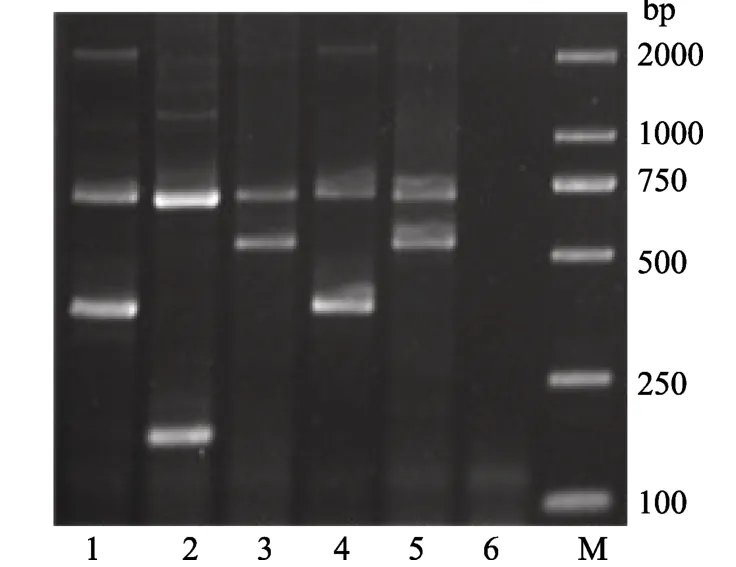
图1 5种成体牡蛎多重PCR扩增结果Fig.1 Multiplex-PCR results of five oyster adults

图2 成体牡蛎通用引物PCR扩增结果Fig.2 Universal primers-PCR results of oyster adults
2.1.2.1 同源性结果分析:
将A、B、C、D、E 5个样品测序得到的序列与NCBI上GenBank公布的几种牡蛎COⅠ基因部分序列用DNASTAR 7.1软件进行比对, 其中包括香港巨牡蛎(C.hongkongensis) (AY632556.1、FJ841963.1)、有明巨牡蛎(C. ariakensis)(AY632564、FJ841964.1)、熊本牡蛎(C.sikamea)(HQ661011、FJ841966.1)、长牡蛎(C.gigas)(AF152565.1、AF177226.1)、日本巨牡蛎(C.nippona)(AF300616.1、HM015198.1)、葡萄牙牡蛎(C.angulata)(AF152567、FJ841965.1)、美洲牡蛎(C.virginica)(AY905542)、欧洲平牡蛎(O.edulis) (AF120651.1)、黑齿牡蛎(Saccostrea mordax)(FJ841-968.1)、西班牙牡蛎(Crassostreasp.DB1)(JQ0609-58.1)。同源性分析结果显示: A、D与香港巨牡蛎的同源性分别为99.8%、100.0%; B与有明巨牡蛎的同源性为99.8%; C、E与熊本牡蛎同源性分别为99.8%、99.2%, 其进化关系分析结果见图3。
2.1.2.2 测序结果分析:
将 PCR产物测序得到的结果与通用引物 LCO-1490和 HCO-2198序列进行拼接, 得到 5个样品COⅠ基因部分序列结果如图4所示。
综上所述, 序列分析结果与多重PCR结果一致,样品B为有明巨牡蛎, 样品A和D为香港巨牡蛎, 样品C和E为熊本牡蛎。广西茅尾海成体牡蛎种类共3种, 结果与宋忠魁的研究结果一致。而样品A与D、C与 E在形态上的差异可能是由于一些环境因素或者其它形态上的主效基因的不同所致。
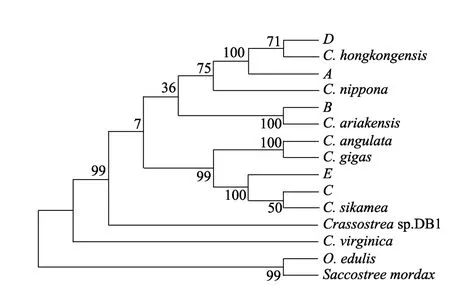
图3 试验获得的5个样品COⅠ基因部分序列与其他品种牡蛎序列的进化关系Fig.3 Phylogenetic tree of COⅠgene sequences of five test samples and other species of oyster
2.2 牡蛎D型幼虫多重PCR鉴定结果
牡蛎D型幼虫多重PCR鉴定结果显示: DⅠ高峰期所检测的40个D型幼虫中, 共检测出39个香港巨牡蛎, 特异目的片段大小为387 bp; 1个为有明巨牡蛎, 片段大小为183bp, 经统计得到DⅠ期中香港巨牡蛎所占的比例为 97.5%, 有明巨牡蛎的比例为2.5%, 而熊本牡蛎则为0。DⅡ高峰期40个D型幼虫的检测结果为所检幼虫100%为香港巨牡蛎。统计结果如图5所示, 两个幼虫高峰期中, D型幼虫的种类以香港巨牡蛎为优势种。
2.3 牡蛎稚贝多重PCR鉴定结果
牡蛎稚贝多重 PCR鉴定结果显示: MⅠ牡蛎稚贝中香港巨牡蛎36个, 占90%, 有明巨牡蛎3个, 占7.5%, 熊本牡蛎1个, 占2.5%; MⅡ牡蛎稚贝中香港巨牡蛎39个, 占97.5%, 有明巨牡蛎1个, 占2.5%; MⅢ牡蛎稚贝中香港巨牡蛎31个, 占77.5%, 有明巨牡蛎4个, 占10.0%, 熊本牡蛎5个, 占12.5%。详见图6。
由图 6可知, 在不同幼虫高峰期附着得到的牡蛎稚贝MⅠ、MⅡ、MⅢ中香港巨牡蛎、有明巨牡蛎、熊本牡蛎均有出现, 香港巨牡蛎、有明巨牡蛎和熊本牡蛎3个种平均比例分别占88.3%、6.7%和5%; 通过配对样本t检验得到, 香港巨牡蛎与熊本牡蛎、有明巨牡蛎相比差异显著(P<0.05), 熊本牡蛎与有明巨牡蛎差异不显著(P>0.05)。由此得出: 牡蛎各繁殖期附着得到的稚贝均以香港巨牡蛎为优势种。
3 讨论
3.1 广西茅尾海常见牡蛎种类鉴定
目前, 关于我国沿海牡蛎的命名及分类是研究讨论的热点[11], Lam等[12]2003年通过分子系统学和形态学分析将旧称“近江牡蛎”(O. rivrlaris)重新订名为香港巨牡蛎(C.hongkongensis); 宋忠魁等[7]根据COⅠ条形码技术对成体养殖牡蛎鉴定, 推定香港巨牡蛎是钦州湾茅尾海优势种类, 并指出俗名“白眼蚝”为香港巨牡蛎, “红眼蚝”为有明巨牡蛎, “蚝砺”则为熊本牡蛎。广西茅尾海养殖的“黑眼蚝”的外部形态与“白眼蚝”相似, 但闭壳肌痕颜色较深, “蚝砺” 和“黄蚝”外套膜颜色相近, 但外壳边缘为“菊花”状, 而“黄蚝”外壳则狭长型。本实验序列分析与多重 PCR结果说明“红眼蚝”是有明巨牡蛎, “白眼蚝”和“黑眼蚝”是香港巨牡蛎, “蚝砺”和“黄蚝”是熊本牡蛎, 广西茅尾海成体牡蛎种类共3种, 与宋忠魁等[7]的研究结果一致。“白眼蚝”与“黑眼蚝”、“蚝砺”与“黄蚝”可能分别是同一物种的不同品系, 它们在形态上的差异可能是由于一些环境因素或者其他形态上的主效基因的不同所致。牡蛎外部形态大小、外套膜颜色和闭壳肌痕颜色可作为表形性状用于品种选育评价,但作为种类鉴定标准依据不足。
3.2 广西茅尾海牡蛎苗种的种类组成分析
在南海海区, 牡蛎的采苗一年可出现两次附着高峰, 夏秋各一次。因为夏苗比秋苗数量多、体质壮、生长快, 生产上一般都采用夏苗[13]。实验结果发现茅尾海7月份发生的D型幼虫中香港巨牡蛎占97.5%以上, 分别在6月和7月初附着的稚贝MⅠ、MⅡ中香港巨牡蛎占90%以上, 说明6月和7月初海区的D型幼虫高峰期中香港巨牡蛎属于优势种, 茅尾海大规模的养殖牡蛎是采苗区幼虫的主要来源; 7月12日之前投放采苗器可采集到数量多、种类纯的香港巨牡蛎。7月 12日之后投放采苗器, 香港巨牡蛎以外的牡蛎附着量增加, 影响采苗效果及养殖生产。苏天凤等[2]研究结果认为, 钦州湾养殖的“白蚝”种群含有有明巨牡蛎和香港巨牡蛎 2个种, 其中有明巨牡砺所占比例约为27%。本实验6月和7月附着的3批稚贝中香港巨牡蛎、有明巨牡蛎和熊本牡蛎 3个种平均分别为88.3%、6.7%和5%, 结果与宋忠魁等[7]认为有明巨牡蛎和熊本牡蛎分别占茅尾海常见养殖牡蛎的5%相似, 但有明巨牡蛎所占比例低于苏天凤等得到的 27%的结果。这可能与渔民在牡蛎养成过程中有意剔除肉质较差的“红眼蚝”和个体小的“黄蚝”, 养殖群体中香港巨牡蛎比例逐年增加有关。
图4 5个样品COⅠ基因部分序列Fig.4 Partial sequences of CO Ⅰgene of five sa mples
4 结论
本研究对广西茅尾海常见的几个种类的牡蛎,利用 COⅠ序列分析进行了分子鉴定, 同时, 针对 D型幼虫和不同采苗期的牡蛎稚贝进行了鉴定和区分,推定香港巨牡蛎始终是该海区的优势种, 并初步了解牡蛎不同繁殖期苗种种类资源, 为提高牡蛎半人工采苗效果提供理论依据。
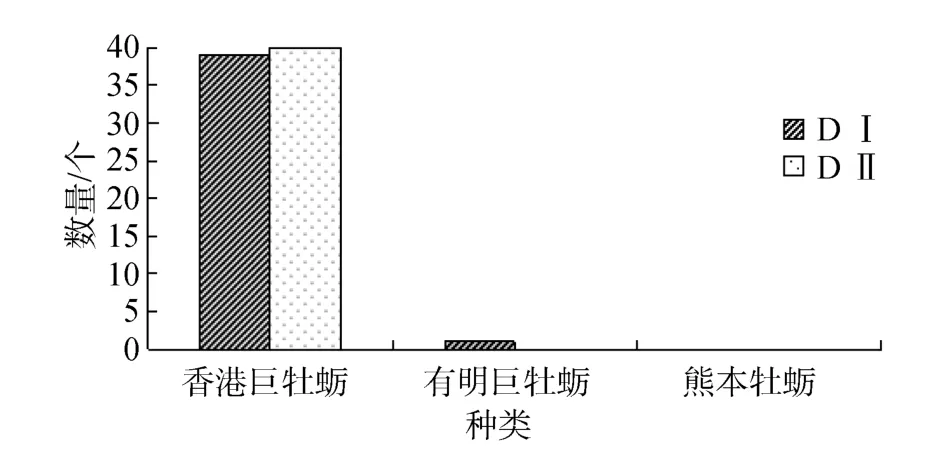
图5 牡蛎D型幼虫DⅠ、DⅡ多重PCR统计结果Fig.5 The multiplex-PCR statistical results of oyster larvae DⅠand DⅡ
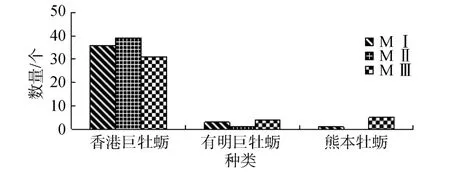
图6 牡蛎幼苗MⅠ、MⅡ、MⅢ多重PCR统计结果Fig.6 The multiplex-PCR statistical results of oyster juvenile MⅠ, MⅡ and MⅢ
[1] 王如才. 牡蛎养殖技术[M]. 北京: 金盾出版社, 2004.
[2] 苏天凤.华南沿海养殖近江牡蛎的分类研究[J].南方水产, 2006, 2(6): 72-75.
[3] 王如才, 王昭萍, 张建中. 海水贝类养殖学[M].青岛:青岛海洋大学出版社, 2008.
[4] 巫旗生, 王晓清, 曾志南, 等.中国牡蛎分类方法研究进展[J].福建水产, 2011, 33(1): 67-72.
[5] Wang H Y, Guo X M. Identification ofCrassostrea ariakensisand related oysters by multiplex speciesspecific PCR[J]. Shellfish Res, 2008, 27(3): 481-487.
[6] Wang H Y, Guo X M, Zhang G F, et al. Classification of Jinjiang oystersCrassostrea rivularis(Gould, 1861) from China, based on morphology and phylogenetic analysis [J]. Aquaculture, 2004, 242(1-4):137-155.
[7] 宋忠魁, 蔡小辉, 童潼, 等. 广西茅尾海常见牡蛎的分子鉴定[J]. 海洋科学, 2010, 34(8): 11-16.
[8] 李咏梅, 陈秀荔, 彭敏等. 基于线粒体 COI 基因序列探讨广西钦州湾牡蛎的遗传分化[J]. 西北农林科技大学学报, 2009, 37(3): 60-65.
[9] SC/T 9403-2012, 海洋渔业资源调查规范[S].
[10] Folmer O, Black M, Hoeh W, et al.DNA primers for amplification of mitochondrial cytochrome c oxidase subunit I from diverse metazoan invertebrates[J].Mol Mar Biol Biotechnol, 1994, 3:294-299.
[11] 阙华勇, 刘晓, 王海艳, 张素萍, 张国范, 张福绥.中国近海牡蛎系统分类研究的现状和对策[J]. 动物学杂志, 2003, 38(4): 110-113.
[12] Lam K, Morton B. Mitochondrial DNA and morphological identification of a new species of Crassostrea ( Bivalvia: Ostreidae) cultured for centuries in the Pearl River Delta, Hong Kong, China[J]. Aquaculture, 2003, 228(1-4):1-13.
[13] 劳赞.近江牡蛎养殖技术[J], 水产科技, 2005, 1: 15-18.
(本文编辑: 梁德海)
Species identification species group structure analysis of the common oysters from the Maowei sea in Guangxi
ZHONG Fang-jie1,2, YAN Xue-yu1, GAO Yang1, JIANG Qing-yan1, JIA Zheng1, LI Qiong-zhen2, LI Wen-hong1, CHEN Qin1
(1. College of Animal Science and Technology of Guangxi University, Nanning 530004, China; 2. Guangxi Institute of Fisheries , Nanning 530021, China)
Jun., 22, 2013
Maowei Sea; oyster juvenile; oyster larvae; multiple PCR; cytochrome coxidase I gene
The present study was conducted to learn the germplasm resource situation of oyster larvaes and juveniles in Guangxi Maowei Sea, to improve the efficiency of oysters collecting. Five common oyster adults were collected from Maowei Sea, Two types of oyster D type larvae, named DⅠand DⅡwere collected during different breeding peaks of mature oysters. Three types of oyster juvenile, named MⅠ, MⅡand MⅢ were collected, during different attachment periods. Multiple PCR technology was used to identify the species of the oyster adults, juvenile and larvae.C.hongkongensiswas the dominant species in breeding peaks of both mature oysters and oyster juvenile. The average proportion was 88.3%, 6.7% and 5% forC.hongkongensis,C. ariakensisandC.sikamearespectively in oyster juvenile. The quantity ofC.hongkongensiswas significant higher than that of C.sikamea and C. ariakensis(P<0.05). There was no significant difference betweenC.sikamea and C. ariakensis (P>0.05).C.hongkongensiswas the dominant oyster in Maowei sea. In order to collect numerousC.hongkongensiswith single species, oyster collectors should be placed before July 12.Otherwise, the proportion of oyster juvenile which adheresC. ariakensisandC.sikameawould increase, which would influence the collection and aquaculture production of Oyster.
S93
A
1000-3096(2014)03-0091-07
10.11759/hykx20130204003
2013-06-22;
2013-10-11
广西科技攻关项目(桂科攻13470002-1); 广西科技攻关项目(桂科攻11107012-2); 现代农业产业技术体系建设专项; 广西硕士研究生科研创新项目; 广西高校大学生创新计划项目
钟方杰(1988-), 男, 广西钦州人, 硕士研究生, 研究方向:渔业, 电话: 13768372701, E-mail:zhongyu0713@126.com; 李文红, 通信作者, 教授, 电话: 15994479761, E-mail: whli66@163.com; 陈琴, 通信作者, 高级实验师, 电话: 18934721306, E-mail: c90757@sina.com
