肺局灶性磨玻璃密度结节的多层螺旋CT诊断
2014-03-07HEHui
何 慧 HE Hui
孙鹏飞 SUN Pengfei
曹向荣 CAO Xiangrong
叶斌强 YE Binqiang
董永兴 DONG Yongxing
肺局灶性磨玻璃密度结节的多层螺旋CT诊断
何 慧 HE Hui
孙鹏飞 SUN Pengfei
曹向荣 CAO Xiangrong
叶斌强 YE Binqiang
董永兴 DONG Yongxing
目的 探讨肺局灶性磨玻璃密度结节(fGGO)的多层螺旋CT(MSCT)特征与病灶良恶性的相关性。资料与方法回顾性分析36例fGGO患者的影像学资料,包括8例炎症,18例肺泡癌,8例腺癌,2例非典型腺瘤样增生,评价病灶形态学特征及内部结构与良恶性的相关性。结果8例炎症中7例呈斑片状;肺不典型腺瘤样增生(AAH)均为圆形或类圆形;细支气管肺泡癌(BAC)和腺癌主要呈圆形、不规则形及分叶征。11例BAC和腺癌边缘毛糙或伴毛刺征,16例边缘清晰、光整。15例胸膜凹陷征,均见于BAC和腺癌;16例胸膜增厚,3例见于炎症,13例见于BAC和腺癌。6例炎症和2例AAH为纯GGO,18例BAC和8例腺癌为混杂GGO。结论fGGO的CT征象与病灶病理类型具有较高的相关性,对于提高其诊断准确率具有重要的临床价值。
肺炎;肺肿瘤;局灶性磨玻璃密度灶;体层摄影术,螺旋计算机;诊断,鉴别
肺局灶性磨玻璃密度结节(focal ground-glass opacity, fGGO)表现为局部肺密度轻度增加,血管和支气管内可见病灶[1]。随着多层螺旋CT(MSCT)的普及,fGGO的检出率逐渐提高,但仍无法对fGGO进行准确定性。本研究收集36例fGGO患者的影像学资料,并与病理结果进行对照,探讨fGGO的MSCT表现与病理类型的相关性。
1 资料与方法
1.1 研究对象 2010-02~2013-03兰州大学第二医院行MSCT检查,并经手术病理或随访证实的36例fGGO患者,其中男14例,女22例;年龄42~75岁,平均(57±8)岁。9例无临床症状,于体格检查时发现;20例反复咳嗽、咳痰;7例痰中带血。具体病变类型见表1。
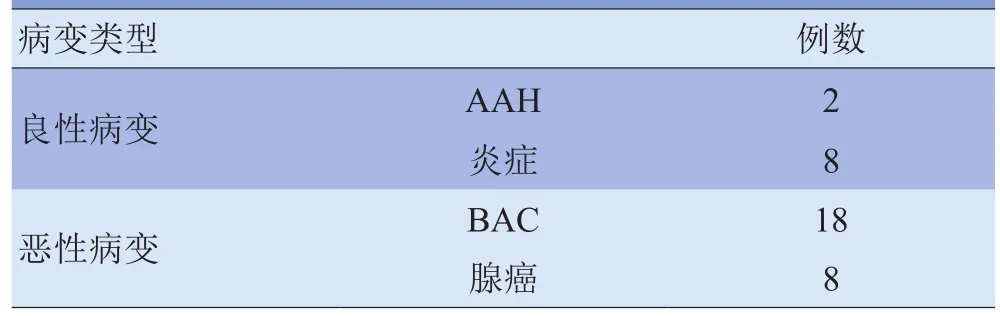
表1 36例fGGO患者的病变类型
1.2 仪器与方法 采用Siemens Somatom Sensation 64层螺旋CT机,扫描范围自肺尖至膈顶。扫描参数:准直器0.6 mm,螺距1.0,视野 300 mm,管电压120 kV,管电流采用自动毫安技术,层厚1.0 mm,间隔0.9 mm,重建视野20~30 cm。增强扫描采用双筒高压注射器于肘静脉注射70~90 ml非离子型造影剂碘普罗胺,注射速度3~5 ml/s,再采用相同速度注射20 ml生理盐水。动脉期采用团注跟踪技术,选择主肺动脉作为感兴趣区,触发阈值120 Hu,延迟时间4 s;延迟期于注射造影剂后90 s开始扫描。
1.3 图像后处理及分析 原始数据经薄层、重叠及靶重建后传至Wizard工作站,对病灶肺叶进行多平面重组(MPR)、最大密度投影(MIP)、容积再现(VR)重建。由2名影像科主任医师对原始及重建图像进行综合评价,分析fGGO的影像学特征。fGGO的形态学评价标准[2,3]:①大小:病灶最大层面长短径的平均值分为≤0.9 cm、1.0~2.9 cm、≥3.0 cm;②轮廓:分斑片状、圆或类圆形、不规则形;③边缘:分光整、毛糙、模糊;④密度:分纯GGO(pGGO)和混杂GGO(mGGO);⑤根据GGO所占整个病灶的面积比例,分为I型(GGO成分占91%~100%)、II型(GGO成分占51%~90%)、III型(GGO成分≤50%)。
2 结果
2.1 fGGO的MSCT表现 ①大小:8例炎症均≥1 cm,2例AAH均≤1 cm;②形态轮廓:8例炎症中7例呈斑片状(图1);AAH均为圆形或类圆形;BAC和腺癌主要呈圆形、不规则形及分叶征;③边缘:8例炎症均边缘模糊,2例AAH均边缘清晰、光整;11例BAC和腺癌边缘毛糙或伴毛刺征,16例边缘清晰、光整(图2);④周围改变:胸膜凹陷(图3)15例,均见于BAC和腺癌;胸膜增厚16例,3例见于炎症,13例见于BAC和腺癌。见表3。

表2 fGGO的MSCT形态学表现
2.2 fGGO的内部结构 ①密度:6例炎症和2例AAH为pGGO,18例BAC和8例腺癌为mGGO。14例BAC为II型,10例III型fGGO中6例为腺癌;②支气管充气征:17例出现支气管充气征,其中13例见于BAC和腺癌。见表3。

表2 fGGO的内部结构
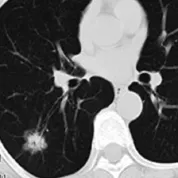
图2 女,60岁,右肺下叶BAC。病灶呈不规则形mGGO,边界清晰,伴有分叶征、毛刺征(箭)

图1 男,43岁,左肺炎症。A.轴位示斑片状pGGO(箭),边界模糊,无分叶、毛刺;B. MPR示支气管充气征(箭),支气管走形自然

图3 女,46岁,右肺上叶腺癌。A.轴位示不规则形mGGO(箭),边界清晰,有明显分叶征和胸膜凹陷征;B. VR示胸膜凹陷征(箭)
3 讨论
3.1 fGGO的定义及病理学基础 fGGO是指肺密度局限性增高,而未遮盖血管影和支气管影,是一种非特异性的影像学表现,可由多种病变引起,包括炎症、AAH、BAC、腺癌及局限性肺纤维化、水肿、出血等[4]。pGGO的病理基础是病理组织沿肺泡壁伏壁生长,不伴肺泡结构的破坏,肺泡含气比较充分,形成炎症、局灶性肺出血、AAH等;当病理组织增多,肺泡结构塌陷,成纤维细胞增生时,病灶逐步演变为含实性成分的磨玻璃结节,形成BAC、腺癌、肺间质纤维化等。Haro等[5]将肺小腺癌分为以下6型:局限性细支气管肺泡癌(A型)、局限性细支气管肺泡癌伴局灶性肺泡萎陷(B型)、局限性细支气管肺泡癌伴活动性成纤维细胞增生(C型)、低分化腺癌(D型)、管状腺癌(E型)、乳头状腺癌(F型)。影像学上A、B、C型主要表现为fGGO,D、E、F型表现为实性结节。
3.2 fGGO的影像学表现 胸部X线对fGGO的显示不敏感,主要表现为边缘不清的结节或阴影。MSCT肺窗上fGGO表现为局限性浅淡密度增高影,病灶内血管和支气管纹理清晰可见;纵隔窗上不显示或仅显示磨玻璃样病灶中的实性成分。MSCT可以清晰地显示fGGO,在扫描及重建时需要注意:①CT薄层(2 mm以下)扫描或薄层、重叠、小视野重建,即靶重建;②深吸气末扫描;③采用宽肺窗观察(窗宽1500~2000 Hu、窗位-500~700 Hu)或中间窗。pGGO表现为边缘清楚的均匀半透明密度,而mGGO呈磨玻璃样病灶伴中央结节状、条状、片状、带状致密影[6]。fGGO的病理分型与其CT表现有较好的相关性,fGGO的特征在一定程度上可以反映其组织类型[7]。
3.3 fGGO的诊断及鉴别诊断 良、恶性fGGO的临床处理和预后截然不同,因此,对fGGO进行良、恶性鉴别非常重要。周围型小fGGO(<2 cm)中恶性病灶的直径大于良性病灶[2,8]。本组≥3.0的病变中,恶性病灶平均直径大于良性病灶。病灶的形态轮廓,如圆形或类圆形、不规则形、斑片状等对于病灶良恶性的鉴别具有重要价值,文献报道恶性病灶多为圆形或球形[9]。本组恶性病灶多为不规则形或圆形,可能与本组病例数较少有关。另外,病灶的边缘(分叶、毛刺、毛糙、尖角)特征、内部结构(空泡、空气支气管征)及周围改变(胸膜凹陷征、卫星病灶)等对于良、恶性fGGO的鉴别具有重要意义[9]。与实性周围型肺癌相类似,分叶征、毛刺征、空泡征、空气支气管征、胸膜凹陷征等征象在fGGO恶性病变中的发生率明显高于良性病变[8]。本组21例fGGO恶性病变中可见分叶征、毛刺征及胸膜凹陷征,而良性fGGO中极少出现这些征象。
fGGO的密度对于病灶良恶性的鉴别亦有重要参考价值,pGGO多为良性病灶(如感染、纤维化、出血等),亦可为恶性病灶(如肺泡癌、AAH),mGGO往往为恶性[10]。本组26例恶性fGGO均为mGGO(100%),而10例良性fGGO中7例为pGGO。fGGO中GGO所占比例越小,恶性程度越大[11]。
感染、出血、纤维化等亦可呈现为fGGO,根据本组fGGO的影像学表现并结合文献,笔者认为以下几点有助于良、恶性fGGO的鉴别诊断[12-14]:①感染、出血、纤维化病灶范围相对较大,形态不规则,多呈斑片状;fGGO恶性病变直径一般为1.0~3.0 cm,不规则形及圆形多见,边缘清晰;②感染、出血密度较低,呈云雾状;fGGO恶性病变中常含有实性密度,但需注意肺泡癌可能无实性密度;③fGGO恶性病变常具有类似于实性周围型肺癌的典型特征,如分叶征、毛刺征、胸膜凹陷征;而感染、纤维化、出血很少具备这些征象,后者可以出现边缘毛糙、尖角及卫星病灶等;④定期复查或抗感染治疗对于良、恶性fGGO的鉴别诊断具有重要的意义,感染、出血等良性fGGO多在短期内吸收、消散,fGGO恶性病变在短期复查无明显变化;中长期复查中发现fGGO密度增高或病灶内出现实性成分,是诊断肺癌的重要依据。
3.4 fGGO的处理原则 ①mGGO应高度怀疑恶性,建议手术或穿刺活检。②pGGO且不具备其他伴随征象,需要随访观察。③pGGO且具备其他伴随征象,恶性可能性大,建议行胸腔镜下肺叶、肺段切除术。④fGGO在3~6个月的随访过程中逐渐增大或密度增高提示恶性,建议穿刺活检以明确诊断或手术切除[15]。
总之,fGGO的早期发现具有重要的意义,根据fGGO的大小及类型可以推断其良恶性,对于恶性fGGO,应尽早手术切除明确病理类型。
[1] Yamauchi Y, Izumi Y, Nakatsuka S, et al. Diagnostic performance of percutaneous core needle lung biopsy under multi-CT fluoroscopic guidance for ground-glass opacity pulmonary lesions. Eur J Radiol, 2011, 79(2): e85-e89.
[2] 范丽, 于红, 刘士远, 等. 3cm以下肺恶性局灶性磨玻璃结节与实性结节螺旋CT征象对照. 中华放射学杂志, 2010, 44(1): 16-19.
[3] 陈群慧, 张杰, 叶晓丹, 等. 磨玻璃密度肺小腺癌病理亚型的Ultra-HRCT分析. 中国医学计算机成像杂志, 2011, 17(4): 307-312.
[4] Felix L, Serra-Tosio G, Lantuejoul S, et al. CT characteristics of resolving ground-glass opacities in a lung cancer screening programme. Eur J Radiol, 2011, 77(3): 410-416.
[5] Haro A, Yano T, Kohno M, et al. Ground-glass opacity lesions on computed tomography during postoperative surveillance for primary non-small cell lung cancer. Lun Cancer, 2012, 76(1): 56-60.
[6] 张旻, 陈起航, 杨正汉, 等. 表现为局灶性纯磨玻璃密度影的肺癌:影像与病理对照分析. 医学影像学杂志, 2008, 18(6): 606-610.
[7] 高丰, 葛虓俊, 滑炎卿. 肺磨玻璃结节的CT分类及鉴别诊断研究. 国际医学放射学杂志, 2012, 35(1): 47-49, 58.
[8] 郝敬明. 肺局灶性磨玻璃样结节——对肺癌诊断作用//2009中国长江医学论坛——影像学与医学发展暨江苏省第四次CT/磁共振学术会议论文集. 2009: 127-129.
[9] Inoue D, Gobara H, Hiraki T, et al. CT fluoroscopy-guided cutting needle biopsy of focal pure ground-glass opacity lung lesions: diagnostic yield in 83 lesions. Eur J Radiol, 2012, 81(2): 354-359.
[10] 蒙秋华, 陈娇香, 曾庆思, 等. 局灶性磨玻璃密度小结节肺泡癌的MSCT评价. 影像诊断与介入放射学, 2011, 20(2): 122-124.
[11] 张善华, 王和平, 王善军, 等. 肺部局灶性磨玻璃影的CT诊断. 医学影像学杂志, 2012, 22(8): 1329-1332.
[12] 高丰, 葛虓俊, 李铭, 等. 经多层螺旋CT探讨肺磨玻璃结节与支气管的关系. 中华放射学杂志, 2013, 47(2): 157-161. [13] 彭德昌, 龚洪翰, 余克涵, 等. 肺部局灶性磨玻璃密度结节MSCT诊断. 实用放射学杂志, 2012, 28(1): 29-32, 41.
[14] 蒋宝国, 李林. 肺内单发磨玻璃样结节45例薄层螺旋CT扫描影像特点. 中国老年学杂志, 2011, 31(9): 1541-1543.
[15] Koo CW, Miller WT, Kucharczuk JC. Focal ground-glass opacities in non-small cell lung carcinoma resection patients. Eur J Radiol, 2012, 81(1): 139-145.
(责任编辑 唐 洁)
Multi-slice Spiral CT in the Diagnosis of Pulmonary Focal Ground Glass Opacity
PurposeTo investigate the multi-slice spiral CT (MSCT) manifestations of pulmonary focal ground glass opacity (fGGO), and to analyze its correlation with benign and malignant lesions.Materials and MethodsMSCT manifestations of 36 cases with fGGO were retrospectively reviewed including pneumonia (n=8), bronchioloalveolar cell carcinoma (BCA) (n=18), adenocarcinoma (n=8), and atypical adenomatous hyperplasia (AAH) (n=2). The correlation of lesion morphology and internal structure characteristic with benign and malignance were evaluated.ResultsSeven of eight cases of pneumonia showed patchy lesion. All cases of AAH presented round or sphericity. BCA and adenocarcinomas appeared round, irregular or lobular shape. Eleven cases of malignance showed blur margin with fuzzy. Sixteen cases had smooth edges. Fifteen cases showed pleural indentation sign, which were all confirmed malignance. Sixteen cases showed plural thickness, three of them were pneumonia and thirteen of them were malignant lesions. Six cases of pneumonia and two cases of AAH presented as pGGO. Eighteen cases of BAC and eight cases of adenocarcinoma showed mGGO.ConclusionThere is correlation between CT manifestations and its histological type of fGGO, which is important to improve diagnostic accuracy.
Pneumonia; Lung neoplasms; Focal ground-glass opacity; Tomography, spiral computed; Diagnosis, differential
兰州大学第二医院放射科 甘肃兰州730030
孙鹏飞
Department of Radiology, Lanzhou University Second Hospital, Lanzhou 730030, China
Address Correspondence to: SUN Pengfei
E-mail: sunpengfeiby@163.com
R816.41;R445.3
2013-08-15
修回日期:2013-12-31
中国医学影像学杂志
2014年 第22卷 第2期:121-123,126
Chinese Journal of Medical Imaging
2014 Volume 22(2): 121-123, 126
10.3969/j.issn.1005-5185.2014.02.012
