大豆异黄酮对乳腺癌细胞抑癌基因启动子区的去甲基化作用研究
2014-03-06金孝华柏珊珊马旭
崔 熠 金孝华 胡 玮 柏珊珊 马旭,*
1.国家人口计生委科学技术研究所遗传研究室(北京,100081);2.北京协和医学院研究生院
植物雌激素是一类存在于植物、水果和蔬菜中的天然化合物,结构及生物活性均类似于雌激素,能与雌激素受体相结合,具有弱雌激素样作用,研究发现植物雌激素还具有抗肿瘤作用,但其具体作用的分子机制目前尚不清楚[1,2]。大豆异黄酮是植物雌激素异黄酮类化合物中主要的一种,作为一种天然物质主要存在于豆科植物中,具有多种生理及药理活性,其在抗肿瘤方面的临床作用正受到众多学者的关注,具有广阔的临床应用前景[3]。肿瘤的发生和发展是一个多步骤、多阶段相互作用的级联结果,涉及到多种基因的异常改变,较常见的改变为抑癌基因的表达沉默,抑癌基因启动子及其附近区域内Cp G岛高甲基化是其表达沉默的一个重要机制[4]。目前许多研究表明多种天然及人工合成的化学物质可以利用表观遗传修饰的可逆性特性,改变基因表观遗传修饰,这种通过改变DNA甲基化状态的分子靶向表观遗传性治疗方法日益受到关注[5~7]。本研究选择抑癌基因——上皮型钙粘蛋白基因(E-cadherin)启动子区高甲基化的乳腺癌细胞系SKBR3为研究对象,检测大豆异黄酮对抑癌基因E-cadherin启动子区的甲基化作用,及对抑癌基因的去基因表达恢复情况,探讨植物雌激素大豆异黄酮是否能够通过表观遗传修饰逆转抑癌基因启动子高甲基化状态,进一步阐明大豆异黄酮抗肿瘤的分子机制。
1 材料与方法
1.1 细胞系与材料
人乳腺癌细胞系SKBR3购自中国医学科学院肿瘤医院,细胞培养所需RPMI 1640培养基、双抗、丙酮酸钠均为Hyclone公司生产,胎牛血清为Gibco公司生产。实验中所需RNA抽提及反转录所需试剂:Trizol试剂、逆转录酶、Oligo d T、RNA酶抑制剂均购自英骏生物技术有限公司。少量DNA纯化系统、Taq DNA聚合酶均购自普洛麦格(北京)生物技术有限公司。大豆异黄酮、亚硫酸氢钠、噻唑蓝(MTT)均购自西格玛奥德里奇公司。
1.2 细胞培养
人乳腺癌细胞系SKBR3用含10%胎牛血清的RPMI 1640培养基进行培养。培养基含2 mmol/L谷氨酰胺,100 U/ml青霉素和链霉素。细胞置于37℃,5%CO2混合气体培养箱中培养,隔2~3 d换一次液,3~5 d细胞生长到80%时汇合后传代。细胞传代时倒去瓶中的旧培养液,加入2~3 ml的PBS,轻轻振荡漂洗细胞除去碎片。滴加0.25%胰蛋白酶,置孵箱中3~5 min,显微镜下观察细胞收缩变圆、细胞间隙收缩变宽时,将胰酶吸出,滴加含血清的培养基终止消化,以弯头吸管顺瓶底依次轻轻吹打成单细胞悬液,按1∶3传代。
1.3 受试药物的处理
将大豆异黄酮溶解在二甲基亚砜(DMSO)中,配成1 mol/L的储存液,-20℃保存。用DMSO将其稀释成终浓度为2.5、5、12.5、25 mol/L的工作液。MTT用PBS(p H 7.2)配成5 g/L的溶液,磁力搅拌器搅拌30 min,直径为0.22μm的微孔滤膜过滤除菌后4℃保存,2周内有效。
1.4 细胞生长抑制效应测定
选对数生长期的细胞,用0.25%胰蛋白酶消化细胞,调成单细胞悬液(2.5×103个/ml),每孔体积为200μl接种到96孔培养板中。培养24 h后分别加入10、20、40、80、160μmol/L浓度的大豆异黄酮后继续培养;对照组中加入等量的0.5%DMSO液,每组接种3个复孔,连续培养72 h,加10μl MTT溶液(5 mg/ml),37℃继续培养4 h后,小心吸去培养液,以150μl DMSO溶解结晶物,振荡器振荡片刻用酶标分析仪测量570 nm处的吸光度值(A),用下列公式计算药物对细胞生长的抑制率。
抑制率%=(对照孔测定的平均A值-加药组测定的平均A值)/对照孔测定的平均A值×100%。
1.5 大豆异黄酮对乳腺细胞系SKBR3的去甲基化作用
1.5.1 药物处理 将SKBR3细胞以3×105个/瓶的密度接种于25cm2的培养瓶中,接种24 h后分别加入不同浓度的受试药(每瓶20μl),终浓度为10、20、50、100μmol/L,同时用含 DMSO 的完全培养基和空白一起作对照。培养3 d后更换新鲜培养液及药物,6 d后收集细胞提取DNA、mRNA。
1.5.2 DNA提取及甲基化特异性PCR(MSP) 所收集细胞经蛋白酶K消化,常规酚-氯仿-异戊醇法提取基因组DNA,紫外分光光度计测定DNA含量,测量样品时 A260/A280=1.7~2.0为纯度较好DNA,<1.7表明有蛋白质污染,>2.0表示有RNA污染。基因组DNA的亚硫酸氢盐修饰按文献[8]进行,PCR引物见参考文献[9]。首先取5μg DNA,溶解于18μl无菌水中,加入3 mol/L NaOH 2μl,再加入5 mol/L亚硫酸氢钠和氢醌混合液380 μl,50℃水浴12~16 h。转移至室温,吸去顶层矿物油,准备纯化柱,连接注射器和真空。各管加入30℃水浴混匀的树脂1 ml,混匀,转移至纯化柱内,静置5 min,再加入80%异丙醇2 ml,抽真空,加入80℃水100μl,80℃温浴5 min,10 000 g高速离心,加入3 mol/L NaOH 11μl,37℃水浴15 min,加入5 mol/L NH4Ac 166μl,加入2.5倍体积的无水乙醇,-70℃沉淀1 h,10 000 g,4℃离心20 min,70%乙醇200μl洗沉淀,4℃离心20 min,将DNA溶解于50μl TE缓冲液中,备用。25μl PCR反应体系组成为10×buffer终浓度为1×;亚硫酸氢盐修饰后的DNA 1μg;2 mmol/L d NTPs;2μmol/L引物和1 U Tag聚合酶。反应条件:95℃预变性5 min,95℃30 s,55℃30 s,72℃30 s,35个循环,72℃延伸7 min。取10μl PCR产物置2%琼脂糖凝胶电泳,凝胶图像成像仪观察结果。PCR反应产物纯化后在ABI3730自动测序仪上测序验证MSP结果。
1.5.3 RNA提取及半定量PCR Trizol试剂提取细胞RNA,用2μg总RNA以oligo d T为引物进行逆转录。cDNA经半定量PCR进行扩增,所用引物为E-cadherin特异性引物、内参为基因GAPDH特异性引物(引物序列见表1),进行PCR扩增。常规PCR反应体系及反应条件,引物退火温度58℃。反应完成后取5μl PCR产物置2%琼脂糖凝胶电泳,用凝胶图像成像仪观察结果。
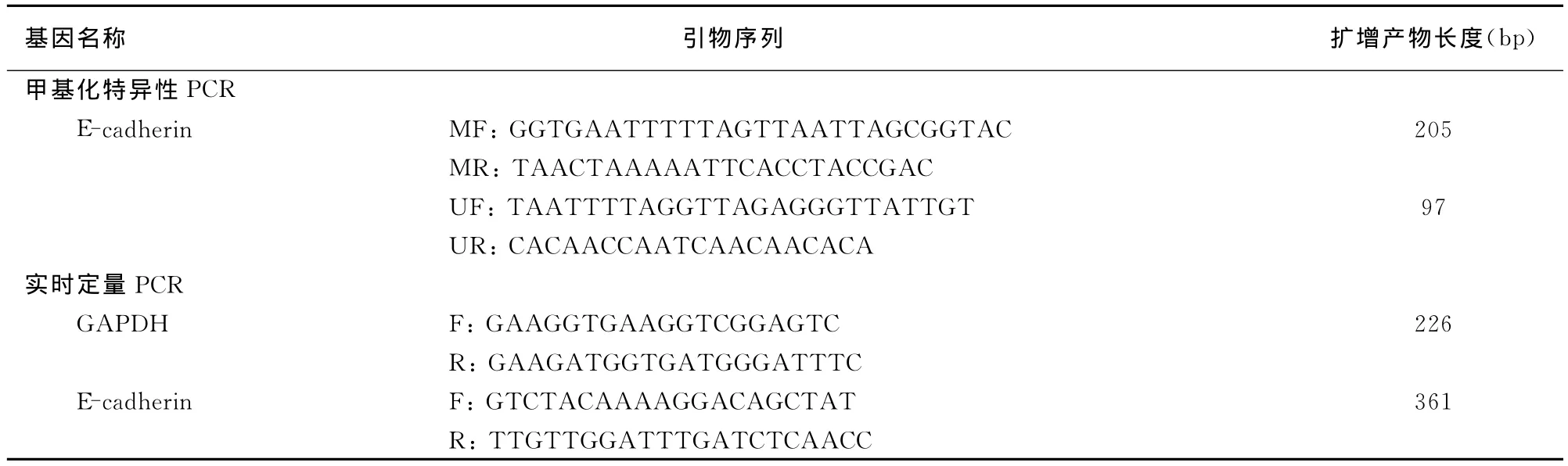
表1 各基因PCR所用的引物序列
1.6 统计学处理
数据分析采用SPSS 17.0软件系统中的One way ANOVA进行统计分析,各组与对照组间进行多重比较的双侧Dunnett'st检验,以<0.05为差异有统计学意义。
2 结果
2.1 大豆异黄酮对SKBR3细胞增生的抑制作用
不同剂量的大豆异黄酮作用于细胞系72 h后,MTT法测定吸光值(OD值)的变化显示,大豆异黄酮能明显抑制细胞的体外增殖。在大豆异黄酮10,20,40,80,160μmol/L浓度处理组其抑制率分别为(7±2.11)%,(10±3.23)%,(44.33±4.93)%,(84.33±3.06)%,(86.33±3.51)%。显示大豆异黄酮对细胞的增殖抑制率呈现明显的剂量依赖性,随着浓度的增高,大豆异黄酮抑制细胞增殖的作用愈加明显。浓度>10μmol/L药物处理组与对照组相比差异有统计学意义(P<0.05),结果见图1。
2.2 E-cadherin基因启动子区Cp G岛甲基化状态的测定
常规培养的SKBR3经MSP扩增结果显示,E-cadherin基因启动子区Cp G岛呈高甲基化,10、20、50、100μmol/L大豆异黄酮处理SKBR3细胞系6 d后,可见4个药物浓度组E-cadherin基因启动子区Cp G岛均出现非甲基化条带,条带颜色随浓度的增加而加深,提示去甲基化效果呈剂量依赖性(图2)。为证实 MSP分析的可靠性,用引物E-cadherin M、U扩增纯化后的PCR产物并测序,测序结果可见,在非甲基化序列中没有胞嘧啶,即所有胞嘧啶均变成为胸腺嘧啶。
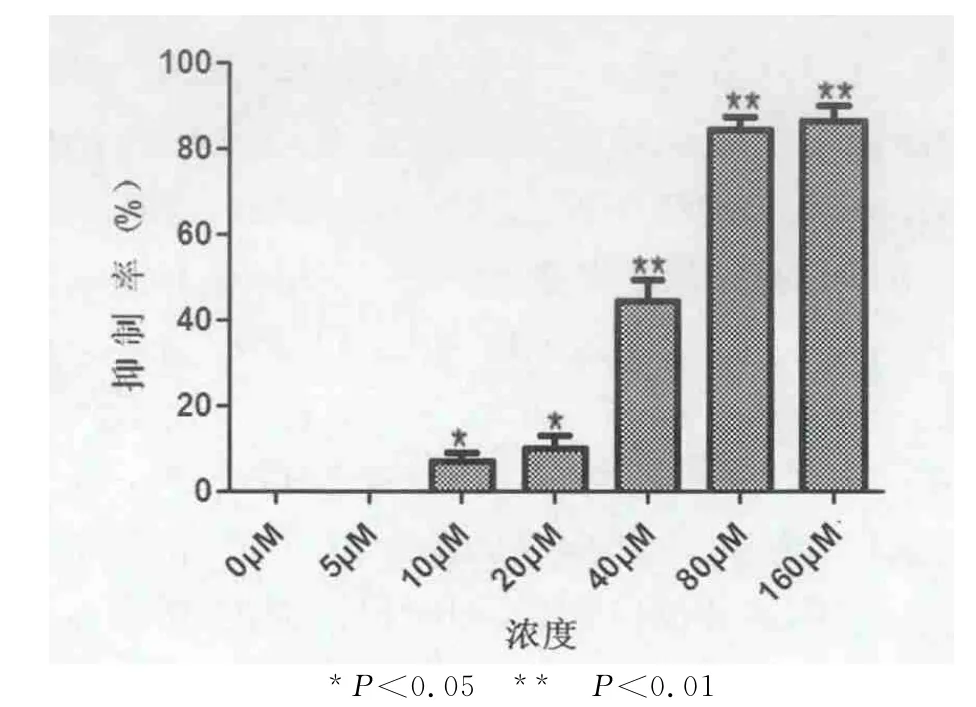
图1 不同浓度大豆异黄酮对人乳腺癌细胞系SKBR3细胞的抑制作用
2.3 E-cadherin m RNA 表达水平的变化
半定量PCR结果显示,SKBR3细胞在大豆异黄酮作用6 d后,10μmol/L处理组可见微弱表达,随加药浓度增加,E-cadherin基因mRNA表达逐渐增强,未用药组未见E-cadherin基因m RNA表达,大豆异黄酮对E-cadherin基因表达的恢复作用呈剂量依赖性效应(图3)。半定量PCR过程中选择管家基因GAPDH作为内对照,调整PCR起始模板一致性。

图2 甲基化特异性PCR检测不同浓度大豆异黄酮对E-cadherin基因的去甲基化作用
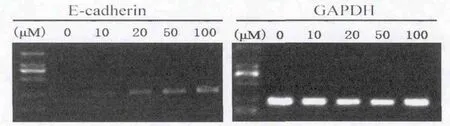
图3 半定量PCR检测大豆异黄酮作用于SKBR3细胞E-cadherin的基因表达
3 讨论
乳腺癌是妇科最常见的恶性肿瘤之一,目前临床常用的治疗方案虽然治疗效率有所提高,但淋巴道与血行转移是导致乳腺癌治疗失败的主要原因,>30%的患者死于复发和转移。肿瘤细胞浸润、转移的机制非常复杂,迄今为止多数研究均显示E-cadherin与肿瘤侵袭转移密切相关,具有转移抑制功能,被认为是一种重要的肿瘤转移抑制基因[10]。在肿瘤细胞中E-cadherin的低水平表达可致肿瘤细胞间连接松散,从而容易脱离原发灶而形成转移,致肿瘤细胞的浸润性增加[11]。E-cadherin基因定位于染色体16q22.1,基因编码的细胞表面跨膜糖蛋白相对分子质量为124 000。E-cadherin由细胞外区域、跨膜区和细胞内区域组成。细胞外区域通过与邻近细胞的E-cadherin分子相互作用建立上皮细胞间的粘附作用,细胞内区域与连环蛋白形成复合体后使E-cadherin锚定于肌动蛋白骨架[12]。E-cadherin在肿瘤组织中表达常减少或缺失,许多研究证实大部分肿瘤组织中其异常表达或缺失与其基因5'端启动子区域的Cp G岛异常甲基化有关[13]。Nojima等[14]发现,在恶性肿瘤组织及细胞系中E-cadherin基因启动子区域存在Cp G甲基化,以DNA甲基化转移酶抑制剂处理缺乏E-cadherin表达的人类肿瘤细胞系,即去甲基化处理后,可以诱导E-cadherin的表达。因此,E-cadherin基因是一种可以通过DNA异常甲基化而使基因表达减少的肿瘤抑制基因。
本研究中抑癌基因启动子甲基化状态的检测采用MSP方法,该方法是目前检测CpG岛异常甲基化的主要方法,具有较高的灵敏度。MSP法的原理是首先用亚硫酸氢钠修饰处理基因组DNA,所有未发生甲基化的胞嘧啶都被转化为尿嘧啶,而甲基化的胞嘧啶则不变,然后针对亚硫酸氢钠修饰后的模板设计两对引物—甲基化和非甲基化特异引物进行PCR扩增。当基因Cp G岛全部甲基化时,甲基化特异引物将出现PCR扩增,当基因CpG岛无甲基化时,非甲基化特异引物将出现PCR扩增,当基因CpG岛部分甲基化时,甲基化特异引物和非甲基化特异引物均出现PCR扩增。
已有研究证实大豆异黄酮能够通过改变DNA甲基转移酶的活性而影响胶质瘤细胞基因的甲基化模式[15]。本研究结果发现大豆异黄酮显著抑制乳腺肿瘤细胞的体外增殖,大豆异黄酮对抑癌基因E-cadherin启动子区有去甲基化作用,在逆转甲基化的过程中可以观察到甲基化与非甲基化共存的状态,且随剂量增加非甲基化的恢复比例增加。半定量PCR检测结果提示大豆异黄酮部分恢复因甲基化沉默的E-cadherin基因表达且呈剂量依赖性。
本研究将有助于解释大豆异黄酮化学预防、治疗乳腺癌的机制。Nam等[16]通过裸鼠实验证实,目前公认的去甲基化药物5-aza-dC通过改变E-cadherin基因启动子区的甲基化状况,恢复乳腺细胞系MDAMB-435S中因甲基化沉默的E-cadherin表达及功能,从而有效抑制肿瘤的转移,降低了肿瘤的致死率。但5-aza-dC由于具有较强的骨髓抑制、细胞毒性等作用而限制了其在临床的应用[17]。本研究发现大豆异黄酮能够逆转E-cadherin基因启动子区的甲基化状态,提示大豆异黄酮不仅能够对体外培养的肿瘤细胞系增殖起到抑制作用,还有可能通过恢复E-cadherin的表达而有效抑制机体内肿瘤的转移、浸润,为治疗肿瘤带来新的希望和新途径。从天然植物中提取出的大豆异黄酮有可能成为一种新的去甲基化药物,给肿瘤的治疗带来新的曙光,进一步深入研究大豆异黄酮的预防及抗癌效果,探讨其作用机制有着重要的临床意义。
1 Boucher BA,Cotterchio M,Curca IA,et al.Intake of phytoestrogen foods and supplements among women recently diagnosed with breast cancer in Ontario,Canada[J].Nutr Cancer,2012,64(5):695-703.
2 Velentzis LS,Woodside JV,Cantwell MM,et al.Do phy-toestrogens reduce the risk of breast cancer and breast cancer recurrence?What clinicians need to know[J].Eur J Cancer,2008,44(13):1799-1806.
3 Fan P,Fan S,Wang H,et al.Genistein decreases the breast cancer stem-like cell population through Hedgehog pathway[J].Stem Cell Res Ther,2013,11(6):146.
4 Wörmann SM,Algül H.Risk Factors and Therapeutic Targets in Pancreatic Cancer[J].Front Oncol,2013,18(3):282.
5 Song CX,He C.Balance of DNA methylation and demethylation in cancer development[J].Genome Biol,2012,13(10):173.
6 Kim SH,Lee HY,Yi H,et al.Haloperidol induces demethylation and expression of the dual specificity phosphatase 6 gene in MIA PaCa-2 human pancreatic cancer cells[J].Life Sci,2012,91(25-26):1317-1322.
7 Dalton SR1,Bellacosa A.DNA demethylation by TDG[J].Epigenomics,2012,(4):459-467.
8 Herman JG,Graff JR,Myohanen S,et al.Methylation-specific PCR:a novel PCR assay for methylation status of CpG islands[J].Proc Natl Acad Sci U S A,1996,93(18):9821-9826.
9 Xue WC,Chan KY,Feng HC,et al.Promoter hypermethylation of multiple genes in hydatidiform mole and choriocarcinoma[J].J Mol Diagn,2004,6(4):326-334.
10 Li LC,Zhao H,Nakajima K,et al.Methylation of the E-cadherin gene promoter correlates with progression of prostate cancer[J].The Journal of urology,2001,166(2):705-709.
11 Christofori G,Semb H.The role of the cell-adhesion molecule E-cadherin as a tumour-suppressor gene[J].Trends in biochemical sciences,1999,24(2):73-76.
12 Cleton-Jansen AM.E-cadherin and loss of heterozygosity at chromosome 16 in breast carcinogenesis:different genetic pathways in ductal and lobular breast cancer?[J].Breast Cancer Res,2002,4(1):5-8.
13 Wang G,Hu X,Lu C,et al.Promoter-hypermethylation associated defective expression of E-cadherin in primary non-small cell lung cancer[J].Lung Cancer,2008,62(2):162-172.
14 Nojima D,Nakajima K,Li LC,et al.Cp G methylation of promoter region inactivates E-cadherin gene in renal cell carcinoma[J].Molecular carcinogenesis,2001,32(1):19-27.
15 Fang MZ,Chen DP,Yang CS.Dietary Polyphenols May Affect DNA Methylation[J].J Nutr,2007,137 (1 Suppl):223S-228S.
16 Nam JS,Ino Y,Kanai Y,et al.5-aza-2'-deoxycytidine restores the E-cadherin system in E-cadherin-silenced cancer cells and reduces cancer metastasis[J].Clinical & Experimental Metastasis,2004,21(1):49-56.
17 Covey JM,Zaharko DS.Comparison of the in vitro cytotoxicity(L1210)of 5-aza-2'-deoxycytidine with its therapeutic and toxic effects in mice[J].European Journal of Cancer & Clinical Oncology,1985,21(1):109-117.
