表面改性在提高硅胶基体与抗菌涂层结合力中的应用
2014-03-04沙晓娟郭睿劼赵起殷广达康虹魏丽乔
沙晓娟,郭睿劼,赵起,殷广达,康虹,魏丽乔
(1 太原理工大学新材料界面科学与工程教育部重点实验室,山西 太原 030024;2 太原理工大学材料科学与工程学院,山西 太原 030024;3 邓迪大学机械工程学院,邓迪 DD1 4HN,英国)
近年来高分子材料在医用领域的应用日渐广泛,越来越多的高分子材料被应用到医疗卫生领域,如聚氨酯的人工心脏、聚氯乙烯的血包、聚丙烯的注射器以及硅橡胶的导尿管等[1]。通常由高分子材料制备而成的医疗器械都需要和人体组织接触,在这一过程中,细菌容易通过各种途径入侵,形成生物膜,进而引发感染,导致发病率与死亡率大大提高[2-3]。患者平均住院时间延长,承受的痛苦和医疗成本也随之上升。在这种大背景下,具有抗菌功能的医用高分子材料应运而生。
硅胶由于其高稳定性、柔韧性、低毒性及优良的生物相容性而被广泛应用于医疗材料领域,例如用作导尿管的原材料[4]。硅胶材料具有特殊的大分子低极性结构,表面活性很低,易造成与表面抗菌层结合力差,抗菌涂层极易脱落,造成抗菌性失效。解决这个问题的有效方法之一是改性硅胶表面,从而显著增加涂层与基体间结合力[4]。γ射线辐射作为一种低成本、环境友好型技术成为新兴的聚合物材料表面改性方法[5-7]。γ射线辐射改性硅胶表面不仅可以粗化硅胶材料形成凹凸不平的粗糙表面,而且其高能量可破坏聚合物表面的C—H键,使其断裂释放H原子并导致交联或者接枝,从而提高聚合物表面的活性[8]。γ-氨丙基三乙氧基硅烷[γ-APTS,(CH3O)3SiCH2CH2CH2NH2]是一种常用硅烷偶联剂,可以与活化后的硅胶表面发生接枝反应形成自组装单层膜(SAM),表面氨基(—NH2)中的N原子锚定镀液中的抗菌粒子,使其以化学键的方式键合在基体表面[9-11]。过程中的γ-APTS起到桥梁作用。
本实验中采用的抗菌剂为Ag,杀菌过程中发挥作用的为Ag+,Ag+通过与细菌的蛋白质、酶等作用,使细胞壁与细胞膜结构改变,损害了细菌膜通透性从而使细胞瓦解最终导致细菌死亡[12-13]。众所周知,PTFE的低表面能使其具有抗粘附特性[14],可减少细菌粘附。在γ射线改性后的硅胶表面无电镀沉积Ag-PTFE复合抗菌涂层(Ag-PTFE复合抗菌涂层同时具备抗细菌粘附与杀菌特性),涂层与硅橡胶基体间以共价键结合,从而显著提高金属/聚合物间结合力。而低摩擦系数、低表面能的 PTFE纳米颗粒的引入则可减少细菌粘附从而减少感染并发症的发生[14]。
1 实验内容
1.1 材料
所用化学试剂均为分析纯。硅橡胶为济南晨生硅橡胶股份有限公司生产,厚度0.5mm,结构为甲基乙烯基硅橡胶。偶联剂γ-APTS(98.0%)和PTFE乳液(60%)购自A ldrich。AgNO3、葡萄糖、果糖购自天津基准化学试剂有限公司,丙酮与氨水购自天津天力化学试剂有限公司。
1.2 样品制备
将 10mm×10mm×0.5mm大小的硅橡胶片分别置于丙酮、盐酸溶液、氢氧化钠溶液、乙醇中超声波清洗 15~20m in,取出后用去离子水清洗干净。在室温条件下将清洗并晾干的硅胶片置于60Co的γ射线源下(哈尔滨瑞普辐照技术有限公司),以6kGy/h的速率进行辐照,辐照剂量为50kGy。将处理后的硅胶片置于偶联剂中接枝24h后取出清洗干净并晾干备用。用无电镀法制备Ag-PTFE复合抗菌涂层。银氨络合溶液的组成为 AgNO3(1.3g/L)、NaOH(1.6g/L)、NH3·H2O(50m L/L),还原糖为C6H12O6(1.0g/L)与 C4H6O6(0.1g/L)。将配置好的还原糖溶液加入到银氨络合溶液中,置于无光条件下反应30m in。
1.3 表征
复合抗菌涂层的表面形貌用 FEI-quanta-200F扫描电子显微镜(SEM)观察,EDS用于表征涂层组成;涂层与基体间结合力采用美国标准测试方法ASTM D3359-02进行测试[15];用抑菌环试验与震荡烧瓶实验表征涂层抗菌性。其中抑菌环实验使用的细菌为革兰氏阴性细菌(大肠杆菌),细菌浓度为(1~5)×107cfu/m L,培养 18~24h后,硅胶片周围未长细菌区域的宽度即为抑菌环大小。
2 结果与讨论
2.1 表面形貌分析
样品横切面表面形貌如图1所示。与未经改性的样品[图1(a)]相比,γ射线改性后的抗菌涂层与基体间结合更加紧密,表面更加致密、平整。
2.2 抗菌涂层成分分析
图2(a)是样品EDS图。从图2(a)中可以看出,Ag元素的峰值较高,其含量可高达27.35%,这与抗菌涂层主要成分为Ag相符;F元素的出现说明PTFE纳米颗粒随着Ag共沉积到了基体表面,形成Ag-PTFE复合抗菌涂层。值得注意的是,同时检测到N元素的存在,根据硅胶基体的成分与实验过程可知,N元素的出现有可能且仅可能为γ-APTS偶联剂中的氨基,接枝结束后的表面是用有机溶剂多次清洗过的,此处N元素的出现说明了γ-APTS已接枝到硅胶基体表面。由样品的面分布[图2(b)]可以看出,N、F、Ag元素在基体中分布均匀。

图1 样品横切面扫描电镜图
2.3 结合力测试
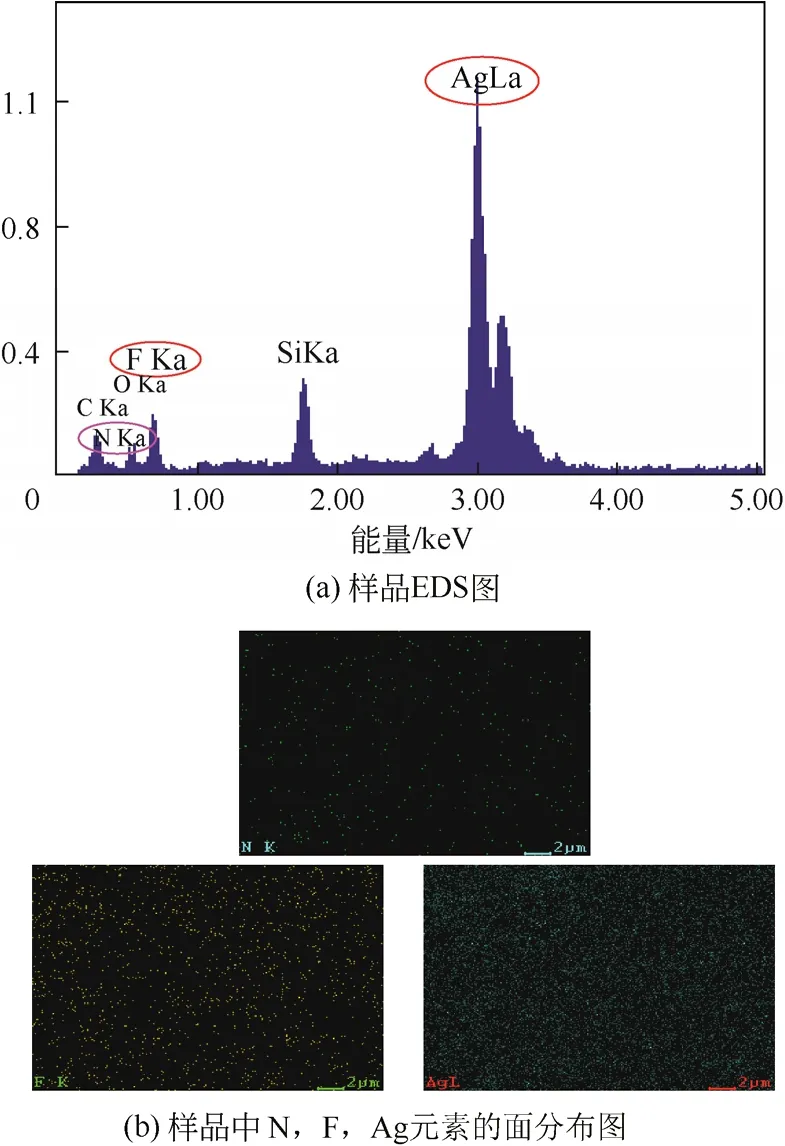
图2 样品的EDS图及面分布图
由ASTM D 3359-02法测试涂层与基体间结合力[15],测试结果如图3所示。图3(a)图中样品未经改性处理,仅清洗样品表面后无电镀,经过胶带测试后,样品表面涂层几乎全部脱落,根据ASTM D 3359-02结合力分级标准,其结合力为0B;经γ射线辐射但不接枝偶联剂而直接进行无电镀,其涂层沿切口边缘处有长条状剥落,受影响面积约35%~65%,结合力等级为1B[图3(b)];硅胶基体先经过γ射线辐射并接枝偶联剂后进行无电镀,其涂层仅在沿切口边缘和切口的交叉点处有少量涂层剥落,结合力等级达到4B,涂层与基体之间的结合力明显得到提高。由此说明,γ射线改性硅胶基体可以在基体表面形成粗糙表面,能部分提高基体与涂层间结合力;而通过γ射线改性并接枝偶联剂γ-APTS,在粗化基体表面的同时还可以形成强而有效的化学键,从而显著提高基体与涂层之间的结合力。

图3 样品结合力测试结果
2.4 抗菌性测试
用抑菌环法与震荡烧瓶法测试样品的抗菌性。对未经改性[图4(a)]和 γ射线辐射并接枝偶联剂的样品[图4(b)~(d)]测试其抗菌活性,采用的细菌为大肠杆菌。从图4(a)中可以看出,样品表面涂层有部分脱落,抑菌环大小不明显,抗菌涂层的剥落使抗菌性能下降,根据国家标准,其抗菌性未达到使用标准;而图4(b)~(d)中,三组样品表面涂层均匀、无脱落现象,抑菌环大小均大于标准的1mm,说明此样品具有良好的抗菌性。此外,抗菌样品对大肠杆菌的震荡烧瓶实验表明,抗菌样品的抗菌性高达99.996%。
3 结 论

图4 抑菌环测试结果
采用γ射线辐照并接枝硅烷偶联剂的方法对硅胶基体进行表面改性,成功制备出与基体结合力强同时抗菌性能优异的Ag-PTFE复合抗菌涂层。偶联剂的使用使结合力由弱的物理作用力转变为更强的化学键力,从而显著提高了涂层与基体间结合力,同时抗菌性能符合使用要求,使制品的临床使用性能更加优异,使用寿命随之延长。此方法操作简单,成本低廉,工业化应用前景广阔。
[1] S Ramakrishna,J Mayer,E Wintermantel,Kam W Leong.Biomedical applications of polymer-composite materials:A review[J].Composites Science and Technology,2001,61:1189-1224.
[2] Agnieszka K,Muszanska,Henk J Busscher,Andreas Herrmann,et al.Pluronic-lysozyme conjugates as anti-adhesive and antibacterial bifunctional polymers for surface coating[J].Biomaterials,2011,32:6333-6341.
[3] Nina Dinjaski,Mar Fernández-Gutiérrez,Shivaram Selvam,et al.PHACOS,a functionalized bacterial polyester w ith bactericidal activity against methicillin-resistant Staphylococcus aureus[J].Biomaterials,2014,35:14-24.
[4] Ding Xin,Yang Chuan,Lim Tze Peng,et al.Antibacterial and antifouling catheter coatings using surface grafted PEG-b-cationic polycarbonate diblock copolymers[J].Biomaterials,2012,33:6593-6603.
[5] Titaux G A,Contreras-Garcı´a A,Bucio E.Surface modification by γ-ray-induced grafting of PDMAEMA/PEGMEMA onto PE films[J].Radiation Physics and Chemistry,2009,78:485-488.
[6] Liu Tianyi,Ma Ying,Xue Sophia,et al.Modifications of structure and physicochemical properties of maize starch by g-irradiation treatments[J].LWT:Food Science and Technology,2012,46:156-163.
[7] Idrees Ahmed Wani,Mahpara Jabeen,Haneefa Geelani,et al.Effect of gamma irradiation on physicochem ical properties of Indian Horse Chestnut (Aesculus indica Colebr.) starch[J].Food Hydrocolloids,2014,35:253-263.
[8] Abdul-Kade A M,Turos A,Radwan R M,et al.Surface free energy of ultra-high molecular weight polyethylene modified by electron and gamma irradiation[J].Applied Surface Science,2009,255:7786-7790.
[9] Badruddoza A Z M,Junwen L,Hidajat K,et al.Selective recognition and separation of nucleosides using carboxymethyl-β-cyclodextrin functionalized hybrid magnetic nanoparticles[J].Colloids and Surfaces B:Biointerfaces,2012,92:223- 231.
[10] Ayed Noomane,Souhaira Hbaieb,Marie-Alexandrine Bolzinger,et al.Effectiveness of grafting modes of methoxycinnamate sunscreen onto silica particles[J].Colloids and Surfaces A:Physicochem.Eng.Aspects,2014,441:653- 663.
[11] Maryam Tajabadi,Mohammad E,Khosroshahi,Shahin Bonakdar.An efficient method of SPION synthesis coated w ith third generation PAMAM dendrimer[J].Colloids and Surfaces A:Physicochem.Eng.Aspects,2013,431:18- 26.
[12] Schierholz J M,Lucas L J, Rump A,et al.Efficacy of silver-coated medical devices[J].Journal of Hospital Infection,1998,40(4):257-262.
[13] Shao Wei,Zhao Qi.Influence of reducers on nanostructure and surface energy of silver coatings and bacterial adhesion[J].Surface & Coatings Technology,2010,204:1288-1294.
[14] Zhao Q,Liu Y,Wang C.Development and evaluation of electroless Ag-PTFE composite coatings w ith anti-m icrobial and anti-corrosion properties[J].Applied Surface Science,2005,252:1620-1627.
[15] 美国材料与试验协会标准.ASTM D3359 02.Standard test methods for measuring adhesion by tape test[S].
