SEDS工艺制备丝素纳米颗粒及其表征
2014-03-04邓爱华陈爱政王士斌王明宗
邓爱华,陈爱政,2,王士斌,2,王明宗
(1 华侨大学化工学院,福建 厦门 361021;2 华侨大学生物材料与组织工程研究所,福建 厦门 361021)
丝素蛋白是一种来源于桑蚕丝和柞蚕丝的纤维蛋白,主要由甘氨酸、丙氨酸、丝氨酸等18种氨基酸组成,可分为重链(约390kDa)、轻链(约26kDa)及糖蛋白链(约28kDa)3部分[1]。丝素蛋白具有良好的降解性、生物相容性、力学性能和可塑性[2-3],已广泛应用于药物的缓(控)释载体材料[4-6]。目前,丝素载药颗粒的主要制备方法有乳化-溶剂挥发法[7]、相分离法[8]、高压静电法[9]和喷雾干燥法[10]等,这些方法由于有机溶剂残留或使用高温导致制备的丝素药物载体存在一定的细胞毒性或药物失活等问题。超临界流体技术因能有效地去除残留的有机溶剂,且操作条件温和等特点倍受研究者的青睐[11-13]。特别是超临界流体强制分散溶液(SEDS)工艺引入同轴二流式喷嘴[14],使溶液充分雾化并强化液滴与超临界流体的混合传质,获得更高的溶液过饱和速率与结晶沉淀速率,从而析出细小的颗粒[15-16]。相比其他超临界流体技术,该技术制备的纳米颗粒粒径更小[17-19]。本实验采用SEDS工艺制备了丝素纳米颗粒,并对丝素纳米颗粒进行了相关性能的表征。
1 实验材料与仪器设备
1.1 主要试剂
丝素蛋白,平均相对分子质量250000,湖州新天丝生物技术有限公司;CO2,纯度 99.9%,厦门日宏实业发展有限公司;六氟异丙醇,分析纯,国药集团化学试剂有限公司。
1.2 主要仪器
FTIR-8400S傅里叶红外变换光谱仪,日本Shimadzu公司;S-4800场发射扫描电镜,日本Hitachi公司;Zen-3600动态激光光散射仪,英国Malvern公司;D8Advance X射线衍射仪,德国Bruker-Axs公司;6890N气相色谱仪,美国Agilent公司;HA220-50-06改进型超临界造粒装置,南通华安超临界萃取有限公司。
2 实验方法
2.1 丝素纳米颗粒的制备
先向结晶釜内通入CO2气体,待结晶釜内达到一定的压力时,保持CO2泵入速率不变,开启放气阀以恒定速率放气,并调节结晶釜外部恒温箱 35℃,保持釜内压力和温度恒定,超临界二氧化碳(SC-CO2)通过结晶釜顶部的同轴喷嘴外侧通道,将一定浓度的丝素/六氟异丙醇溶液以一定的流速由高压恒流泵通过内侧的通道,同时泵入结晶釜。结束进样后,维持釜内压力及温度不变,继续通入新鲜的CO2萃取30min。萃取完成,缓慢卸压,待釜内压力降为常压时,打开结晶釜收集样品,造粒装置见图1。
2.2 电镜观察和粒径分布
取不同条件下制备的丝素纳米粒,经真空干燥后,用E-1010型离子喷射仪喷金180s,然后用扫描电子显微镜观察其表面形态。将丝素纳米颗粒经乙醇超声分散后,通过动态激光光散射仪测试粒径分布情况。
2.3 Zeta电位测试
取适量样品,放入20m L离心管内,加入15m L乙醇,超声分散3m in后取出,室温放置至25℃,用针筒取少量混悬液装入样品池内,测试样品的Zeta电位。
2.4 有机溶剂残留测试
称取 500mg丝素纳米粒,用顶空-气相色谱仪检测丝素纳米颗粒中六氟异丙醇的残余量。测试条件如下。色谱柱为 DB-624毛细管柱;进样口 210℃;检测器(FID)温度250℃。柱温:程序升温,初始40℃,保持7m in,以 30℃/min升至180℃,保持3min;载气为氮气99.999%;流速1.0m L/min;分流模式为分流比 10∶1。顶空进样器加热参数:加热温度为85℃,加热时间为30m in。
2.5 结构表征
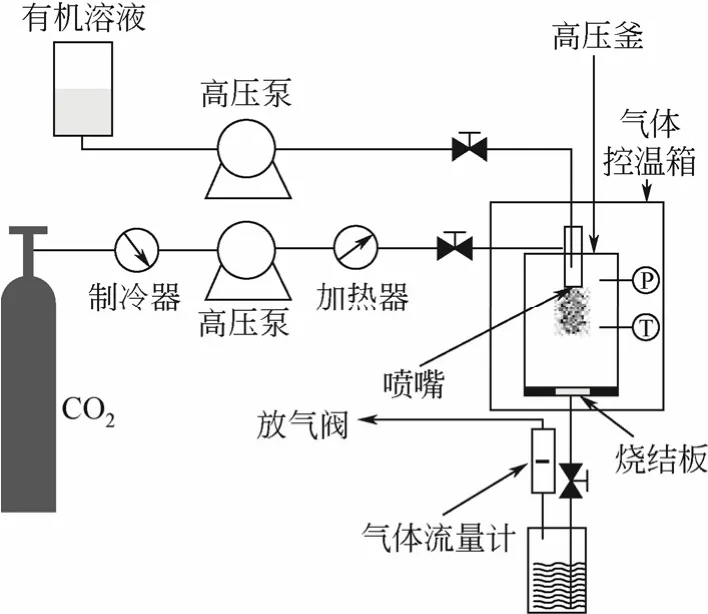
图1 SEDS工艺装置示意图
采用KBr压片法,在波数4000~400cm-1范围内采用傅里叶红外光谱仪检测样品的特征官能团;取适量样品在玻璃板上铺平,以Cu-Kα作为放射源,X射线衍射仪在10°~35°扫描样品;差示扫描量热仪测试温度为30~300℃,升温速率10℃/min,空气气氛,气体流量20μL/min,载气为氩气。
3 结果与讨论
3.1 单因素实验
3.1.1 压力的影响
在丝素溶液浓度5g/L、溶液流速1.0m L/min、CO2流速500 L/h的条件下,考察结晶釜内不同压力下纳米颗粒的粒径分布和形貌,结果如表1和图2所示。
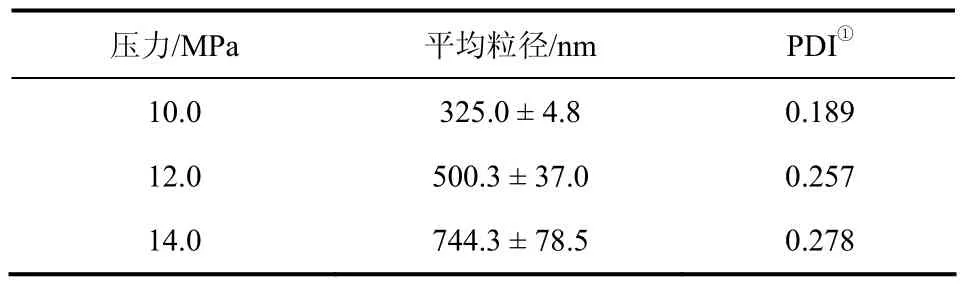
表1 不同压力条件制备的纳米粒平均粒径
从表1可知,随着压力增大,丝素纳米颗粒平均粒径增大;而图2显示粒径尺寸变化不明显,且出现颗粒的黏结。一方面,随着压力增大,釜内CO2密度增大,有机溶剂在SC-CO2中的扩散系数增大,有机溶剂进入SC-CO2中的速度加快[20],溶剂对溶质的溶解力降低[21],有利于结晶颗粒成核,从而形成较小的纳米颗粒;另一方面,随着压力增大,溶剂/非溶剂之间的密度差在降低,传质推动力降低,使得传质时间变长,颗粒发生相互黏结,颗粒实际尺寸增大[22]。
3.1.2 溶液浓度的影响
在结晶釜内压力10MPa、溶液流速1.0m L/min、CO2流速500L/h条件下,考察了不同丝素溶液浓度下纳米颗粒的粒径分布和形貌,结果如表2和图3所示。

表2 不同浓度条件制备的纳米粒平均粒径

图2 不同压力条件制备的丝素纳米粒

图3 不同溶液浓度下制备的丝素纳米粒
从表2和图3可知,随着丝素溶液浓度的增大,纳米颗粒平均粒径增大。随着溶液浓度增大,丝素含量高,黏度大,而当其他变量恒定时,液体形成的雾滴较大,使得 SC-CO2与有机溶液接触面积减少,传质效果减弱,雾滴达到过饱和状态的时间加长,瞬间成核数量减少,颗粒的沉积以生长为主要机理,所以形成的颗粒粒径较大。同时高浓度的丝素溶液可能会降低雾化强度,以致液滴无法被打碎形成更小的液滴,容易发生交联现象,这与Franceschia等[23]的研究结果一致。
3.1.3 溶液流速的影响
在结晶釜内压力10MPa、溶液浓度10g/L、CO2流速500L/h的条件下,考察了在不同丝素溶液流速下纳米颗粒的粒径分布和形貌,结果如表3和图4所示。
从表3和图4可知,当丝素溶液流速在0.5~1.0m L/min时,丝素纳米颗粒粒径变化不明显,甚至出现了减小的趋势;但当溶液流速增加到1.5m L/min时,纳米颗粒平均粒径增大。可能是由于在低溶液流速下,增大溶液流速,动能增加,溶液与 S C-CO2的作用力增加,有机溶剂更快扩散进入SC-CO2,从而导致快速结晶,形成的粒径较小;而在高溶液流速下,丝素溶液流速增大,SC-CO2和有机溶剂的接触面积减少,传质效果减弱,导致过饱和率降低,成核数量减少,颗粒以生长为主要机理,得到的粒径较大[24-25]。
3.1.4 CO2流速的影响
在结晶釜内压力10MPa、丝素溶液浓度10g/L、溶液流速1.0m L/min的条件下,考察了不同CO2流速下纳米颗粒的粒径分布和形貌,结果如表4和图5所示。

表3 不同流速条件制备的纳米粒平均粒径

表4 不同CO2流速条件制备的纳米粒平均粒径

图4 不同流速条件制备的丝素纳米粒

图5 不同CO2流速条件制备的丝素纳米粒
从表4和图5可知,在1000~1500L/h的范围内,随CO2流速的增加,丝素纳米颗粒平均粒径略有减小。这可能是由于随着 CO2流速的增加,SC-CO2动能增加,溶剂和SC-CO2作用力增大,从而有利于形成较小的颗粒[26-27]。当继续增加CO2流速到2000L/h时,此时动能的影响不明显,粒径变化不明显(表4);由于CO2的相对含量增加,反而导致过饱和度降低,成核数量减少,成核时间长,在颗粒形貌上有增大的迹象(图5)。
3.2 Zeta电位
为考察同一操作条件下,不同粒度的样品的Zeta电位,按单因素考察 3.1.1中制备不同压力条件下的样品,测量其Zeta电位,结果如表5所示。

表5 不同压力条件制备的纳米粒Zeta电位
影响Zeta电位的显著因素有:分散剂的性质、样品的浓度和样品的表面电荷性。从表5可看出丝素纳米颗粒表面呈电负性,且 Zeta电位值均比较高,说明丝素纳米颗粒较为稳定。此外,在考察的压力范围下,粒径和电位存在对应关系,粒径随电位绝对值的增大而减小。
3.3 有机溶剂残余量
在釜内压力为10MPa,溶液浓度为10g/L,溶液流速为1.0m L/m in,CO2流速为500L/h条件下制备丝素纳米颗粒,经过顶空-气相色谱法检测,溶剂出峰时间在5.3m in,残留量为20μL/L。尽管SEDS工艺使用有机溶剂,但基于 SC-CO2良好的扩散和传质性能,能够迅速扩散和穿透进入纳米颗粒的内部,从而将纳米颗粒内部的有机溶剂萃取出来带走[28]。如SEDS工艺制备的PLLA/PLGA纳米颗粒有机溶剂的残余量为39μL/L[29],而高压静电喷雾法制备的样品在冻干几天后有机溶剂残留达到365μL/L[30],喷雾干燥法制备的纳米颗粒有机溶剂残留甚至高达40000μL/L[31]。由此可见SEDS工艺在制备纳米颗粒上具有有机溶剂残留量低的优点,从而有效解决有机溶剂残留对人体带来的炎症反应。
3.4 红外光谱分析
丝素经SEDS工艺处理前后的红外光谱分析见图6。从图6可知,丝素在1650cm-1吸收峰为氨基Ⅰ(1705~1595cm-1)的特征峰,在1540cm-1吸收峰为氨基Ⅱ(1595~1495cm-1)的特征峰,表明丝素处理前后均存在无规则卷曲结构[32]。此外,丝素经 SEDS工艺处理前后红外特征吸收峰没有明显偏移,说明丝素的化学结构、官能团未发生明显变化[33]。
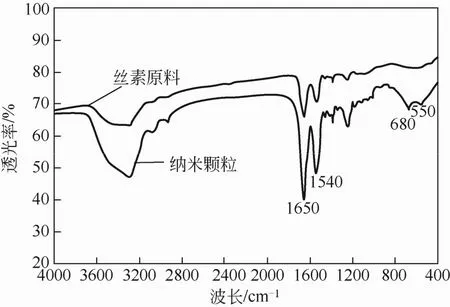
图6 丝素经SEDS处理前后的红外图谱
3.5 X射线衍射分析
丝素经SEDS处理前后X射线衍射谱图见图7。从图7可知,丝素原料在20.4°出现一宽衍射峰,说明丝素原料分子结构主要是无规则卷曲和无定形状态,其中丝素Ⅰ型结构的衍射峰在12.2°,Ⅱ型结构衍射峰在9.6°和20.4°。而经SEDS工艺处理后的丝素纳米颗粒在 20.4°衍射峰变窄,12.2°衍射峰降低,说明丝素内部分子结构发生重排,从无规则卷曲向β结构转换[34]。
3.6 差示扫描量热分析
丝素经SEDS工艺处理前后差示扫描量热曲线见图8。从图8可知,丝素原料的玻璃化转变温度和分解温度分别为183.1℃和280.8℃;而丝素纳米颗粒的玻璃化温度迁移到183.7℃,说明丝素结晶结构发生了部分改变,从无规则卷曲向β结构转换[35]。
4 结 论
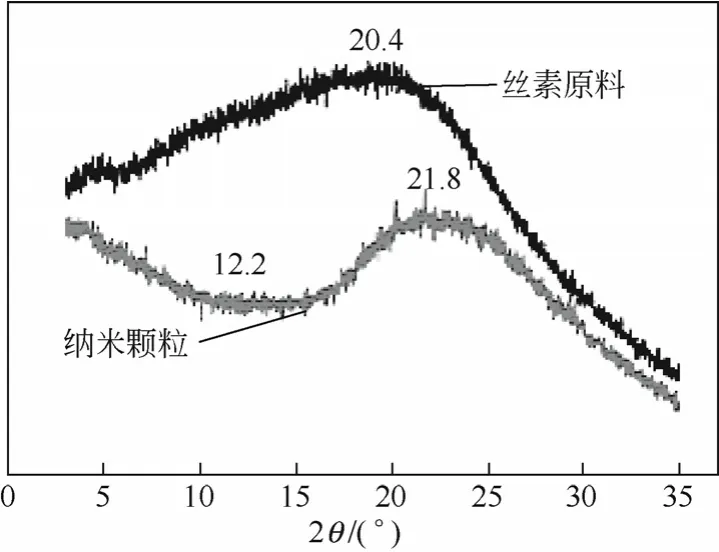
图7 丝素经SEDS处理前后的X射线衍射图
(1)以丝素蛋白为原料,以六氟异丙醇为溶剂,SEDS工艺制备了丝素纳米颗粒。经动态激光光散射仪检测表明:随压力、溶液浓度和流速的增大,丝素纳米颗粒平均粒径增大;随CO2流速的增大,丝素纳米颗粒平均粒径略有减小,最小达到298nm。
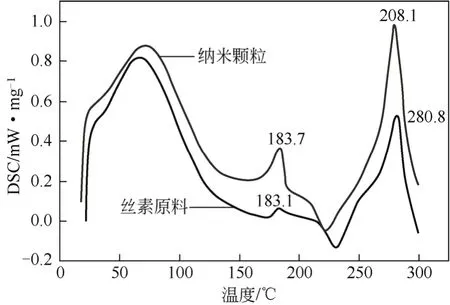
图8 丝素经SEDS处理前后的DSC曲线
(2)丝素纳米颗粒Zeta电位为-39mV,有机溶剂残留量为20μL/L。
(3)丝素材料经SEDS工艺处理后化学结构和官能团不会发生变化,但分子结构发生重排,由无规则卷曲向β折叠转换。
[1] 党婷婷,陈爱政,王士斌.丝素蛋白微球作为药物缓释载体的研究进展[J].化工进展, 2012,31(7): 1587-1596.
[2] Numata K,Kaplan D L.Silk-based delivery systems of bioactive molecules[J].Advanced Drug Delivery Reviews,2010,62(15):1497-1508.
[3] Kundu B,Saha P,Datta K,et al.A silk fibroin based hepatocarcinoma model and the assessment of the drug response in hyaluronan-binding protein 1 overespressed HepG2 cells[J].Biomaterials,2013, 34(37):9462-9474.
[4] Kundu J,Poole-Warren L A,Martens P,et al.Silk fibroin/poly(vinyl alcohol) photocrosslinked hydrogels for delivery of macromolecular drugs[J].Acta Biomaterialia,2012,8(5):1720-1729.
[5] Zhang Y F,Wu C T,Luo T,et al.Synthesis and inflammatory response of a novel silk fibroin scaffold containing BMP7 adenovirus for bone regeneration [J].Bone,2012,51(4):704-713.
[6] Wenk E,Merkle H P,Meinel L.Silk fibroin as a vehicle for drug delivery applications[J].Journal of Controlled Release,2011,150(2):128-141.
[7] Imsombut T,Srisuwan Y,Srihanam P,et al.Genipin-cross-linked silk fibroin m icrospheres prepared by the simple water-in-oil emulsion solvent diffusion method[J].Powder Technology,2010,203(3):603-608.
[8] Wang X Q,Yucel T,Lu Q,et al.Silk nanospheres and microspheres from silk/pva blend films for drug delivery[J].Biomaterials,2010,31(6):1025-1035.
[9] Gholami A,Tavanai H,Moradi A R.Production of fibroin nanopowder through electrospraying[J].Journal of Nanoparticle Research,2011,13(5):2089-2098.
[10] Chung T W,Chang C H,Ho C W.Incorporating chitosan (CS) and TPP into silk fibroin (SF) in fabricating spray-dried microparticles prolongs the release of a hydrophilic drug[J].Journal of the Taiwan Institute of Chemical Engineers,2011,42(4):592-597.
[11] Nerome H,Machmudah S,Wahyudiono,et al.Nanoparticle formation of lycopene/β-cyclodextrin inclusion complex using supercritical antisolvent precipitation[J].The Journal of Supercritical Fluids,2013,83:97-103.
[12] Campardelli R,Cherain M,Perfetti C,et al.Lipid nanoparticles production by supercritical fluid assisted emulsion–diffusion[J].The Journal of Supercritical Fluids,2013,82:34-40.
[13] Kakran M,Sahoo N G,Antipina M N,et al.Modified supercritical antisolvent method w ith enhanced mass transfer to fabricate drug nanoparticles[J].Materials Science Engineering:C,2013,33(5):2864-2870.
[14] 康永强,陈爱政,王士斌,等.基于超临界流体抗溶剂原理的造粒技术及其装置研究进展[J].化工进展,2013,32(8):1734-1742.
[15] Tabernero A,Martin del Valle E M,Galan M A.Precipitation of tretinoin and acetaminophen w ith solution enhanced dispersion by supercritical fluids (SEDS).Role of phase equilibria to optim ize particle diameter[J].Powder Technology,2012,217:177-188.
[16] Hu D D,Lin C C,Liu L,et al.Preparation,characterization,and in vitro release investigation of lutein/zein nanoparticles via solution enhanced dispersion by supercritical fluids[J].Journal of Food Engineering,2012,109(3):545-552.
[17] 黄盼,姜浩锡,李仕昌,等.超临界流体抗溶剂技术及微粒成形机理的研究进展[J].化工进展,2011,30(10):2120-2125.
[18] Chen A Z.Li Y,Chau F T,et al.Application of organic nonsolvent in the process of solution-enhanced dispersion by supercritical CO2to prepare puerarin fine particles[J].The Journal of Supercritical Fluids,2009,49(3):394-402.
[19] Zhang C,Li G D,Wang Y H,et al.Preparation and characterization of 5-fluorouracil-loaded PLLA–PEG/PEG nanoparticles by a novel supercritical CO2technique[J].International Journal of Pharmaceutics,2012,436(1-2):272-281.
[20] Reverchon E,Della P G,De R,et al.Supercritical antisolvent m icronization of some biopolymers[J].The Journal of Supercritical Fluids,2000,18(3): 239-245.
[21] Mukhopadhyay M.Partial molar volume reduction of solvent for solute crystallization using carbon dioxide as antisolvent[J].The Journal of Supercritical Fluids,2003,25(3):213-223.
[22] Moshashaee S,Bisrat M,Forbes R T,et al.Supercritical fluid processing of proteins I:Lysozyme precipitation from organic solution[J].European Journal of Pharmaceutics and Biopharmaceutics,2000,11(2):239-245.
[23] Franceschia E,De Cesaroa A M,Feitena M.Precipitation of β-carotene and PHBV and co-precipitation from SEDS technique using supercritical CO2[J].The Journal of Supercritical Fluids,2008,47(2):259-269.
[24] Hong H L,Suo Q L,Han L M,et al.Study on precipitation of astaxanthin in supercritical fluid[J].Powder Technology,2009,191(3):294-298.
[25] Jin H Y,Li S N,Hu D D,et al.Preparation of PLA-PEG nanoparticles by the solution enhanced dispersion w ith enhanced mass transfer using ultrasound in supercritical CO2[J].Powder Technology,2012,227(5):17-23.
[26] He W Z,Suo Q L,Jiang Z H,et al.Precipitation of ephedrine by SEDS process using a specially designed prefilm ing atom izer[J].The Journal of Supercritical Fluids,2004,31(1):101-110.
[27] Suo Q L,Hea W Z,Huang Y C,et al.M icronization of the natural pigment-bixin by the SEDS process through prefilm ing atom ization[J].Powder Technology,2005,154(2-3):110-115.
[28] Reverchon E,Adami R,Cardea S,et al.Supercritical fluids processing of polymers for pharmaceutical and medical applications[J].The Journal of Supercritical Fluids,2009,47(3):484-492.
[29] Kang Y Q,Yin G F,Ouyang P,et al.Preparation of PLLA/PLGA microparticles using solution enhanced dispersion by supercritical fluids (SEDS)[J].Journal of Colloid and Interface Science,2008,322(1):87-94.
[30] Nie H M,Wang C H.Fabrication and characterization of PLGA/Hap composite scaffolds for delivery of BMP-2 plasmid DNA[J].Journal of Controlled Release,2007,120(1-2):111-121.
[31] Herberger J,Murphy K,Munyakazi L,et al.Carbon dioxideextraction of residual solvents in polly(lactide-co-glycolide) m icroparticles[J].Journal of Controlled Release,2003,90(2):181-195.
[32] Hu X,Kaplan D,Cebe P.Determ ining beta-sheet crystallinity in fibrous proteins by thermal analysis and infrared spectroscopy[J].Macromolecules,2006,39(18):6161-6170.
[33] Karve K A,Gil E S,M cCarthyd S P,et al.Effect of β-sheet crysralline content on mass transfer in silk films[J].Journal of Membrane Science,2011,383(1):44-49.
[34] Zhao Z,Chen A Z,Hu H Y,et al.Fabrication of silk fibroin nanoparticles for controlled drug delivery[J].Journal of Nanoparticles Researches,2012,14(4):736-745.
[35] Lu Q,Hu X,Wang X,et al.Water-insoluable silk films w ith silk I structure[J].Acta Biomaterialia,2010,6(4):1380-1387.
