燃煤烟气中单质汞吸附与氧化机理研究进展
2014-03-04睢辉张梦泽董勇王鹏
睢辉,张梦泽,董勇,王鹏
(山东大学燃煤污染物减排国家工程实验室,山东 济南 250061)
全球每年向大气中排放汞污染物约 5000t,据UNEP 2005年数据显示,人为汞排放量约1930t,燃煤是人为汞排放源重要组成部分,占到了大约45%[1-3],因此燃煤烟气汞污染物脱除成为近期研究热点。单质汞具有较强的稳定性和较差的水溶性,一直是实现汞排放控制的难点。目前燃煤电厂 烟气中汞脱除主要包括两种思路:一是通过吸附剂吸附实现汞的脱除;二是通过催化剂催化氧化使气相中的单质汞转化为更易被吸附和有更强溶解性的氧化态汞,使汞吸附在飞灰上通过除尘器脱除或通过WFGD洗涤作用得到脱除。以上两种思路都涉及两个相辅相成的过程:吸附与氧化。很多学者的研究通常仅仅局限在吸附过程或催化氧化过程,本文对前人的研究进行综述,通过将吸附与催化氧化机理相结合,对解释实验现象,开发经济高效的汞污染物控制方法提供一种研究思路。
1 吸附机理
1.1 吸附理论
吸附是固体表面通过吸附气体分子降低表面能的过程,分吸附力为范德华力的物理吸附和吸附力为化学键力的化学吸附。不同的吸附类型表现出了不同的特征,不同的吸附特征通过吸附量V、吸附平衡温度T和吸附平衡分压P三者之间的关系来进行表征,具体通过吸附等压线(adsorption isobar)、吸附等量线(adsorption isostere)和吸附等温线(adsorption isothermal)表示。其中吸附等压线可用来判别吸附过程的类型;吸附等量线可用来求解吸附热的大小,而吸附热是表征吸附作用强弱的标志;吸附等温线可以用来分析吸附过程的机理,主要包括六种吸附等温线[4],如图1所示。
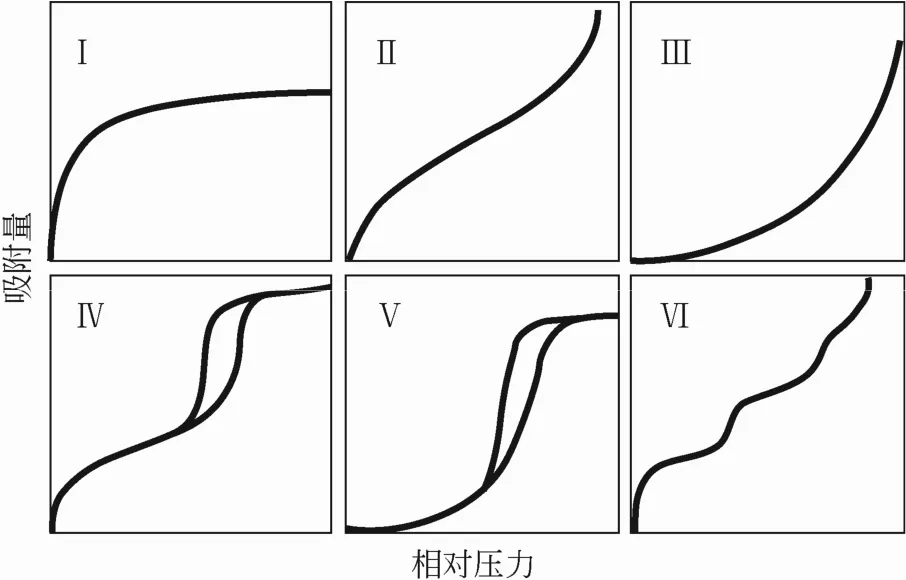
图1 六种类型吸附等温线
吸附剂能够吸附气体分子是因为吸附剂有丰富的孔结构,造成其具有较大的表面能。气体分子可以在细孔和微孔中发生凝结使吸附能力提高,称为毛细管凝结理论,该过程通过Kelvin公式解释,如式(1)。
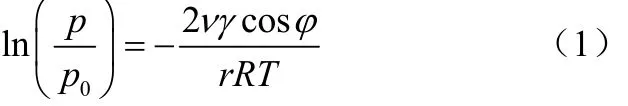
式中,r为微孔半径;R为温度T下的气体常数;P0为饱和蒸汽压;P为流体在微孔中的饱和蒸汽压;γ和ν为流体的表面张力和摩尔体积;φ为流体和毛细孔壁的接触角。
由于汞表面张力大,约0.485N/m,且与炭、玻璃、塑料和不锈钢接触角为135°,不会在微孔中发生凝结,毛细管凝结的现象不明显[5]。
流体在固体表面的吸附效果可以用扩散系数S来判别,如式(2)。

S值越大,吸附质分子以液相形式的凝聚作用越强,而被吸附于固体表面的趋势越弱。同样,由于汞的表面张力较大且接触角大于90°,所以汞的S值较大,吸附较弱。
以上两种理论的分析表明大部分吸附剂对汞吸附能力偏低,而这与活性炭及残炭的吸附实验结果不大相符[6-8],说明这些吸附剂表面存在活性点位以强化其吸附过程。
活性中心和活性点位的概念首先由 Dubinin[9]1993年在解释水蒸气在活性炭表面的吸附等温线时提出的。他假设活性炭表面存在一定数目的吸附中心,也称作活性中心。当水分子被活性中心吸附后,被吸附的水分子可充当“次级中心”吸附其他水分子。
对于汞在活性位点的吸附,因汞具有较大的表面张力,同样具有类似的吸附机理。只要炭质表面形成原生吸附层(不管是物理吸附还是化学吸附形成),吸附过程就会以此为基础继续发展而形成多吸附层或填充微空隙。此过程称作连锁蔓延吸附。汞的这种吸附机理最早是由Barrer和Whiteman 研究汞-菱沸石吸附系统时提出的,该过程遵守 Henry定律[10]。
(1)汞-菱沸石界面上 Hg2+离子对汞的化学吸附
这些活性位点可能为含氧官能团、微量元素(如硫、硒和汞等)以及催化成分。汞在上述活性位点处的吸附以化学吸附为主,而随后的蔓延增值吸附为物理吸附。
常用的汞吸附剂根据其成分分为碳基类吸附剂和非碳基类吸附剂。因其成分和结构的不同,在吸附过程中表现出来的现象差别较大,吸附机理也不尽相同。
1.2 不同吸附剂吸附汞的机理
1.2.1 碳基类吸附剂吸附机理
碳基类吸附剂主要指飞灰残炭和活性炭。学者[11]通过对碳基类吸附剂的研究提出汞吸附剂表面存在两类活性点:一种是较稳定的汞的捕集活性位点,另一种是主要用于Hg0催化氧化的催化活性点。赵永椿等[12]根据活性位点与汞结合能力的大小将飞灰表面活性位点分为四类,分别是低能催化氧化活性位、催化氧化活性位、吸附活性位和高能吸附活性位。
王立刚等[6]和 Li等[13]通过飞灰残炭和活性炭的静态吸附实验发现,残炭的吸附等温线类似于Ⅱ型等温线,活性炭吸附等温线则具有Ⅲ型等温线特征,吸附等温线类型的不同反映出残炭与活性炭吸附机理的差别,表明残炭对汞的作用力更强。炭质的起源因素对汞吸附行为的影响比其他比表面积和孔径分布更大。在较低汞浓度时,飞灰残炭与活性炭吸附量相差不大,在高汞浓度时,活性炭吸附量随汞浓度增加迅速增长。在汞浓度较低时,Li在实验中使用的飞灰残炭对汞的吸附作用比商业活性炭还强,说明飞灰残炭与汞的相互作用较活性炭更强,实验发现飞灰在 180℃脱附汞占飞灰吸附汞总量的比例[12]低于90℃下活性炭吸附剂中汞的脱附率[14]。FS飞灰残炭和HXT飞灰残炭吸附等温线的凹度不同,可能是两种残炭表面含氧官能团等活性位的种类和数量不同造成的。
王立刚以及其他学者的动态吸附实验证明温度升高不利于碳基类吸附剂对汞的吸附,与吸附是放热过程相一致。活性炭表面氧官能团、酯和羰基是单质汞捕捉的活性位;飞灰表面活性原子如氯、氧、氮、硫或者与碳环结合的官能团也是活性位的重要成分[8]。
活性炭虽然具有较高的汞脱除效率,但是其价格昂贵,经济性差。许多学者[15-21]通过卤素、硫和金属氧化物等对活性炭进行改性,进一步提高其脱汞效率,以达到更高的经济性。
孙巍等[22]发现载溴活性炭对汞的吸附能力和吸附速率都随载溴量的增加而显著提高,当载溴量为0.33%时,活性炭对汞的饱和吸附容量较未改性前相比增加80倍。硫在常温下便可以与汞发生反应生成稳定的化合物硫化汞,因此注硫活性炭有很强的汞吸附能力,且吸附产物稳定,避免造成二次污染,实验表明,活性炭表面形成的元素硫和有机硫活性位对汞的吸附能力最强[16]。高洪亮等[21]用FeCl3浸渍活性炭后其对汞的吸附能力大大提高,主要原因是氯化物改性后化学吸附作用增强。实验还发现 MnO2浸渍的活性炭对汞也有很强的吸附能力,原因是高价的锰可以氧化单质汞,使汞与锰氧化物反应生成新的化合物。
改性后的活性炭对汞的吸附能力较未改性前大大增强,主要是因为改性后活性炭表面增加了新的活性位,而这些活性为对汞的吸附主要为化学吸附,故吸附能力更强,吸附产物更加稳定。
活性位的存在大大改变了吸附剂与汞之间的相互作用,碳基类吸附剂表面含有丰富的活性位,在吸附汞时表现出了较好的吸附效果;不同碳基类吸附剂表面活性位种类和数量的差别造成了其在气相汞的吸附过程表现出了不同的吸附特性;烟气组分对吸附剂吸附汞特性的影响也主要是和吸附剂表面的活性位发生了相互作用;通过有效的措施改善吸附剂表面的活性位的种类和数量来提高吸附剂的吸附特性,是经济高效地提高燃煤烟气汞脱除效率的方法和思路。
1.2.2 非碳基吸附剂吸附机理
除了活性炭,常用的吸附剂还包括钙基吸附剂、硅胶和沸石等。硅胶是二氧化硅微粒子的三维凝聚多孔体,沸石的主要成分是硅铝酸盐。此外,研究中常用作汞吸附剂的物质还包括高岭土、皂土(膨润土)、硅酸钙、蛭石和中性氧化铝等。
非碳基类吸附剂成分相对简单,主要是无机成分,表面没有类似活性炭的活性位,对汞的吸附效果较差。但是非碳基吸附剂具有丰富的表面结构,且价格相对活性炭便宜,利用卤化物和硫化物对非碳基吸附剂进行改性能提高其吸附汞能力。
禚玉群等[22]利用卤化物对不同非碳基吸附剂进行改性,并在固定床进行吸附实验。研究结果表明,8%水蒸气,SO2和HCl对非碳基吸附剂以及改性后的吸附剂的脱汞性能有抑制作用。但是HCl通入后气相氧化态汞的含量增加。NO的影响取决于吸附剂的性质。
Morency[23]通过气相沉积法将添加剂添加到沸石中进行汞的吸附实验,得到了和活性炭相同的汞脱除效率;丁峰等[24]通过硫改性硅酸盐吸附剂也得到了不错的汞吸附效率。
Ghorishi等[25]通过研究发现烟气中的SO2能提高熟石灰对单质汞的吸附效率,但抑制熟石灰对氯化汞的吸附效率。原因是熟石灰通过吸附SO2形成捕捉单质汞的活性位,而SO2与氯化汞存在活性位的竞争关系。美国 EPA[26]和美国南部研究所(the Southern Research Institute)[27]研究了钙基类物质[CaO、Ca(OH)2、CaCO3、CaSO4·H2O]对烟气中汞的脱除作用,实验结果表明钙基能较好地吸附氧化态汞,而它对单质汞的吸附没有明显的作用。Wu等[28]通过实验发现,吸附在半干法脱硫灰(主要成分为CaO)表面的汞主要是氧化汞,NO和SO2抑制了汞在半干法脱硫灰表面的吸附。钙基类吸附剂在发挥脱硫作用的同时,对氧化态汞具有较强的吸附能力,而对单质汞几乎没有作用,通过钙基吸附剂同时达到吸附硫和汞的目的必须配合一定催化氧化措施才能实现。
吸附剂通过吸附实现脱汞的过程必须有吸附剂表面活性位的作用才能实现,大部分碳基类吸附剂表面存在丰富的活性位,能够达到较好的吸附汞的效果;非碳基类吸附剂需要通过改性在吸附剂表面添加类似活性位作用的物质成分。吸附剂活性位与单质汞相互作用中非常重要的一个过程是单质汞的氧化过程,该氧化过程包括:①活性位直接氧化单质汞形成化学键,将汞吸附在吸附剂表面;②活性位将单质汞催化氧化成氧化态汞,氧化态汞或吸附在吸附剂表面或游离到气相中使吸附剂表现出对单质汞的催化氧化能力。部分吸附在吸附剂表面的氧化态汞能够通过形成原子簇团增效单质汞在吸附剂表面的吸附。
2 单质汞氧化机理
燃煤烟气中的单质汞可以通过均相和异相反应转化为氧化态汞,许多学者对Hg0的均相和异相反应机理进行了研究,单质汞的氧化机理主要包括Sliger等[29]提出的均相反应机理、迪肯反应以及异相反应的Langmuir-Hinshelwood机理、Eley-Rideal机理和Mars-Maessen机理。研究表明单质汞的异相氧化反应比均相氧化反应更容易进行[12,30]。
2.1 均相反应机理
在气相中,Hg0可以与一些气相氧化剂包括Cl2、HCl、Cl自由基以及O3反应。Sliger等[29]提出燃煤烟气中Hg0的氧化主要是通过在400~700℃与Cl自由基反应,如式(5)。
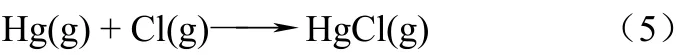
HgCl随后会被烟气中的HCl、Cl2、或Cl自由基氧化。Sliger的理论可以解释Hg0的氧化程度与煤中氯元素含量以及烟气中HCl浓度之间的关系。但是Niksa等[31]通过中试实验发现煤中氯元素的含量不是Hg0氧化的决定因素。在研究均相反应时,经常会由于反应器壁上发生的异相反应的影响,尤其对中试实验和工业试验,造成气相反应试验现象观察存在困难,产生均相反应机理不能解释的实验现象。
此外,有人提出由于在金属氧化物催化条件下,在300~400℃发生迪肯反应(deacon process),如式(6)。
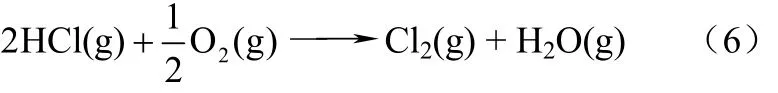
通过将HCl转化为Cl2氧化Hg0。但是,该反应平衡Cl2浓度很低(仅为HCl浓度的1%),另外,Cl2与Hg0气相反应速度较慢。因此,Niksa等[31]提出,仅仅用均相反应机理不足以解释烟气中Hg0的氧化,必须结合异相反应进行解释。
2.2 异相反应机理
2.2.1 Langmuir-Hinshelwood机理
Langmuir-Hinshelwood机理主要用于解释吸附于固体表面的两种气体分子之间的反应,如式(7)~式(10)。
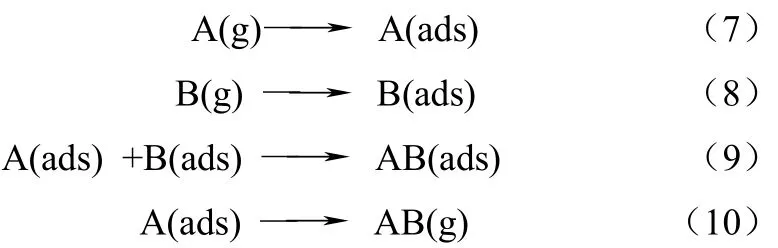
该反应速率受反应物A和B的浓度、吸附平衡常数(Ki)以及表面化学反应速率常数(ksurf)的控制。以Hg0在活性炭表面的催化氧化为例,A是指Hg0,B是含氯物质比如HCl。活性炭表面吸附Hg0和HCl,并在表面反应生成HgCl2,HgCl2脱附到气相中。这个机理可以用来解释烟气中SO2对Hg0氧化的影响。高浓度的SO2抑制汞的氧化,可能是因为SO2与HCl竞争活性炭表面的吸附位点造成的。而低浓度SO2促进汞的氧化,Schofield[32-33]研究发现在不锈钢表面Hg0与SO2反应生成HgSO4并沉积在不锈钢表面,在SO2浓度不足时,反应会生成HgO沉积在表面,而表面的 HgO会与 HCl反应生成HgCl2。Dunham等[34]研究了NO2和SO2对汞氧化影响发现,NO2可以与汞反应生成Hg(NO3)2,有SO2存在时,炭表面反应生成中间产物 Hg(HSO4)2,随后再与NO2反应生成Hg(NO3)2。
2.2.2 Eley-Rideal机理
Eley-Rideal机理指表面反应中一种反应物被吸附到表面而另外一种反应物直接在气相中与被吸附的反应物反应。
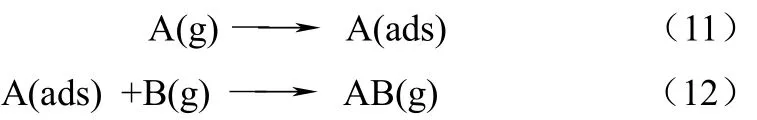
Niksa认为HCl吸附到表面与气相中的Hg0反应生成HgCl2,但是也有人认为,Hg0可以吸附到很多吸附剂中,而HCl在气相中的浓度很高,该反应应该是吸附态Hg0与气相HCl反应。
2.2.3 Mars-Maessen机理
Granite等[35]认为汞的氧化是通过 Mars-Maessen机理实现的,吸附的Hg0在晶格氧的催化作用下被氧化为Hg2+。这个机理通常用于解释卤素改性吸附剂和飞灰作为吸附剂的一些现象。Mars-Maessen机理主要过程如式(13)~式(17)。
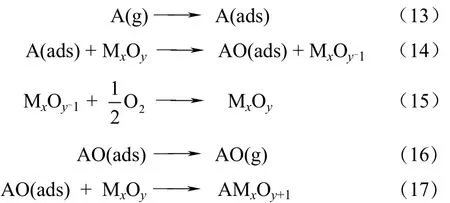
目前还不能确定哪一种氧化机理是汞催化氧化过程的主要机理,这为预测汞氧化程度和研究经济有效地提高汞催化氧化的方法造成困难。
2.3 几种催化剂催化氧化机理分析
在燃煤电厂烟气中,常见的几种促进汞氧化的催化剂包括选择性催化还原(SCR)催化剂、碳基催化剂以及金属和金属氧化物催化剂。
2.3.1 SCR催化剂催化氧化机理
SCR催化剂主要用于脱硝过程中催化 NOx与NH3反应,成分是负载在 TiO2上的五氧化二钒(V2O5)和三氧化钨(WO3)。有学者在机理试验台上证实了SCR催化剂能够催化Hg0的氧化反应,尤其是烟气中存在HCl时,可以实现很好的氧化效果。Lee等[36]的实验证明在含HCl的模拟烟气中,300℃时SCR催化剂作用下达到了95%的氧化率。有学者在中试试验和工业实验中同样发现了 SCR催化剂对Hg0氧化的促进作用,但是研究同时发现,催化剂使用时间的增加,催化Hg0氧化的效率明显降低,猜测是因为烟气中的飞灰对催化剂造成了污染,影响了催化剂的催化效率。NH3/NO比的提高不利于Hg0的氧化。
关于SCR催化剂催化Hg0氧化的反应机理,不同学者观点不同,目前主要存在四种观点。第一种观点认为Hg0氧化机理与脱硝反应机理类似,遵循Eley-Rideal机理,吸附在V2O5表面的HCl与气相中 Hg0反应[31];但是有学者发现催化剂可以吸附Hg0,因此第二种观点认为吸附态的 Hg0与气相中的HCl反应[37];第三种观点认为HCl与Hg0在催化剂表面的氧化反应遵循 Langmuir-Hinshelwood机理,二者都先吸附在催化剂表面,吸附态的HCl与Hg0发生反应[38];Gutberlet等[39]则在SCR催化剂后发现烟气中存在Cl2,认为HCl与Hg0的反应存在迪肯反应过程。SCR催化剂催化氧化Hg0的机理复杂,需要进一步的研究探索。
2.3.2 碳基类吸附剂催化氧化机理
活性炭喷射技术是目前最常用的汞脱除技术,而且活性炭除了对汞有脱除效果外,也是脱除烟气中其他污染物如SO2、NO和HCl的重要吸附剂。燃煤飞灰因为含有未燃烧的碳,对Hg0也有催化氧化作用。目前关于碳基催化剂对Hg0催化氧化的研究主要集中在飞灰作为催化剂对Hg0的氧化。
影响飞灰对Hg0的催化氧化作用大小的因素有很多,主要包括煤种、飞灰粒径、气氛、比表面积以及残炭结构等因素。由于飞灰除了对Hg0有催化氧化作用以外,对HgCl2吸附作用较强,造成飞灰对汞的催化氧化程度的研究困难。颗粒态汞虽然不能够区分其中汞的价态,但是颗粒态汞因相对单质汞更容易脱除,达到了类似催化氧化汞的目的,若将颗粒态汞和氧化态汞的总和占进口总汞的浓度的比例定义为氧化率,更利于对催化氧化作用的吸附剂,尤其是飞灰的脱汞效率进行对比。
Hargrove等[40]实验研究了不同煤种的飞灰对Hg0的催化氧化效果, 发现不同煤种和不同粒径的飞灰对Hg0催化氧化效果和吸附效果差异很大。
HCl和NO2促进飞灰对汞的催化氧化,NO抑制飞灰对汞的催化氧化,SO2对该催化氧化反应的影响不同学者结论不同。结论不同可能是因为SO2浓度和飞灰未燃碳结构组成以及未燃碳以外的成分对汞的吸附效果差异造成的。
Dunham等[34]的研究表明飞灰比表面积与 Hg0的氧化与吸附具有正相关性,飞灰中的残炭能够促进Hg0的氧化但是与气相HgCl2的吸附相关性不大。赵永椿等[41]的研究认为影响燃煤飞灰脱汞能力的主要因素是飞灰中各向异性碳颗粒尤其是多孔网状结构碳含量。
关于飞灰氧化Hg0机理,由于残炭对Hg0具有吸附性,Langmuir-Hinshelwood机理和Eley-Rideal机理在逻辑上都是可行的。另外,由于飞灰中含有金属氧化物和氯化物,Mars-Massen机理也是可能存在的。
2.3.3 金属和金属氧化物催化氧化机理
除了SCR催化剂的主要活性成分五氧化二钒对Hg0有催化氧化作用外,其他许多金属和金属氧化物作为潜在的汞氧化催化剂近年来得到了广泛的研究。贵重金属包括铜、金、银、钯具有催化氧化Hg0的作用,但是贵金属由于其成本较高限制了其在工业生产中的应用。研究发现铁的氧化物[42](Fe2O3和Fe3O4)、锰氧化物以及铜氧化物等也有催化氧化气相中Hg0的作用。
Ghorishi等[43]在固定床上研究包含不同组分的飞灰样本,发现飞灰中含有Fe2O3时,在250℃下单质汞的氧化率可以达到90%,而当飞灰中不含Fe2O3时,汞的转化率只有10%。Wu等[44]用沉淀法制备了Fe2O3/TiO2催化剂并研究了其在不同气氛下的脱汞性能,发现H2S促进了铁氧化物对汞的催化氧化性能。Dunham等[34]发现在120和180℃时,汞的氧化率随飞灰中Fe3O4含量的增加而增加。
在铁氧化物对汞的氧化机理方面,郭欣等[45]用密度泛函理论揭示了汞在Fe2O3表面的吸附机理,理论计算表明Hg在α- Fe2O3表面的吸附为物理吸附,HgCl是反应的重要中间体,H2S对Hg0在α-Fe2O3表面吸附的影响符合Eley-Rideal机理,H2S首先吸附在α-Fe2O3表面并发生两步解离,最终S吸附在表面与Fe成键,气相中的Hg与吸附态的S结合生成HgS[46]。
锰氧化物是一种有效的低温汞催化剂。Ji等[47]研究表明,MnO2/TiO2催化剂在200℃的低温条件下可以对汞实现高效氧化。何胜[48]以Al2O3为载体制备的锰氧化物催化剂,在HCl浓度为10×10-4时汞氧化率达到85%以上,并通过吸附实验表明该催化剂通过Mars-Massen机理吸附单质汞并与晶格氧作用形成HgO,Ji等[47]也通过XPS检测到催化剂表面有Hg-O键的存在,说明锰氧化物对汞的催化存在Mars-Massen机理。
此外,CuO和CuCl2也具有较好的催化氧化作用,而且根据Ghorishi等[20,25]的研究,即使在烟气中没有HCl存在时,CuCl2对Hg0也具有非常好的氧化效果。
目前金属和金属氧化物催化氧化Hg0的机理也是不明确的,简单的逻辑假设分析发现以上三种机理以及迪肯反应都是有可能存在的。由于不同的金属氧化物、不同的气氛,汞的氧化机理不同,这给探索金属氧化物催化氧化汞的机理造成一定的困难,阐明不同催化剂、不同烟气成分下汞的氧化机理仍是以后研究的主要方向。
以上几种单质汞催化氧化机理在解释一些实验现象时都存在合理性。对于三种异相反应机理除了相应的化学反应机理外,还存在气相物质在固相表面的吸附与脱附过程。化学反应和吸附过程是相辅相成的,吸附过程制约化学反应过程的发生,同时,化学反应过程为吸附过程提供动力和空间,同时催化氧化反应产生的 Hg2+又通过簇团理论促进单质汞在吸附剂表面的吸附。此外,由于吸附剂种类的多样性和吸附剂表面成分的复杂性,有些催化氧化过程是多种机理的共同作用实现的。这为单质汞催化氧化机理的研究造成了困难,然而,催化氧化机理的研究是研究烟气组分对汞脱除的影响,开发新型高效汞脱除方法的重要思路。利用卤化物或硫化物对吸附剂进行改性就是一种非常典型且高效的方法。目前,关于催化氧化机理需要解决的问题还包括,汞在催化剂表面的吸附是化学吸附还是物理吸附,Hg0异相氧化反应的中间产物是什么,Hg2+以何种化合物形态存在以及其他烟气成分对催化氧化反应的作用效果和作用机理。
由于汞形态的多样性和测试分析技术难度大等各方面的因素限制,通过实验方法来确定汞的物种形成的机理研究困难重重,计算机技术的发展使通过模拟计算手段研究汞的吸附与氧化机理成为可能,部分学者已经取得了较大的进展。Sliger等[30]通过化学反应动力学模型研究为氯在汞氧化过程中的作用机理提供了指导,刘晶[49]运用量子化学从头计算理论深入研究了煤燃烧过程中汞与含氯气体的反应。
3 结 语
汞与大部分物质的不浸润性造成单质汞在吸附剂表面吸附率低,吸附剂表面的活性位是决定吸附剂对单质汞吸附效果的决定因素,活性炭和飞灰残炭表面含有丰富的活性位,表现出了较好的吸附效果,活性位较少的吸附剂可以通过利用卤化物等物质改性达到部分活性位的作用从而提高吸附效率。
吸附剂表面的活性位种类不同,表现出的作用也有所差别,有些活性位通过提高汞在吸附剂表面的吸附能力,有些活性位则起到催化氧化单质汞的作用;被催化氧化的氧化态汞可以吸附在吸附剂表面或脱附到气相中经过洗涤过程出去。
单质汞的氧化包括均相反应和异相反应,均相反应的机理包括原子基团理论和迪肯反应,实验表明均相反应不是单质汞氧化的主要途径;异相反应包括Langmuir-Hinshelwood机理,Eley-Rideal机理和Mars-Maessen机理,催化剂种类不同,活性位的差异等造成具体机理不同,仅仅通过宏观的实验现象很难推断出具体的反应机理。通过研究汞在吸附剂和催化剂表面的吸附和催化氧化反应来开发经济有效的燃煤烟气汞污染物脱除方法仍然是今后研究的重点。
[1] Branch Chemicals UNEP.The global atmospheric mercury assessment:Sources,emissions and transport[R].Geneva,Suitzerlard:UNEP-Chem icals,2008.
[2] Pacyna E G,Pacyna J M,Sundseth K,et al.Global em ission of mercury to the atmosphere from anthropogenic sources in 2005 and projections to 2020[J].Atmospheric Environment,2010,44(20):2487-2499.
[3] W ilson S,Munthe J,Sundseth K,et al.Updating historical global inventories of anthropogenic mercury emissions to air[R].AMAP Technical Report,2010.
[4] Donohue M D,Aranovich G L.Classification of Gibbs adsorption isotherms[J].Advances in Colloid and Interface Science,1998,76-77:137-152.
[5] 近藤精一,石川达雄,安部郁夫.吸附科学[M].北京:化学工业出版社,2010.
[6] Wang Ligang,Chen Changhe,Kolker Kruse H.Vapor-phase elemental mercury adsorption by residual carbon separated from fly ash[J].Journal of Environmental Sciences,2005,17(3):518-520.
[7] Olson Edw in S,Azenkeng Alexander,Laumb Jason D,et al.New developments in the theory and modeling of mercury oxidation and binding on activated carbons in flue gas[J].Fuel Processing Technology,2009,90(11):1360-1363.
[8] Li Y H,Lee C W,Gullett B K.Importance of activated carbon's oxygen surface functional groups on elemental mercury adsorption[J].Fuel,2003,82(4):451-457.
[9] Dubinin M M.Theory of the bulk saturation of microporous activated charcoal during adsorption of gases and vapours[J].Russ.J.Phys.Chem.,1993,39(6):697-704.
[10] 王立刚,刘柏谦.燃煤汞污染及其控制[M].北京:冶金工业出版社,2008.
[11] Presto A lbert A,Granite Evan J,Karash Andrew.Further investigation of the impact of sulfur oxides on mercury capture by activated carbon[J].Industrial & Engineering Chemistry Research,2007,46(24):8273-8276.
[12] 赵永椿,张军营,刘晶,等.燃煤飞灰氧化汞的机制研究[J].科学通报,2009,21:3395-3399.
[13] Li Z,Sun X,Luo J,et al.Unburned carbon from fly ash for mercury adsorption:II.Adsorption isotherms and mechanisms[J].Journal of Minerals & Materials Characterization & Engineering,2002,1(2):79-96.
[14] Luo Zhongyang,Hu Changxing,Zhou Jinsong,et al.Stability of mercury on three activated carbon sorbents[J].Fuel Processing Technology,2006,87(8):679-685.
[15] 孙巍,晏乃强,贾金平.载溴活性炭去除烟气中的单质汞[J].中国环境科学,2006,26(3):257-261.
[16] Hsi Hsing-Cheng,Rood Mark J,Rostam-Abadi Massoud,et al.Mercury adsorption properties of sulfur-impregnated adsorbents[J].Journal of Environmental Engineering,2002,128(11):1080-1089.
[17] Hsi Hsing-Cheng,Chen Shiaoguo,Rostam-Abadi Massoud,et al.Preparation and evaluation of coal-derived activated carbons for removal of mercury vapor from simulated coal combustion flue gases[J].Energy & Fuels,1998,12(6):1061-1070.
[18] Liu Wei,Vidic Radisav D,Brown Thomas D.Optim ization of sulfur impregnation protocol for fixed-bed application of activated carbon-based sorbents for gas-phase mercury removal[J].Environmental Science & Technology,1998,32(4):531-538.
[19] Liu Wei,Vidic Radisav D,Brown Thomas D.Impact of flue gas conditions on mercury uptake by sulfur-impregnated activated carbon[J].Environmental Science & Technology,2000,34(1):154-159.
[20] Ghorishi S Behrooz,Keeney Robert M,Serre Shannon D,et al.Development of a Cl-impregnated activated carbon for entrained-flow capture of elemental mercury[J].Environmental Science & Technology,2002,36(20):4454-4459.
[21] 高洪亮,周劲松,骆仲泱,等.改性活性炭对模拟燃煤烟气中汞吸附的实验研究[J].中国电机工程学报,2007,27(8):26-30
[22] Tao Ye,Zhuo Yuqun,Zhang Liang,et al.Impact of flue gas species and temperature on mercury oxidation[J].Tsinghua Science & Technology,2010,15(4):418-425.
[23] Morency Joe.Zeolite sorbent that effectively removes mercury from flue gases[J].Filtration & Separation,2002,39(7):24-26.
[24] 丁峰,张军营,赵永椿,等.硫改性硅酸盐吸附剂脱汞性能的实验研究[J].华中科技大学学报:自然科学版,2011,39(11):116-119.
[25] Ghorishi S Behrooz,Sedman Charles B.Low concentration mercury sorption mechanisms and control by calcium-based sorbents:Application in coal-fired processes[J].Journal of the Air & Waste Management Association,1998,48(12):1191-1198.
[26] Am rhein G T,Holms M J,Baily R T,et al.Advanced emissions control development program,phase III-approved final report[R].DOE Contract DE-FC22-94PC94251,July,1999,5:209-215.
[27] G&M ARCADIS.Mercury control w ith calcium-based sorbents and oxidizing agents[J/OL].2005; Available from: http: //prod75-inter1.netl.doe.gov/technologies/coalpower/ew r/mercury/cont rol-tech/pubs/41183/41183R01.pdf.
[28] Wu Shaohua,Wang Shuai,Gao Jihui,et al.Interactions between mercury and dry FGD ash in simulated post combustion conditions[J].Journal of Hazardous Materials,2011,188(1):391-398.
[29] Sliger Rebecca N,Kram lich John C,Marinov Nick M.Towards the development of a chem ical kinetic model for the homogeneous oxidation of mercury by chlorine species[J].Fuel ProcessingTechnology,2000,65:423-438.
[30] Presto A A,Granite E J.Survey of catalysts for oxidation of mercury in flue gas[J].Environmental Science & Technology,2006,40(18):5601-5609.
[31] Niksa Stephen,Fujiwara Naoki.Predicting extents of mercury oxidation in coal-derived flue gases[J].Journal of the Air & Waste Management Association,2005,55(7):930-939.
[32] Schofield Keith.Let them eat fish:Hold the mercury[J].Chemical Physics Letters,2004,386(1):65-69.
[33] Schofield Keith.Mercury em ission chem istry:The sim ilarities or are they generalities of mercury and alkali combustion deposition processes[J].Proceedings of the Combustion Institute,2005,30(1):1263-1271.
[34] Dunham Grant E,DeWall Raymond A,Senior Constance L.Fixed-bed studies of the interactions between mercury and coal combustion fly ash[J].Fuel Processing Technology,2003,82(2-3):197-213.
[35] Granite Evan J,Pennline Henry W,Hargis Richard A.Novel sorbents for mercury removal from flue gas[J].Industrial & Engineering Chemistry Research,2000,39(4):1020-1029.
[36] Lee Chun W,Srivastava Ravi,Ghorishi S Behrooz,et al.Study of speciation of mercury under simulated SCR NOxem ission control conditions[C]//In Combined Power Plant Air Pollutant Control Mega Symposium,Washington D C,2003.
[37] Senior Constance L.Oxidation of mercury across selective catalytic reduction catalysts in coal–fired power plants[J].Journal of the Air & Waste Management Association,2006,56(1):23-31.
[38] Hocquel M.The Behaviour and Fate of Mercury in Coal-fired Power Plants w ith Downstream Air Pollution Control Devices[M].VDI Verlag:Dusseldorf,2004.
[39] Gutberlet H,Schluten A,Lienta A.SCR impacts on mercuryem issions on coal-fired boilers[C]//EPRI SCR Workshop,Memphis,TN,2000.
[40] Hargrove O W,Carey T R,Richardson C F,et al.Enhanced control of mercury and other HAP by innovative modifications to wet FGD processes[R].National Energy Technology Lab.,Pittsburgh,PA,and Morgantown,WV(US),1997.
[41] 赵永椿,张军营,刘晶,等.燃煤飞灰吸附脱汞能力的实验研究[J].中国科学:技术科学,2010,4:385-391.
[42] Pavlish John H,Sondreal Everett A,Mann M ichael D,et al.Status review of mercury control options for coal-fired power plants[J].Fuel Processing Technology,2003,82(2):89-165.
[43] Ghorishi S,Lee C,Jozewicz W,et al.Effects of fly ash transition metal content and flue gas HCl/SO2ratio on mercury speciation in waste combustion[J].Environ.Eng.Sci.,2005,22:221-231.
[44] Wu S J,Uddin M A,Sasaoka E,et al.Characteristics of the removal of mercury vapor in coal derived fuel gas over iron oxide sorbents[J].Fuel,2006,85:213-218.
[45] Guo Pan,Guo Xin,Zheng Chuguang.Computational insights into interactions between Hg species and α-Fe2O3(001)[J].Fuel,2011,90:1840-1846.
[46] Liu Tao,Guo Xin,Zheng Chuguang.Density functional study of Hg adsorption mechanisms on α-Fe2O3with H2S[J].Proceedings of the Combustion Institute,2013,34:2803-2810.
[47] Ji Lei,Sreekanth Pavani M,Sm irniotis Panagiotis G,et al.Manganese oxide/titania materials for removal of NOxand elemental mercury from flue gas[J].Energy & Fuels,2008,22:2299-2306
[48] 何胜.燃煤烟气汞催化氧化的实验和机理分析[D].杭州:浙江大学,2009.
[49] 刘晶.燃烧过程中痕量元素释放与反应机理的研究[D].武汉:华中科技大学,2007.
